سرطان بطانة الرحم: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
| سطر 254: | سطر 254: | ||
. |
. |
||
====سرطانة مختلطة أو لامتمايزة ==== |
====سرطانة مختلطة أو لامتمايزة ==== |
||
السرطانات المختلطة هي تلك التي تمتلك خلايا من النوع الأول وأخرى من النوع الثاني، وهي تشكل على الأقل 10% من |
السرطانات المختلطة هي تلك التي تمتلك خلايا من النوع الأول وأخرى من النوع الثاني، وهي تشكل على الأقل 10% من الورم<ref name=Hoffman827/>، وتشمل ورم مولر المختلط الخبيث الذي ينشأ من ظهارة بطانة الرحم وله مآل سيء<ref name="Cochrane 1011">{{cite journal | vauthors = Johnson N, Bryant A, Miles T, Hogberg T, Cornes P | title = Adjuvant chemotherapy for endometrial cancer after hysterectomy | journal = The Cochrane Database of Systematic Reviews | issue = 10 | pages = CD003175 | date = October 2011 | pmid = 21975736 | pmc = 4164379 | doi = 10.1002/14651858.CD003175.pub2 }}</ref>. |
||
وتشكل سرطانات بطانة الرحم اللامتمايزة أقل من 1-2% من حالات سرطان بطانة الرحم المشخصة، ويكون لها مآل أسوأ من مآل أورام الدرجة الثالثة، وبالنسبة لعلم الأنسجة فإن هذه الأورام تُظهر ملاءات من الخلايا الظهارية المتطابقة التي لا يمكن تمييزها عن بعضها. |
وتشكل سرطانات بطانة الرحم اللامتمايزة أقل من 1-2% من حالات سرطان بطانة الرحم المشخصة، ويكون لها مآل أسوأ من مآل أورام الدرجة الثالثة، وبالنسبة لعلم الأنسجة فإن هذه الأورام تُظهر ملاءات من الخلايا الظهارية المتطابقة التي لا يمكن تمييزها عن بعضها<ref name=Hoffman827/>. |
||
== المراجع == |
== المراجع == |
||
نسخة 11:13، 8 يوليو 2019
هذه مقالة أو قسم تخضع حاليًّا للتوسيع أو إعادة هيكلة جذريّة. إذا كانت لديك استفسارات أو ملاحظات حول عملية التطوير؛ فضلًا اطرحها في صفحة النقاش قبل إجراء أيّ تعديلٍ عليها. فضلًا أزل القالب لو لم تُجرَ أي تعديلات كبيرة على الصفحة في آخر شهر. لو كنت أنت المحرر الذي أضاف هذا القالب وتُحرر المقالة بشكلٍ نشطٍ حاليًّا، فضلًا تأكد من استبداله بقالب {{تحرر}} في أثناء جلسات التحرير النشطة. آخر من عدل المقالة كان دنيا (نقاش | مساهمات) منذ 4 سنين (تحديث) |
| سرطان الرحم | |
|---|---|
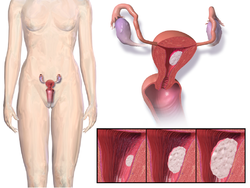
موقع ونمو سرطان الرحم.
| |
| معلومات عامة | |
| الاختصاص | علم الأورام، طب النساء |
| من أنواع | سرطان الرحم، وانتباذ بطاني رحمي، ومرض |
| الموقع التشريحي | بطانة الرحم[1] |
| الأسباب | |
| عوامل الخطر | السمنة، التعرض المفرط لهرمون الإستروجين، ارتفاع ضغط الدم، السكري، تاريخ العائلة[2][3] |
| المظهر السريري | |
| البداية المعتادة | بعد سن اليأس[4] |
| الأعراض | نزيف المهبل، عسر التبول أو عسر الجماع، ألم حوضي[2] |
| الإدارة | |
| التشخيص | خزعة بطانة الرحم[2] |
| العلاج | استئصال الرحم بطريق البطن، العلاج الإشعاعي، العلاج الكيميائي، العلاج الهرموني[6] |
| المآل | معدل البقاء على قيد الحياة لمدة خمس سنوات ~ 80% (الولايات المتحدة)[5] |
| الوبائيات | |
| انتشار المرض | 3.8 مليون (الإجمالي المتأثر في عام 2015)[7] |
| الوفيات | 89,900 (2015)[8] |
| تعديل مصدري - تعديل | |
سرطان بطانة الرحم (بالإنجليزية: Endometrial cancer) هو سرطان ينشأ من بطانة الرحم (الغشاء المبطن للرحم)،[2] يكون نتيجة للنمو غير الطبيعي للخلايا التي لديها القدرة على الغزو أو الانتشار إلى أجزاء أخرى من الجسم،[9] وتكون العلامة الأولية غالبًا نزيف مهبلي غير مرتبط بفترة الحيض،[2] كما يشمل أعراض أخرى مثل عسر التبول أو عسر الجماع أو ألم الحوض،[2] ويُعد سرطان بطانة الرحم أكثر شيوعًا بعد انقطاع الطمث.[4]
تُعاني حوالي 40% من الحالات المرضية من البدانة،[3] ويرتبط سرطان بطانة الرحم أيضًا بالتعرض المفرط لهرمون الإستروجين وارتفاع ضغط الدم ومرض السكري،[2] وبالرغم من أن تناول الإستروجين بمفرده يزيد من خطر الإصابة بسرطان بطانة الرحم فإن تناول كل من الإستروجين والبروجستيرون معًا -كما هو الحال في معظم حبوب منع الحمل- يقلل من المخاطر،[2][3] ويرتبط ما بين 2- 5% من الحالات بالجينات الموروثة من الآباء،[3] وفي بعض الأحيان يُشار إلى سرطان بطانة الرحم على أنه "سرطان الرحم" على الرغم من أنه يختلف عن أشكال أخرى من سرطان الرحم مثل سرطان عنق الرحم والساركوما الرحمية ومرض ورم الأرومة الغاذية الحملي،[10] ويُعد النوع الأكثر شيوعًا من سرطان بطانة الرحم هو سرطانة شبيهة ببطانة الرحم والذي يمثل أكثر من 80% من الحالات،[3] يتم تشخيص سرطان بطانة الرحم عادة عن طريق خزعة بطانية رحمية أو عن طريق أخذ عينات خلال عملية تعرف باسم توسيع وكحت الرحم،[2] وتُعتبر لطاخة عنق الرحم ليست كافية عادة لإظهار سرطان بطانة الرحم،[6] لا يتطلب فحص منتظم للأشخاص المعرضين لدرجة طبيعية من خطر الإصابة بسرطان بطانة الرحم.[11]
يُعتبر الخيار العلاجي الرئيسي لسرطان بطانة الرحم هو استئصال الرحم بطريق البطن (عملية جراحية لإزالة الرحم بشكل كلي) مع إزالة قناتي فالوب والمبيضين على كلا الجانبين، وتدعى هذه العملية استئصال البوق والمبيض على كلا الجانبين،[6] وفي الحالات الأكثر تقدمًا يمكن أيضًا التوصية بالعلاج الإشعاعي أو العلاج الكيميائي أو العلاج الهرموني،[6] وإذا تم تشخيص المرض في مرحلة مبكرة فإن النتيجة ستكون إيجابية[6] حيث يصل معدل البقاء على قيد الحياة لمدة خمس سنوات في الولايات المتحدة لأكثر من 80٪.[5]
في عام 2012 أصابت سرطانات بطانة الرحم حديثًا 320,000 امرأة وتسببت في وفاة 76,000 شخصًا،[3] مما جعل هذا المرض ثالث أكثر الأسباب شيوعًا للوفاة في السرطانات التي تؤثر فقط على النساء بعد سرطان المبيض وسرطان عنق الرحم،[3] وهو أكثر شيوعًا في العالم المتقدم[3] ويُعَد أكثر أنواع السرطانات شيوعًا في الجهاز التناسلي الأنثوي في البلدان المتقدمة،[6] وقد ارتفعت معدلات سرطان بطانة الرحم في عدد من البلدان بين عامي 1980 و 2010[3] ويعتقد أن هذا يرجع إلى زيادة أعداد كبار السن وزيادة معدلات السمنة.[12]
الأعراض والعلامات
يحدث نزيف مهبلي أو تبقيع في النساء بعد سن اليأس في 90% من سرطان بطانة الرحم،[4][14][15] ويعتبر النزيف شائعًا بشكل خاص مع السرطانة الغدية التي تحدث في ثلثي الحالات،[4][11] كما أنه قد تكون الدورة الشهرية غير الطبيعية أو الطويلة جدًا أو الغزيرة أو المتكررة قبل سن اليأس علامة على الإصابة بسرطان بطانة الرحم.[11]
ليس من الشائع حدوث أعراض أخرى غير النزيف، وتشمل الأعراض الأخرى إفرازات مهبلية بيضاء رقيقة أو صافية في النساء بعد سن اليأس، حيث يُظهر المرض الأكثر تقدمًا أعراضًا أو علامات أكثر وضوحًا يمكن اكتشافها في الفحص البدني، وقد يتضخم الرحم أو قد ينتشر السرطان مما يسبب ألمًا أسفل البطن أو تشنجًا في الحوض،[11] ويُعد كل من عسر الجماع وعسر التبول علامات أقل شيوعًا في سرطان بطانة الرحم،[10] وقد يمتلئ الرحم أيضًا بالقيح (مما يُسبب بما يعرف ب تقيح الرحم)،[16] من بين النساء اللائي يعانين من هذه الأعراض الأقل شيوعًا (الإفرازات المهبلية وألم الحوض والقيح) تعاني 10-15% منهن من السرطان.[17]
عوامل الخطر
تشمل عوامل الخطر لسرطان بطانة الرحم: السمنة وداء السكري وسرطان الثدي واستخدام عقار تاموكسيفين وعدم إنجاب طفل وسن اليأس المتأخر والمستويات العالية من الإستروجين والتقدم في السن،[16][17] وتبين دراسات الهجرة -التي تفحص التغير في خطر الإصابة بالسرطان بين السكان الذين ينتقلون بين بلدان ذات معدلات مختلفة من السرطان- أن هناك بعض العناصر البيئية مسببة لسرطان بطانة الرحم،[18] لكن عوامل الخطر البيئية هذه غير محددة بشكل جيد.[19]
الهرمونات
تتضمن معظم عوامل الخطر لسرطان بطانة الرحم مستويات عالية من هرمون الاستروجين، ويُعتقد أن 40% من الحالات مرتبطة بالبدانة؛[3] فبسبب السمنة يزيد فائض الأنسجة الدهنية الذي بدوره يُزيد عملية تحويل الأندروستندويون إلى إسترون هو الإستروجين، وتؤدي المستويات العالية من الإسترون في الدم إلى نقصان أو عدم وجود الإباضة مما يعرض بطانة الرحم لمستويات عالية باستمرار من هرمون الإستروجين،[12][20] كما تؤدي السمنة إلى ضعف التخلص من هرمون الاستروجين من الدم،[20] وترتبط متلازمة تكيس المبايض (PCOS) -التي تسبب أيضًا عدم انتظام أو عدم وجود إباضة- بزيادة معدلات سرطان بطانة الرحم للأسباب نفسها مثل السمنة،[18] وعلى وجه التحديد فإنه يُعتبر كلٌ من السمنة وسكري النوع الثاني ومقاومة الإنسولين عوامل خطر للنوع الأول من سرطان بطانة الرحم،[21] حيث تزيد السمنة من خطر الإصابة بسرطان بطانة الرحم بنسبة 300-400٪.[22]
يعتبر العلاج الإعاضة بالإستروجين أثناء سن اليأس عندما يكون غير متوازن (أو "معاكس") لنشاط البروجستين عامل خطر آخر؛ حيث أن الجرعات العالية أو فترات العلاج الطويلة من الإستروجين تحمل مخاطر أكبر للإصابة بسرطان بطانة الرحم،[20] وتُعد النساء ذوات الوزن المنخفض أكثر عرضة لخطر زيادة الإستروجين غير المقاوم،[3] ومن عوامل الخطر أيضًا زيادة فترة الخصوبة وذلك إما بفعل بدء الإحاضة في وقت مبكر أو بسبب تأخر سن اليأس،[23] حيث يزيد الاستروجين غير المقاوم من خطر الإصابة بسرطان بطانة الرحم بنسبة 2 إلى 10 أضعاف، وهذا يتوقف على الوزن وطول مدة العلاج،[3] وفي الرجال العابرين جنسيًا الذين يأخذون التستوستيرون ولم يقوموا باستئصال الرحم فإن تحويل هرمون التستوستيرون إلى هرمون الاستروجين عبر الأندروستنديون قد يؤدي إلى ارتفاع خطر الإصابة بسرطان بطانة الرحم.[24]
الجينات

يمكن أن تُسبب الاضطرابات الوراثية أيضًا سرطان بطانة الرحم، وبشكٍل عام فإن الأسباب الوراثية تسهم في 2-10% من حالات سرطان بطانة الرحم،[3][25] وتسبب متلازمة لينش (السرطان الوراثي القولوني المستقيمي اللاسليلي) سرطان بطانة الرحم أيضًا وخاصة قبل سن اليأس وهذه المتلازمة عبارة عن اضطراب وراثي صبغي جسمي سائد يؤدي بشكل رئيسي إلى سرطان القولون والمستقيم، وتعاني النساء المصابات بمتلازمة لينش من 40–60% من خطر الإصابة بسرطان بطانة الرحم وهو أعلى من خطر الإصابة بسرطان القولون والمستقيم (الأمعاء الغليظة) أو سرطان المبيض.[18] ينمو كلٌّ من سرطان المبيض وبطانة الرحم في وقت واحد في 20% من الناس. يحدث سرطان بطانة الرحم دائمًا قبل سرطان القولون، في المتوسط، قبل 11 عامًا.[19] يأتي التسرطن في متلازمة لينش من طفرة في الجينات MLH1 و / أو MLH2: الجينات التي تشارك في عملية إصلاح عدم التطابق، وتسمح للخلية بتصحيح الأخطاء في الحمض النووي.[18] وتشمل الجينات الأخرى المتحورة في متلازمة لينش MSH2، و MSH6، و PMS2، والتي تعد أيضًا جينات لإصلاح عدم التطابق. تمثل النساء المصابات بمتلازمة لينش 2–3% من حالات سرطان بطانة الرحم. ترفع بعض المصادر هذه النسبة لتصل إلى 5 ٪.[19][22] بناءً على طفرة هذه الجينات، فإن النساء المصابات بمتلازمة لينش لديهن مخاطر مختلفة لسرطان بطانة الرحم. مع طفرات MLH1، فإن نسبة الخطر 54 ٪. مع MSH2 21%؛ ومع MSH6، 16 ٪.[26]
تعتبر النساء ذوات التاريخ العائلي لسرطان بطانة الرحم أكثر عرضة للخطر،[10] لا يتسبب جينان بروتين BRCA1 وBRCA2 -المرتبطان ببعض أكثر أنواع سرطانات النساء الأخرى شيوعًا- بسرطان بطانة الرحم، لكن هناك ارتباط واضح مع هذه الجينات ويُعزى ذلك إلى استخدام عقار تاموكسيفين في حالات سرطان الثدي والمبيض وهو دواء يمكن أن يتسبب بحدوث سرطان بطانة الرحم،[18] يمكن لمتلازمة كاودن الوراثية أن تسبب سرطان بطانة الرحم؛ حيث تعاني النساء المصابات بهذا الاضطراب من 5 إلى 10% من خطر الإصابة بسرطان بطانة الرحم[3] مقارنة بنسبة 2 إلى 3% عند النساء غير المصابات.[19]
كما وُجِد أن التباين الوراثي الشائع يؤثر على معدل خطورة سرطان بطانة الرحم عن طريق دراسات ارتباط الجينوم على نطاق واسع،[27][28] حيث ارتبطت 16 منطقة جينومية بسرطان بطانة الرحم، كما فسرت المتفاوتات الشائعة نسبة تصل إلى 7% من المخاطر المتعلقة بالفصيلة.[28]
اضطرابات صحية أخرى
تزيد بعض العلاجات لأشكال أخرى من السرطان من خطر الاصابة بسرطان بطانة الرحم مدى الحياة، حيث يكون خطر الإصابة في الأساس 2-3 ٪،[19] وقد ارتبط التاموكسيفين -دواء يستخدم لعلاج سرطان الثدي الإيجابي للإستروجين- بسرطان بطانة الرحم في حوالي 0.1% من المستخدمات للعقار خاصة النساء المسنات، ولكن تفوق فوائد التاموكسيفين والنجاة من الإصابة بسببه خطر الاصابة بسرطان بطانة الرحم،[29] وقد وُجِد أن دورة استخدام مدتها عام إلى عامين لعقار التاموكسيفين تضاعف خطر الإصابة بسرطان بطانة الرحم تقريبًا، ودورة استخدام مدتها خمس سنوات تضاعف خطر الأصابة أربع مرات،[23] بينما لم يرفع الرالوكسيفين -دواء مشابه- من خطر الإصابة بسرطان بطانة الرحم،[30] وقد كانت الإصابة بسرطان المبيض في السابق عامل خطر لسرطان بطانة الرحم،[31] وكذلك العلاج الإشعاعي السابق لمنطقة الحوض،وعلى وجه التحديد ترتبط أورام الخلية الحبيبية في المبيض و الورم القرابي بسرطان بطانة الرحم.
وقد لوحظ أيضًا انخفاض وظائف المناعة في سرطان بطانة الرحم،[16] ويعد ارتفاع ضغط الدم عامل خطر أيضًا[22] ولكن قد يكون هذا بسبب ارتباطه بالبدانة،[26] ويرتبط الجلوس بانتظام لفترات طويلة بارتفاع معدل الوفيات بسبب سرطان بطانة الرحم، وممارسة التمارين الرياضية لا تُزيل خطر الإصابة لكنها تقلل منه.[32]
عوامل الحماية
يُعد كل من التدخين واستخدام البروجستين عاملين وقائيين ضد سرطان بطانة الرحم؛ حيث يوفر التدخين الحماية عن طريق تغيير التمثيل الغذائي للاستروجين وتعزيز فقدان الوزن وانقطاع الطمث المبكر، ويستمر هذا التأثير الوقائي لفترة طويلة حتى بعد توقف التدخين، بينما يتواجد البروجستين في حبوب منع الحمل المركبة واللولب الرحمي الهرموني (IUD)،[18][33] فتعمل حبوب منع الحمل المركبة على تقليل المخاطر كلما طال استخدامها: حيث تقلل المخاطر بنسبة 56% بعد أربع سنوات، وبنسبة 67% بعد ثماني سنوات، وبنسبة 72% بعد اثني عشر عامًا، ويستمر هذا الحد من المخاطر لمدة خمسة عشر عامًا على الأقل بعد إيقاف استخدام موانع الحمل،[30] وقد تحتاج النساء البدينات إلى جرعات أعلى من البروجستين لحمايتهن،[33] ويُعتبر إنجاب أكثر من خمسة رضع هو أيضًا عامل وقائي،[16] كما أن إنجاب طفل واحد على الأقل يقلل من الخطر بنسبة 35٪، وتؤدي الرضاعة الطبيعية لأكثر من 18 شهرًا إلى تقليل المخاطر بنسبة 23٪، بالإضافة إلى أن زيادة النشاط البدني يقلل من مخاطر الفرد بنسبة 38-46٪، وهناك أدلة أولية على أن تناول الصويا يُعد عامل وقائي.[30]
الفيزيولوجيا المرضية
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
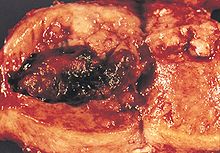
يتكون سرطان بطانة الرحم عند وجود أخطاء في نمو خلايا بطانة الرحم الطبيعية، وعادة عندما تنمو الخلايا وتكبر أو تتضرر فإنها تموت وتأخذ مكانها خلايا جديدة، يبدأ السرطان عندما تتشكل خلايا جديدة لا حاجة لها بالإضافة إلى عدم موت الخلايا القديمة أو التالفة كما ينبغي، وغالباً ما يشكل تراكم الخلايا الإضافية كتلة من النسيج تسمى الورم، ويكون لدى هذه الخلايا السرطانية غير الطبيعية العديد من التشوهات الجينية التي تؤدي إلى نموها بشكل مفرط.[10]
في 10-20% من سرطانات بطانة الرحم -ومعظمهم من الدرجة الثالثة (أعلى تصنيف نسيجي)- توجد الطفرات في الجينات الكابحة للورم، وعادة تكون جينات بي53 أو PTEN، وفي 20% من حالات فرط تنسج بطانة الرحم و50% من السرطانات الشبيهة ببطانة الرحم يعاني جين PTEN من طفرة فقدان الوظيفة أو من طفرة لاغية، مما يجعله أقل فعالية أو غير فعال تمامًا،[35] تؤدي خسارة وظيفة PTEN إلى زيادة تنظيم مسار PI3k / Akt / mTOR مما يؤدي إلى نمو الخلايا،[22] كما يمكنه إما أن ينشط مسار بي53 نشاطًا زائدًا أو يثبطه في سرطان بطانة الرحم، ولكن عندما يتواجد جين بي53 المتحور بشكلٍ مفرط فإن السرطان يميل إلى أن يكون عدواني بشكل خاص،[35] ترتبط طفرات بي53 وعدم استقرار الكروموسومات بالسرطانات المصلية التي تميل أن تشبه سرطان المبيض وقناة فالوب، كما يُعتقد أن السرطانات المصلية تتطور من ورم داخل ظهارة البطانة الرحمية.[22]
ترتبط طفرات فقدان وظيفة PTEN و p27 بمآل جيد خاصة عند النساء البدينات، حيث يظهر الجين الورمي Her2 / neu -الذي يشير إلى سوء مآل الورم- في 20% فقط من السرطانات الشبيهة ببطانة الرحم والسرطانات المصلية، وقد عُثر على طفرات CTNNB1 (بيتا كاتينين، جين النسخ) في 14-44% من سرطانات بطانة الرحم وقد تشير إلى مآل جيد ولكن البيانات غير واضحة في هذا الخصوص،[35] توجد طفرات بيتا كاتنين بشكل شائع في سرطانات بطانة الرحم مع خلايا حرشفية،[22] كما عٌثر على طفرات جين FGFR2 في حوالي 10% من سرطانات بطانة الرحم ولكن مآلهم غير واضح،[35]وقد وُجد أن جين SPOP -جين آخر كابح للأورام- يتحور في بعض حالات سرطان بطانة الرحم: حيث ثَبُت أن 9% من سرطانات بطانة الرحم ذات الخلايا الصافية و8% من سرطانات بطانة الرحم المصلية لها طفرات في هذا الجين.[36]
تميل سرطانات النوع الأول والثاني (الموضحة أدناه) إلى حدوث طفرات مختلفة، فيحمل جين ARID1A في الغالب طفرة نقطية في سرطان بطانة الرحم من النوع الأول، ويتحور أيضًا في 26% من سرطانات بطانة الرحم ذات الخلايا الصافية و 18% من السرطانات المصلية، وفي الغالب يوجد إسكات الجين والطفرات النقطية للعديد من الجينات في سرطان بطانة الرحم النوع الأول،[3][34] بينما تكون الطفرات في الجينات الكابتة للورم شائعة في سرطان بطانة الرحم من النوع الثاني،[3] أما جين PIK3CA فإنه يتحور عادة في كل من النوع الأول والنوع الثاني،[34] وفي النساء المصابات بسرطان بطانة الرحم المصاحب لمتلازمة لينش يكون اضطراب التكرارات المترادفة القصيرة شائعًا.[22]
يعتبر حدوث فرط تنسج بطانة الرحم (فرط نمو خلايا بطانة الرحم) عامل خطر مهم لأن فرط التنسج يمكن أن يتطور في الغالب إلى سرطانة غدية على الرغم من أن السرطان يمكن أن يتطور دون حدوث فرط التنسج،[20] ففي غضون عشر سنوات تتطور 8% إلى 30% من حالات تضخم بطانة الرحم اللانمطية إلى سرطان، في حين أن 1-3% من حالات فرط التنسج النمطية يحدث لها ذلك،[37] ويتميز التضخم اللانمطى بحدوث تشوهات واضحة في نوى الخلايا، كما يُشار أيضًا إلى فرط تنسج بطانة الرحم محتمل التسرطن باسم ورم داخل ظهارة البطانة الرحمية،[38] يمكن للطفرات في جين KRAS أن تسبب فرط تنسج بطانة الرحم وبالتالي سرطان بطانة الرحم من النوع الأول،[35] ويحدث فرط تنسج بطانة الرحم عادة بعد سن الأربعين،[10] كما يحدث خلل التنسج الغشائي البطاني مع زيادة مفرطة في بي53 ويتطور إلى سرطان مصلي.[16]
التشخيص
يتم تشخيص سرطان بطانة الرحم أولًا عن طريق الفحص البدني أو خزعة بطانية رحمية أو توسيع وكشط الرحم (إزالة أنسجة بطانة الرحم: D & C)، ثم يُفحص هذا النسيج تشريحيًا لاكتشاف خصائص السرطان، وإذا تم العثور على السرطان فإنه يمكن إجراء التصوير الطبي لمعرفة ما إذا كان السرطان قد انتشر أو غزا الأنسجة.[39]
الفحص
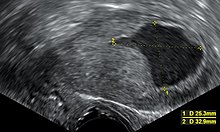

لا يوصَى بالتنظير الشعاعي الروتيني للأشخاص الذين لا يُعانون من الأعراض لأنه يمكن علاج المرض في مراحل أعراضه الأولية، وبدلًا من ذلك فإن النساء -خاصة من وصلت إلى سن اليأس منهن- يجب أن تكون على دراية بأعراض وعوامل خطورة سرطان بطانة الرحم، ويُعد اختبار التنظير الشعاعي لعنق الرحم (مثل لطاخة بابا نيكولاو) طريقة غير مفيدة لتشخيص المرض لأن اللطاخة تكون عادية 50% من الوقت،[11] بينما يتم استخدام لطاخة بابا نيكولاو لاكتشاف المرض الذي انتشر بالفعل إلى عنق الرحم،[10] وتكون نتائج فحص الحوض عادية باستمرار خاصة في المراحل الأولية من المرض، كما يحدث تغيرات في حجم أو شكل أو اتساق الرحم أو الأجزاء المجاورة والداعمة له عندما يكون المرض في مراحله المتطورة،[11] وقد وُجِد أن ضيق عنق الرحم يُعد إشارة إلى وجود سرطان بطانة الرحم عند تجمُّع قيح أو دم داخل الرحم مما يؤدي إلى ما يعرف ب تقيح الرحم أو تدمي الرحم.[14]
من الضروري أن تبدأ النساء المصابات بمتلازمة لينش الحصول على تنظير شعاعي خزعي سنويًا بدايةً من عمر 35، لكن تختار بعض السيدات القيام باستئصال الرحم والمبيض وقناة فالوب لتقليل احتمالية الإصابة بسرطان بطانة الرحم أو سرطان المبيض.[11]
ازداد استخدام الموجات فوق الصوتية عبر المهبل لفحص سمك بطانة الرحم في النساء اللاتي يعانين من نزيف بعد فترة اليأس في الولايت المتحدة مما يساعد على تشخيص سرطان بطانة الرحم،[40] بينما في المملكة المتحدة يتم استخدام كل من الخزعة البطانية الرحمية والموجات فوق الصوتية عبر المهبل بالاقتران مما يُشكِّل مستوى الرعاية لتشخيص سرطان بطانة الرحم،[16] ويُمكن أن يساعد تجانس الأنسجة المرئية في الموجات فوق الصوتية عبر المهبل في تحديد ما إذا كان سمك بطانة الرحم سرطانيًا، وتكون نتائج الموجات فوق الصوتية وحدها غير حاسمة في حالات سرطان بطانة الرحم؛ لذلك يتم استخدام وسيلة أخرى مثل الخزعة البطانية الرحمية بالاقتران معها، بينما تكون دراسات التصوير الأخرى ذات استخدام محدود، فتُستخدم الآشعة المقطعية في التصوير قبل العمليات الجراحية للأورام التي تظهر بصورة متقدمة في الاختبارات البدنية أو لديها أنواع فرعية عالية الخطورة (معدل مرتفع من الانبثاث)،[41] كما يمكن استخدام الآشعة المقطعية أيضًا في فحص الأمراض التي تقع خارج الحوض،[16] ويُستخدم التصوير بالرنين المغناطيسي في تحديد إذا ما انتشر السرطان إلى عنق الرحم أو إذا كان عبارة عن سرطانة غدية داخل عنق الرحم،[41] أيضًا يتم استخدام التصوير بالرنين المغناطيسي لفحص العقد الليمفاوية المُجاورة.[16]
يتم استخدام كل من توسيع وتجريف الرحم أو الخزعة البطانية الرحمية للحصول على عينة نسيج للفحص الهستولوجي، وتُعد الخزعة البطانية الرحمية هي أقل الوسائل تغلغلًا في الجسم لكنها قد لا تعطي نتائج حاسمة كل مرة، يُظهر تنظير الرحم التشريح العياني لبطانة الرحم فقط والذي لا يكشف عن السرطان غالبًا ولذلك لا يتم استخدامه إذا لم يقترن بالخزعة البطانية الرحمية،[41] لكن يمكن استخدامه في تأكيد تشخيص السرطان، وقد أشارت أدلة جديدة أن توسيع وتجريف الرحم لديه معدل سلبي خاطىء أكثر من الخزعة البطانية الرحمية.[22]
قبل بداية العلاج تتم التوصية بالعديد من الفحوصات الأخرى والتي تشمل: آشعة سينية على الصدر واختبارات وظائف الكبد واختبارات وظائف الكلى[22] واختبار مستويات الواصم الورمي CA-125 الذي تزداد نسبته في حالة الإصابة بسرطان بطانة الرحم.[10]
التصنيف
ربما تكون سرطانات بطانة الرحم مُشتقة من الخلايا الظهارية (وتُعرف ب السرطانات)، أو مُشتقة من أورام خلايا ظهارية وجذعية لحمية متوسطة مختلطة (تُعرف ب ساركوما سرطانية)، أو مُشتقة من أورام خلايا جذعية لحمية متوسطة[42].
يُعد التصنيف التقليدي لسرطانات بطانة الرحم قائمًا على:
- إما المظاهر السريرية ومظاهر الغدد الصماء (كالنوع الأول والثاني)
- أو على صفات علم أمراض الأنسجة (كالخلية الصافية أو الشبيهة ببطانة الرحم أو المصلية)
بعض الأورام تكون صعبة التصنيف أو لديها صفات تتداخل مع أكثر من نوع، فمثلًا يكون للأورام الشبيهة ببطانة الرحم ذات الدرجة العالية صفات كل من النوع الأول والثاني[42].
سرطانة
الغالبية العُظمى من حالات سرطان بطانة الرحم تكون عبارة عن سرطانة (وفي الغالب تكون سرطانة غدية)، مما يعني أنها تنشأ من الطبقة المفردة من الخلايا الظهارية التي تبطن بطانة الرحم وتُكَوِّن غددها، ويوجد العديد من الأنواع الفرعية المجهرية لسرطانة بطانة الرحم، تُقسَّم هذه الأنواع إلى نوعين رئيسيين هما: النوع الأول والنوع الثاني، ويعتمد التقسيم على المظاهر السريرية ومنشأ المرض، كما يتميز كل من النوعين عن الآخر[11].
- النوع الأول من سرطانة بطانة الرحم يحدث في أغلب الأحيان قبل أو تقريبًا في توقيت انقطاع الطمث، وفي الولايات المتحدة يكون النوع الأول أكثر شيوعًا عند النساء البيضاوات خاصةً من لديهن تاريخ سابق بفرط تنسج بطانة الرحم، ويكون النوع الأول من سرطانات بطانة الرحم غالبًا منخفض الدرجة ويغزو أجزاء ضئيلة جدًا من عضلة الرحم، ومرتبطًًا بالتعرض للاستروجين بالإضافة إلى أنه يتحسن بدرجة جيدة مع العلاج[11]، ويُشكِّل النوع الأول من السرطانات 75-90% من حالات سرطان بطانة الرحم[16][43].
- بينما يحدث النوع الثاني من السرطانات غالبًا في الأشخاص الأكبر سنًا بعد انقطاع فترة الطمث، و في الولايات المتحدة يكون أكثر شيوعًا في السيدات السمراوات، ولا يرتبط بالتعرض الزائد للاستروجين أو التاريخ المرضي لفرط تنسج بطانة الرحم، ويكون النوع الثاني في أغلب الأحيان ذا درجة مرتفعة حيث يقوم بغزو أجزاء عميقة من عضلة الرحم من نوع الخلايا الصافية أو المصلية، كما أنه يحمل تشخيصًا أكثر فقرًا، فعند تقييم الأعراض يمكن أن يظهر في البداية سرطان المبيض الظهاري[11][43]، وبعد ذلك يتطور ليصبح النوع الأول من الأورام وأكثر عدوانية مع العديد من مخاطر النكس والانبثاث[16].
سرطانة غدية شبيهة ببطانة الرحم
في السرطانات الغدية الشبيهة ببطانة الرحم تنمو الخلايا السرطانية في أنماط تُشبه بطانة الرحم الطبيعية، ويصاحبها وجود الكثير من الغدد الجديدة المتكونة من خلايا الظهارة العمادية مع بعض الأنوية غير الطبيعية، ويكون للسرطانات الغدية الشبيهة ببطانة الرحم ذات الدرجة المنخفضة خلايا متمايزة جيدًا لا تغزو عضل الرحم وتُرى بجانب فرط تنسج بطانة الرحم، وتتكون غدد الأورام بالقرب من بعضها البعض بدون الأنسجة (اللحمية) التي تفصلها عادةً، بينما يكون للسرطانات الغدية الشبيهة ببطانة الرحم ذات الدرجة الأعلى خلايا أقل تمايزًا وأوراق أكثر صلابة من الخلايا السرطانية التي لا تنتظم في غدد، كما أنها تكون مرتبطة بضمور بطانة الرحم، ويوجد العديد من الأنواع الفرعية للسرطانات الغدية الشبيهة ببطانة الرحم تحمل نفس المآل، وتشمل متغيرات الخلايا المهدبة والمفرزة والغدية الخملية، ويوجد أيضًا نوع فرعي يتَّصف بتمايز حرشفي، وبعض السرطانات الغدية الشبيهة ببطانة الرحم تحمل بؤرًا من السرطانة المخاطية[44].
تحدث الطفرات الجينية الأكثر شيوعًا المرتبطة بالسرطانة الغدية الشبيهة ببطانة الرحم في جينات PTEN المثبط للورم وPIK3CA وهو كيناز وأيضًا جينات KRAS وهو عبارة عن جي تي بيز يقوم بتوصيل الإشارة وكذلك جينات CTNNB1 التي تشارك في تلاصق واستشعار الخلية، ويُعد جين CTNNB1 (بيتا كاتنين) هو الجين الأكثر شيوعًا للتعرض للطفرات في النوع الفرعي الحرشفي من السرطانة الغدية لبطانة الرحم[45].
سرطانة مصلية
تُعد السرطانة المصلية ورمًا بطانيًا رحميًا من النوع الثاني حيث يُشكِّل 5-10% من حالات سرطان بطانة الرحم المُشَخصة، وهو شائعًا بعد انقطاع الطمث لدى السيدات اللاتي تُعانين من ضمور بطانة الرحم، وأيضًا هو شائع لدى السيدات السوداوات، ويكون مرض سرطانة بطانة الرحم المصلية عدوانيًا ويغزو غالبًا عضل الرحم ثم ينتقل خلال الصفاق (حيثُ يظهر على هيئة كعكة ثربية) أو الجهاز الليمفاوي، وفيما يخُص علم الأنسجة فإن هذا المرض يظهر معه أنوية لانموذجية وتراكيب حليمية، وعلى عكس السرطانات الغدية الشبيهة ببطانة الرحم التي يظهر فيها خلايا عمودية فإنه يظهر في سرطانة بطانة الرحم المصلية خلايا مستديرة، حوالي 30% من حالات سرطانة بطانة الرحم المصلية تمتلك أجسامًا رملية[20][43]، وتنتشر السرطانات المصلية بصورة مُختلفة عن أغلب أنواع سرطانات بطانة الرحم الأخرى؛ حيثُ يمكنها الانتشار خارج الرحم بدون غزو عضل الرحم[20]. وتمتاز الطفرات الجينية التي تُرى في حالات السرطانات المصلية بعدم الاستقرار الصبغي، وتحدث في الجين المثبط للورم TP53[45].
سرطانة الخلية الصافية
تُعد سرطانة الخلايا الصافية ورمًا بطانيًا رحميًا من النوع الثاني، وهي تُشَكل أقل من 5% من حالات سرطانة بطانة الرحم المُشخصة، وكمثل سرطانة الخلايا المصلية فإن سرطانة الخلايا الصافية أيضًا تكون عدوانية وتحمل مآلًا سيئًا، وبالنسبة لعلم الأنسجة فهي تميزها صفات شائعة في كل الخلايا الصافية: حيث يكون السيتوبلازم واضحًا مسماويًا عند صبغه بصبغة H&E، وتكون أغشية الخلايا متميزة ومرئية[43]، كما يكون نظام إشارة خلية p53 غير نشطًا في سرطانة الخلايا الصافية لبطانة الرحم[16]، ويكون هذا الشكل من السرطانات أكثر شيوعًا في النساء اللاتي تعانين من انقطاع الطمث[20] .
سرطانة مخاطية
تُعد السرطانة المخاطية شكلًا نادرًا لسرطان بطانة الرحم؛ حيث تشكِّل أقل من 1-2% من حالات سرطانة بطانة الرحم المشخصة، وتكون السرطانة المخاطية في أغلب الأحيان مرحلة أولي ودرجة أولى مما يسمح لها بتحسن جيد، وهي تمتلك خلايا عمودية متمايزة جيدًا ومنظمة على شكل غدد، بالإضافة إلى وجود الموسين المميز في السيتوبلازم، ويجب التمييز بين السرطانة المخاطية والسرطانة الغدية العنقية[44] .
سرطانة مختلطة أو لامتمايزة
السرطانات المختلطة هي تلك التي تمتلك خلايا من النوع الأول وأخرى من النوع الثاني، وهي تشكل على الأقل 10% من الورم[44]، وتشمل ورم مولر المختلط الخبيث الذي ينشأ من ظهارة بطانة الرحم وله مآل سيء[46]. وتشكل سرطانات بطانة الرحم اللامتمايزة أقل من 1-2% من حالات سرطان بطانة الرحم المشخصة، ويكون لها مآل أسوأ من مآل أورام الدرجة الثالثة، وبالنسبة لعلم الأنسجة فإن هذه الأورام تُظهر ملاءات من الخلايا الظهارية المتطابقة التي لا يمكن تمييزها عن بعضها[44].
المراجع
- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ أ ب ت ث ج ح خ د ذ "General Information About Endometrial Cancer". National Cancer Institute. 22 أبريل 2014. مؤرشف من الأصل في 3 سبتمبر 2014. اطلع عليه بتاريخ 3 سبتمبر 2014.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ International Agency for Research on Cancer (2014). World Cancer Report 2014. منظمة الصحة العالمية. Chapter 5.12. ISBN:978-92-832-0429-9.
- ^ أ ب ت ث Kong، A؛ Johnson، N؛ Kitchener، HC؛ Lawrie، TA (18 أبريل 2012). "Adjuvant radiotherapy for stage I endometrial cancer". The Cochrane Database of Systematic Reviews. ج. 4: CD003916. DOI:10.1002/14651858.CD003916.pub4. PMC:4164955. PMID:22513918.
- ^ أ ب "SEER Stat Fact Sheets: Endometrial Cancer". المعهد الوطني للسرطان. مؤرشف من الأصل في 6 يوليو 2014. اطلع عليه بتاريخ 18 يونيو 2014.
- ^ أ ب ت ث ج ح "Endometrial Cancer Treatment (PDQ®)". National Cancer Institute. 23 أبريل 2014. مؤرشف من الأصل في 3 سبتمبر 2014. اطلع عليه بتاريخ 3 سبتمبر 2014.
- ^ GBD 2015 Disease and Injury Incidence and Prevalence، Collaborators. (8 أكتوبر 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. ج. 388 ع. 10053: 1545–1602. DOI:10.1016/S0140-6736(16)31678-6. PMC:5055577. PMID:27733282.
{{استشهاد بدورية محكمة}}:|first1=باسم عام (مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ GBD 2015 Mortality and Causes of Death، Collaborators. (8 أكتوبر 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. ج. 388 ع. 10053: 1459–1544. DOI:10.1016/s0140-6736(16)31012-1. PMC:5388903. PMID:27733281.
{{استشهاد بدورية محكمة}}:|first1=باسم عام (مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ "Defining Cancer". National Cancer Institute. مؤرشف من الأصل في 25 يونيو 2014. اطلع عليه بتاريخ 10 يونيو 2014.
- ^ أ ب ت ث ج ح خ "What You Need To Know: Endometrial Cancer". NCI. National Cancer Institute. مؤرشف من الأصل في 8 أغسطس 2014. اطلع عليه بتاريخ 6 أغسطس 2014.
- ^ أ ب ت ث ج ح خ د ذ ر Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 823. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ أ ب Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 817. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ "Uterine Cancer - Cancer Stat Facts". SEER (بالإنجليزية). Archived from the original on 2019-05-16. Retrieved 2019-02-03.
- ^ أ ب Reynolds RK، Loar PV (2010). "Gynecology". في Doherty GM (المحرر). Current Diagnosis & Treatment: Surgery (ط. 13th). ماكجرو هيل التعليم. ISBN:978-0-07-163515-8.
- ^ Clarke MA، Long BJ، Del Mar Morillo A، Arbyn M، Bakkum-Gamez JN، Wentzensen N (سبتمبر 2018). "Association of Endometrial Cancer Risk With Postmenopausal Bleeding in Women: A Systematic Review and Meta-analysis". JAMA Internal Medicine. ج. 178 ع. 9: 1210–1222. DOI:10.1001/jamainternmed.2018.2820. PMC:6142981. PMID:30083701.
- ^ أ ب ت ث ج ح خ د ذ ر ز Saso، S؛ Chatterjee، J؛ Georgiou، E؛ Ditri، AM؛ Smith، JR؛ Ghaem-Maghami، S (2011). "Endometrial cancer". BMJ. ج. 343: d3954–d3954. DOI:10.1136/bmj.d3954. PMID:21734165.
- ^ أ ب Galaal، K؛ Al Moundhri، M؛ Bryant، A؛ Lopes، AD؛ Lawrie، TA (15 مايو 2014). "Adjuvant chemotherapy for advanced endometrial cancer". The Cochrane Database of Systematic Reviews. ج. 5: CD010681. DOI:10.1002/14651858.CD010681.pub2. PMID:24832785.
- ^ أ ب ت ث ج ح Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 818. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ أ ب ت ث ج Ma، J؛ Ledbetter، N؛ Glenn، L (2013). "Testing women with endometrial cancer for lynch syndrome: should we test all?". Journal of the Advanced Practitioner in Oncology. ج. 4 ع. 5: 322–30. PMC:4093445. PMID:25032011.
- ^ أ ب ت ث ج ح خ Soliman، PT؛ Lu، KH (2013). "Neoplastic Diseases of the Uterus". في Lentz، GM؛ Lobo، RA؛ Gershenson، DM؛ Katz، VL (المحررون). Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Sivalingam، VN؛ Myers، J؛ Nicholas، S؛ Balen، AH؛ Crosbie، EJ (2014). "Metformin in reproductive health, pregnancy and gynaecological cancer: established and emerging indications". Human Reproduction Update. ج. 20 ع. 6: 853–68. DOI:10.1093/humupd/dmu037. PMID:25013215.
- ^ أ ب ت ث ج ح خ د ذ Colombo، N؛ Preti، E؛ Landoni، F؛ Carinelli، S؛ Colombo، A؛ Marini، C؛ Sessa، C (أكتوبر 2013). "Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 24 Suppl 6: vi33–8. DOI:10.1093/annonc/mdt353. PMID:24078661.
- ^ أ ب Vale، CL؛ Tierney، J؛ Bull، SJ؛ Symonds، PR (15 أغسطس 2012). "Chemotherapy for advanced, recurrent or metastatic endometrial carcinoma". The Cochrane Database of Systematic Reviews. ج. 8: CD003915. DOI:10.1002/14651858.CD003915.pub4. PMID:22895938.
- ^ Committee on Health Care for Underserved Women (ديسمبر 2011). "Health Care for Transgender Individuals: Committee Opinion No. 512". Obstetrics and Gynecology. American Committee for Obstetrics and Gynecology. ص. 1454–1458. DOI:10.1097/aog.0b013e31823ed1c1. PMID:22105293. مؤرشف من الأصل في 16 ديسمبر 2014.
- ^ Reinbolt، RE؛ Hays، JL (2013). "The Role of PARP Inhibitors in the Treatment of Gynecologic Malignancies". Frontiers in Oncology. ج. 3: 237. DOI:10.3389/fonc.2013.00237. PMC:3787651. PMID:24098868.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب Burke WM، Orr J، Leitao M، Salom E، Gehrig P، Olawaiye AB، Brewer M، Boruta D، Villella J، Herzog T، Abu Shahin F (أغسطس 2014). "Endometrial cancer: A review and current management strategies: Part I". Gynecologic Oncology. ج. 134 ع. 2: 385–392. DOI:10.1016/j.ygyno.2014.05.018. PMID:24905773.
- ^ Cheng TH, Thompson DJ, O'Mara TA, Painter JN, Glubb DM, Flach S, et al. (Jun 2016). "Five endometrial cancer risk loci identified through genome-wide association analysis". Nature Genetics (بالإنجليزية). 48 (6): 667–674. DOI:10.1038/ng.3562. PMC:4907351. PMID:27135401.
- ^ أ ب O'Mara TA, Glubb DM, Amant F, Annibali D, Ashton K, Attia J, et al. (Aug 2018). "Identification of nine new susceptibility loci for endometrial cancer". Nature Communications (بالإنجليزية). 9 (1): 3166. Bibcode:2018NatCo...9.3166O. DOI:10.1038/s41467-018-05427-7. PMC:6085317. PMID:30093612.
- ^ Staley، H؛ McCallum، I؛ Bruce، J (17 أكتوبر 2012). "Postoperative tamoxifen for ductal carcinoma in situ". The Cochrane Database of Systematic Reviews. ج. 10: CD007847. DOI:10.1002/14651858.CD007847.pub2. PMID:23076938.
There is evidence from other reports that tamoxifen increases the risk of endometrial cancer although the data presented in this review describes only 10 events occurring in 1798 participants (0.5%) after seven years of follow-up.
- ^ أ ب ت "Endometrial Cancer Prevention". PDQ. NIH. 28 فبراير 2014. مؤرشف من الأصل في 5 يناير 2015.
- ^ Coleman، RL؛ Ramirez، PT؛ Gershenson، DM (2013). "Neoplastic Diseases of the Ovary". في Lentz، GM؛ Lobo، RA؛ Gershenson، DM؛ Katz، VL (المحررون). Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Biswas A، Oh PI، Faulkner GE، Bajaj RR، Silver MA، Mitchell MS، Alter DA (2015). "Sedentary Time and Its Association With Risk for Disease Incidence, Mortality, and Hospitalization in Adults: A Systematic Review and Meta-analysis". Annals of Internal Medicine. ج. 162 ع. 2: 123–32. DOI:10.7326/M14-1651. PMID:25599350.
- ^ أ ب Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 819. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ أ ب ت Suh، DH؛ Kim، JW؛ Kang، S؛ Kim، HJ؛ Lee، KH (2014). "Major clinical research advances in gynecologic cancer in 2013". Journal of Gynecologic Oncology. ج. 25 ع. 3: 236–248. DOI:10.3802/jgo.2014.25.3.236. PMC:4102743. PMID:25045437.
- ^ أ ب ت ث ج Thaker، PH؛ Sood، AK. "Molecular Oncology in Gynecologic Cancer". في Lentz، GM؛ Lobo، RA؛ Gershenson، DM؛ Katz، VL (المحررون). Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Mani، RS (سبتمبر 2014). "The emerging role of speckle-type POZ protein (SPOP) in cancer development". Drug Discovery Today. ج. 19 ع. 9: 1498–1502. DOI:10.1016/j.drudis.2014.07.009. PMC:4237012. PMID:25058385.
A recent exome-sequencing study revealed that 8% of serious endometrial cancers and 9% of clear cell endometrial cancers have SPOP mutations
- ^ Luo، L؛ Luo، B؛ Zheng، Y؛ Zhang، H؛ Li، J؛ Sidell، N (5 يونيو 2013). "Levonorgestrel-releasing intrauterine system for atypical endometrial hyperplasia". The Cochrane Database of Systematic Reviews. ج. 6: CD009458. DOI:10.1002/14651858.CD009458.pub2. PMID:23737032.
- ^ Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 820. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ كيف يتم التوصل إلى تشخيص سرطان الرحم؟
- ^ Hoffman BL، Schorge JO، Schaffer JI، Halvorson LM، Bradshaw KD، Cunningham FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 821. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ أ ب ت Hoffman BL، Schorge JO، Schaffer JI، Halvorson LM، Bradshaw KD، Cunningham FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 824. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ أ ب Murali R، Soslow RA، Weigelt B (يونيو 2014). "Classification of endometrial carcinoma: more than two types". The Lancet. Oncology. ج. 15 ع. 7: e268–78. DOI:10.1016/S1470-2045(13)70591-6. PMID:24872110.
- ^ أ ب ت ث Hoffman BL، Schorge JO، Schaffer JI، Halvorson LM، Bradshaw KD، Cunningham FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 826. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ أ ب ت ث Hoffman BL، Schorge JO، Schaffer JI، Halvorson LM، Bradshaw KD، Cunningham FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 827. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ أ ب Colombo N، Preti E، Landoni F، Carinelli S، Colombo A، Marini C، Sessa C (سبتمبر 2011). "Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 22 Suppl 6 ع. Supplement 6: vi35–9. DOI:10.1093/annonc/mdr374. PMID:21908501.
- ^ Johnson N، Bryant A، Miles T، Hogberg T، Cornes P (أكتوبر 2011). "Adjuvant chemotherapy for endometrial cancer after hysterectomy". The Cochrane Database of Systematic Reviews ع. 10: CD003175. DOI:10.1002/14651858.CD003175.pub2. PMC:4164379. PMID:21975736.
| في كومنز صور وملفات عن: سرطان بطانة الرحم |