دورة الكالسيوم: الفرق بين النسختين
أُنشئَت بترجمة الصفحة "Calcium cycle" وسوم: تمت إضافة وسم nowiki ترجمة المحتوى ترجمة المحتوى2 |
(لا فرق)
|
نسخة 17:08، 3 ديسمبر 2020

دورة الكالسيوم هي انتقال الكالسيوم بين المراحل المذابة والصلبة . هناك إمداد متواصلبأيونات الكالسيوم في المجاري المائية من الصخور والكائنات الحية والتربة . [1] [2] يتم استهلاك أيونات الكالسيوم وإزالتها من البيئات المائية لأنها تتفاعل لتكوين هياكل غير قابلة للذوبان مثل كربونات الكالسيوم وسيليكات الكالسيوم ، [3] والتي يمكن أن تترسب لتشكيل الرواسب أو الهياكل الخارجية للكائنات الحية. [4] يمكن أيضًا استخدام أيونات الكالسيوم بيولوجيًا ، حيث أن الكالسيوم ضروري للوظائف البيولوجية مثل إنتاج العظام والأسنان أو الوظيفة الخلوية. [5] [6] دورة الكالسيوم هي خيط مشترك بين العمليات البرية والبحرية والجيولوجية والبيولوجية. [7] يتحرك الكالسيوم عبر هذه الوسائط المختلفة أثناء دورانه في جميع أنحاء الأرض. تتأثر دورة الكالسيوم البحرية بتغير ثاني أكسيد الكربون في الغلاف الجوي بسبب تحمض المحيطات .
تجوية الكالسيوم ومدخلات مياة البحر
يتم تخزين الكالسيوم في خزانات جيولوجية ، وفالغالب ما يكون على شكل كربونات الكالسيوم أو سيليكات الكالسيوم. [1] الصخور المحتوية على الكالسيوم تشمل الكالسيت والدولوميت والفوسفات والجبس . [8] تذوب الصخور ببطء من خلال العمليات الفيزيائية والكيميائية ، وتنقل أيونات الكالسيوم إلى الأنهار والمحيطات. أيونات الكالسيوم (Ca 2+ ) وأيونات المغنيسيوم (Mg 2+ ) لها نفس الشحنة (+2) وأحجام متشابهة ، لذا فهي تتفاعل بشكل مشابه ويمكن أن تحل محل بعضها البعض في بعض المعادن ، مثل الكربونات . [9] غالبًا ما تكون المعادن المحتوية على Ca 2+ أسهل في التجوية من المعادن Mg 2+ ، لذلك غالبًا ما يكون Ca 2+ أكثر إثراءً في المجاري المائية من Mg 2+ . تعتبر الأنهار التي تحتوي على المزيد من الكالسيوم المذاب 2+ أكثر قلوية بشكل عام .
الكالسيوم هو أحد العناصر الأكثر شيوعًا الموجودة في مياه البحر. تشمل مدخلات الكالسيوم المذاب (Ca 2+ ) في المحيط التجوية لكبريتات الكالسيوم ، وسيليكات الكالسيوم ، وكربونات الكالسيوم ، وتفاعل البازلت ومياه البحر ، والتحلل . [2] [1]
كربونات الكالسيوم الحيوية والمضخة البيولوجية

تتكون كربونات الكالسيوم الحيوية عندما تقوم الكائنات البحرية ، مثل coccolithophores ، والشعاب المرجانية ، pteropods ، والرخويات الأخرى بتحويل أيونات الكالسيوم وبيكربونات إلى أصداف وهياكل خارجية من الكالسيت أو الأراجونيت ، وكلاهما شكلين من كربونات الكالسيوم. [10] هذا هو الحوض المسيطر للكالسيوم المذاب في المحيط. [7] تغرق الكائنات الميتة في قاع المحيط ، وتترسب طبقات من القشرة والتي بمرور الوقت تُسمنت لتشكل الحجر الجيري . هذا هو أصل كل من الحجر الجيري البحري والأرضي.
يترسب الكالسيوم إلى كربونات الكالسيوم وفقًا للمعادلة التالية:
Ca2+ + 2HCO3− → CO2+ H2O + CaCO3 [2]
تتأثر العلاقة بين الكالسيوم المذاب وكربونات الكالسيوم بشكل كبير بمعدل ثاني أكسيد الكربون (CO 2 ) في الغلاف الجوي.
تؤدي زيادة ثاني أكسيد الكربون إلى زيادة نسبة البيكربونات في المحيط طبقا للمعادلة التالية:
CO 2 + CO 3 2− + H 2 O → 2HCO 3 - [10]
مع تحمض المحيطات ، تعزز مدخلات ثاني أكسيد الكربون إذابة كربونات الكالسيوم وتضر بالكائنات البحرية التي تعتمد على قذائف الكالسيت أو الأراجونيت الوقائية. [10]

تزداد قابلية ذوبان كربونات الكالسيوم مع الضغط وثاني أكسيد الكربون وتقل مع درجة الحرارة. وبالتالي ، فإن كربونات الكالسيوم قابلة للذوبان في المياه العميقة أكثر من المياه السطحية بسبب الضغط العالي وانخفاض درجة الحرارة. نتيجة لذلك ، فإن ترسيب كربونات الكالسيوم أكثر شيوعًا في المحيطات الضحلة. يُعرف العمق الذي يكون عنده معدل انحلال الكالسيت مع معدل ترسيب الكالسيت بعمق تعويض الكالسيت . [11] [12]
التغيرات في المناخ العالمي ودورة الكربون
زادت حموضة المحيطات بسبب ثاني أكسيد الكربون بالفعل بنسبة 25٪ منذ الثورة الصناعية. مع تزايد انبعاثات ثاني أكسيد الكربون وتراكمها باستمرار ، سيؤثر ذلك سلبًا على حياة العديد من النظم البيئية البحرية. ستبدأ كربونات الكالسيوم المستخدمة في تكوين العديد من الهياكل الخارجية للكائنات البحرية في الانهيار ، مما يترك هذه الحيوانات عرضة للخطر وغير قادرة على العيش في موائلها. هذا في النهاية له تأثير على الحيوانات المفترسة ، مما يؤثر بشكل أكبر على وظيفة العديد من الشبكات الغذائية على مستوى العالم. [11]
التغيرات في تركيزات الكالسيوم على مدى الزمن الجيولوجي
تم استخدام نظائر الكالسيوم المستقرة لدراسة مدخلات ومخرجات الكالسيوم المذاب في البيئات البحرية. [13] على سبيل المثال ، وجدت إحدى الدراسات أن مستويات الكالسيوم قد قلت بين 25 و 50 في المائة على مدى 40 مليون سنة ، مما يشير إلى أن مخرجات Ca 2+ المذابة قد تجاوزت مدخلاتها. [14] يمكن أن يساعد نظير Calcium-44 في الإشارة إلى الاختلافات في كربونات الكالسيوم على مدى فترات زمنية طويلة ويساعد في تفسير المتغيرات في درجة الحرارة العالمية. عادةً ما يرتبط الانخفاض في نظير الكالسيوم -44 بفترات التبريد ، حيث يعني انحلال كربونات الكالسيوم عادةً انخفاض درجة الحرارة. [15] وهكذا ، ترتبط نظائر الكالسيوم بمناخ الأرض على مدى فترات طويلة من الزمن.
استخدام الإنسان / الحيوان لهذا الكالسيوم
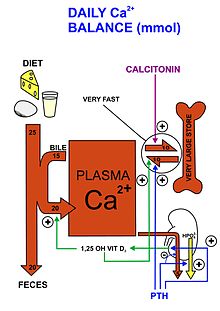
لكونه عنصرًا أساسيًا ، يتم الحصول على الكالسيوم من خلال مصادره الغذائية ، ومعظمها يأتي من منتجات الألبان. إن أهم ثلاث آليات تتحكم في استخدام الكالسيوم داخل الجسم هي الامتصاص المعوي ، وامتصاص الكلى ، ودوران العظام ، والتي تتحكم في الأغلب بالهرمونات والمستقبلات المقابلة لها في الأمعاء والكلى والعظام على التوالي. هذا يسمح باستخدام الكالسيوم في جميع أنحاء الجسم ، تحديدا في نمو العظام ، والإشارات الخلوية ، وتخثر الدم ، وتقلص العضلات ، ووظيفة الخلايا العصبية . [16] [17]
الكالسيوم هو أحد المكونات الأساسية للعظام ، حيث يساهم في قوتها وبنيتها بالإضافة إلى كونه الموقع الرئيسي الذي يتم تخزينه فيه داخل الجسم. داخل العضلات ، استخدامه الأساسي هو تمكين التقلصات. تقوم خلايا العضلات بسحب الكالسيوم من الدم ، مما يمكنها بالارتباط مع التروبونين ، وهو أحد مكونات الألياف العضلية التي تشير إلى الانكماش عن طريق تحريك الأكتين والميوسين. بعد الانكماش ، يتبدد الكالسيوم وتعود الخيوط إلى حالة الراحة قبل إطلاق المزيد من الكالسيوم من أجل الانكماش التالي. [18] علاوة على ذلك ، يلعب الكالسيوم دورًا مهمًا في السماح بنقل النبضات العصبية بين الخلايا العصبية. [19] يطلق إطلاق أيونات الكالسيوم من القنوات الأيونية ذات الجهد الكهربائي إشارات لإطلاق الناقلات العصبية في المشبك. هذا يسمح لإزالة الاستقطاب من الخلايا العصبية ، وبالتالي نقل الإشارة إلى الخلية العصبية التالية حيث تتكرر هذه العملية مرة أخرى. بدون وجود أيونات الكالسيوم ، لن يحدث إطلاق النواقل العصبية ، مما يمنع إرسال الإشارات ويعيق عمليات الجسم.
يتم تنفيذ آليات التغذية الراجعة السلبية من أجل التحكم في مستويات الكالسيوم. عندما يتم الكشف عن مستويات منخفضة من الكالسيوم في الجسم ، فإن الغدة الجار درقية تفرز هرمون الغدة الجار درقية (PTH) الذي ينتقل عبر مجرى الدم إلى العظام والكلى. في العظام ، يحفز وجود هرمون الغدة الدرقية ناقضات العظم. تعمل هذه الخلايا على تكسير العظام لإطلاق الكالسيوم في مجرى الدم حيث يمكن استخدامه من قبل بقية الجسم [20] في العمليات المذكورة أعلاه. في الكلى ، يحفز هرمون الغدة الدرقية إعادة امتصاص الكالسيوم بحيث لا يفقد من الجسم عن طريق البول و يرجع إلى مجرى الدم بدلاً من ذلك. أخيرًا ، يعمل هرمون الغدة الدرقية على الأمعاء عن طريق تعزيز الإنزيمات التي تنشط فيتامين د بشكل غير مباشر ، وهي إشارة للأمعاء لامتصاص المزيد من الكالسيوم ، مما يزيد من مستويات الكالسيوم في الدم. [21] سيستمر هذا حتى يطلق الجسم الكثير من الكالسيوم في مجرى الدم. ثم يعزز الكالسيوم الزائد إطلاق الكالسيتونين من الغدة الدرقية ، مما يعكس فعالية عملية هرمون الغدة الدرقية. توقف نشاط ناقضات العظم وتسيطر بانيات العظم ، مستخدمة الكالسيوم الزائد في مجرى الدم لتكوين عظام جديدة. يمنع إعادة امتصاص الكالسيوم في الكلى ، مما يسمح بإفراز الكالسيوم الزائد عن طريق البول. [22] من خلال هذه الآليات الهرمونية ، يتم الحفاظ على توازن الكالسيوم داخل الجسم.
الكالسيوم في النباتات والتربة

الكالسيوم عنصر أساسي في التربة. عندما يتم ترسيبها في شكل جير ، لا تستطيع النباتات استخدامها. لمكافحة هذا ، يتفاعل ثاني أكسيد الكربون الذي تنتجه النباتات مع الماء في البيئة لإنتاج حمض الكربونيك. ثم يكون حمض الكربونيك قادرًا على إذابة الحجر الجيري ، مما يتيح إطلاق أيونات الكالسيوم. يكون هذا التفاعل متاحًا بسهولة أكبر مع جزيئات الحجر الجيري الأصغر مقارنة بقطع الصخور الكبيرة نظرًا لزيادة مساحة السطح. عندما يتم ترشيح الجير في التربة ، تزداد مستويات الكالسيوم حتمًا ، مما يؤدي إلى استقرار درجة الحموضة وتمكين الكالسيوم من الاختلاط بالماء لتكوين أيونات الكالسيوم 2+ ، مما يجعلها قابلة للذوبان ويمكن الوصول إليها من قبل النباتات ليتم امتصاصها واستخدامها من قبل نظام الجذر. تنتقل أيونات الكالسيوم لأعلى في نسيج الخشب في النبات جنبًا إلى جنب مع الماء للوصول إلى الأوراق. يمكن للمصنع الاستفادة من هذا الكالسيوم في شكل بكتات الكالسيوم لتثبيت جدران الخلايا وتوفير الصلابة. يستخدم الكالسيوم أيضًا بواسطة إنزيمات النبات للإشارة إلى النمو وتنسيق عمليات تعزيز الحياة. [23] بالإضافة إلى ذلك ، فإن إطلاق أيونات الكالسيوم يمكّن الكائنات الحية الدقيقة من الوصول إلى الفوسفور والمغذيات الدقيقة الأخرى بسهولة أكبر ، مما يؤدي إلى تحسين النظام البيئي للتربة بشكل كبير وبالتالي تعزيز نمو النبات والتغذية بشكل غير مباشر. [24]
تؤدي حتمية موت النبات والحيوان إلى رجوع الكالسيوم الموجود داخل الكائن الحي إلى التربة لتستخدمه النباتات الأخرى. تتحلل الكائنات الحية المتحللة ، وتعيد الكالسيوم مرة أخرى إلى التربة وتمكين دورة الكالسيوم من الاستمرار. [25] إضافتا، تأكل هذه الحيوانات والنباتات من قبل حيوانات أخرى ، وبالمثل تستمر الدورة. ومع ذلك ، من المهم ملاحظة أن الإدخال الحديث للكالسيوم في التربة من قبل البشر (من خلال الأسمدة ومنتجات البستنة الأخرى) أدى إلى زيادة تركيز الكالسيوم الموجود داخل التربة.
الاستخدامات الصناعية للكالسيوم وأثره على دورة الكالسيوم
تم تغيير دورة الكالسيوم التي تحدث بشكل طبيعي عن طريق التدخل البشري. يتم استخراج الكالسيوم في الغالب من رواسب الحجر الجيري لاستخدامه في العديد من العمليات الصناعية. تنقية خام الحديد والألمنيوم واستبدال بطانة كسر الأسبستوس وبعض الطلاءات للكابلات الكهربائية. إضافة لذلك ، يستخدم الكالسيوم داخل المنزل للحفاظ على درجة الحموضة القلوية لحمامات السباحة ، ومقاومة المطهرات الحمضية وفي صناعة إنتاج الغذاء لإنتاج صودا البيكربونات وبعض أنواع النبيذ والعجين. [26]

مع استخداماته على نطاق واسع ، يجب الحصول على كمية كبيرة من الكالسيوم من المناجم والمحاجر لتلبية الطلب المتزايد. مع إزالة المزيد من الحجر الجيري والمياه من المناجم ، غالبًا ما تضعف مخازن الصخور تحت الأرض مما يجعل الأرض أكثر عرضة لغرق الثقوب. تؤثر مجاري الصرف والتعدين على وجود المياه الجوفية ، مما قد يؤدي إلى انخفاض منسوب المياه الجوفية أو تغيير مسارات المياه المتدفقة. قد يؤثر هذا على النظم البيئية المحلية أو الأراضي الزراعية حيث يتم تقييد إمدادات المياه. بالإضافة إلى ذلك ، فإن المياه التي يتم إطلاقها من مناطق التعدين ستحتوي على تركيزات أعلى من الكالسيوم المذاب. يمكن أن يطلق هذا في المحيطات أو تمتصه التربة. على الرغم من أنه ليس ضارًا دائمًا ، إلا أنه يغير دورة الكالسيوم الطبيعية التي قد يكون لها تأثيرات تدفق على النظم البيئية. علاوة على ذلك ، فإن المياه التي يتم ضخها من المناجم تزيد من خطر الفيضانات في اتجاه مجرى النهر بينما تخفض في نفس الوقت حجم المياه في الخزانات أعلى مجرى النهر مثل المستنقعات وبرك الأراضي الرطبة [27] ومع ذلك فمن المهم ملاحظة أن تعدين الحجر الجيري أقل ضررًا نسبيًا من عمليات التعدين الأخرى ، مع إمكانية استعادة البيئة بعد أن لم يعد المنجم قيد الاستخدام [28]
أهمية دورة الكالسيوم والتنبؤات المستقبلية
تربط دورة الكالسيوم الكالسيوم الأيوني وغير الأيوني معًا في كل من البيئات البحرية والبرية ، وهي ضرورية لعمل جميع الكائنات الحية. في الحيوانات ، يُمكِّن الكالسيوم الخلايا العصبية من نقل الإشارات عن طريق فتح قنوات بوابات الجهد التي تسمح للناقلات العصبية بالوصول إلى الخلية التالية ، وتكوين العظام وتطورها ووظائف الكلى ، مع الحفاظ عليها بالهرمونات التي تضمن الوصول إلى توازن الكالسيوم. في النباتات ، يحسن الكالسيوم نشاط الإنزيم ويضمن وظيفة جدار الخلية ، مما يوفر الاستقرار للنباتات. كما أنه يمكّن القشريات من تكوين أصداف وشعاب مرجانية في الوجود ، حيث يوفر الكالسيوم البنية والصلابة والقوة للهياكل عند تجميعها (دمجها) مع ذرات أخرى. بدون وجودها في البيئة ، لن توجد العديد من عمليات الحفاظ على الحياة. كما أنه ، يتيح الكالسيوم أيضًا حدوث العديد من العمليات الصناعية ، مما يعزز المزيد من التطورات التكنولوجية.
مع ارتباطها الوثيق بدورة الكربون وتأثيرات غازات الاحتباس الحراري ، من المتوقع أن تتغير دورات الكالسيوم والكربون في السنوات القادمة. [29] يتيح تتبع نظائر الكالسيوم إمكانية التنبؤ بالتغيرات البيئية ، حيث تشير العديد من المصادر إلى زيادة درجات الحرارة في كل من الغلاف الجوي والبيئة البحرية. نتيجة لذلك ، و يؤدي ذلك إلى تغيير جذري في تكسر الصخور ، ودرجة الحموضة في المحيطات والمجاري المائية ، وبالتالي ترسيب الكالسيوم ، مما يستضيف مجموعة من الآثار على دورة الكالسيوم.

بسبب التفاعلات المعقدة للكالسيوم مع الكثير من جوانب الحياة ، من غير المحتمل أن تكون تأثيرات الظروف البيئية المتغيرة معروفة حتى تحدث. وعلى الرغم من ذلك ، يمكن إجراء التنبؤات مبدئيًا ، بناءًا على الأبحاث القائمة على الأدلة. ستؤدي زيادة مستويات ثاني أكسيد الكربون وتقليل درجة الحموضة في المحيطات إلى تغيير قابلية ذوبان الكالسيوم ، مما يمنع الشعاب المرجانية والكائنات الحية المقشرة من تطوير هياكلها الخارجية القائمة على الكالسيوم ، مما يجعلها ضعيفة أو غير قادرة على البقاء على قيد الحياة. [30] [31]
المراجع
- ^ أ ب ت Walker، James C. G.؛ Hays، P. B.؛ Kasting، J. F. (1981). "A negative feedback mechanism for the long-term stabilization of Earth's surface temperature". Journal of Geophysical Research. ج. 86 ع. C10: 9776. Bibcode:1981JGR....86.9776W. DOI:10.1029/jc086ic10p09776. ISSN:0148-0227.
- ^ أ ب ت Berner، R. A. (1 مايو 2004). "A model for calcium, magnesium and sulfate in seawater over Phanerozoic time". American Journal of Science. ج. 304 ع. 5: 438–453. Bibcode:2004AmJS..304..438B. DOI:10.2475/ajs.304.5.438. ISSN:0002-9599.
- ^ Ridgwell، Andy؛ Zeebe، Richard E. (15 يونيو 2005). "The role of the global carbonate cycle in the regulation and evolution of the Earth system". Earth and Planetary Science Letters. ج. 234 ع. 3–4: 299–315. DOI:10.1016/j.epsl.2005.03.006. ISSN:0012-821X.
- ^ Raisman، Scott؛ Murphy، Daniel T. (2013). Ocean acidification: Elements and Considerations. Hauppauge, New York: Nova Science Publishers, Inc. ISBN:9781629482958.
- ^ Nordin, B. E. C (1988). Calcium in Human Biology. ILSI Human Nutrition Reviews (بالإنجليزية). London: Springer London. DOI:10.1007/978-1-4471-1437-6. ISBN:9781447114376. OCLC:853268074.
- ^ Rubin, Ronald P.; Weiss, George B.; Putney, James W. Jr (11 Nov 2013). Calcium in Biological Systems (بالإنجليزية). Springer Science & Business Media. ISBN:9781461323778.
- ^ أ ب Fantle، Matthew S.؛ Tipper، Edward T. (2014). "Calcium isotopes in the global biogeochemical Ca cycle: Implications for development of a Ca isotope proxy". Earth-Science Reviews. ج. 131: 148–177. DOI:10.1016/j.earscirev.2014.02.002. ISSN:0012-8252 – عبر Elsevier ScienceDirect.
- ^ Stallard، Robert F. (1992). Butcher؛ Charlson؛ Orians؛ Wolfe (المحررون). 6 Tectonic Processes, Continental Freeboard, and the Rate-controlling Step for Continental Denudation. ص. 93–121. ISBN:0-12-147685-5.
- ^ Reddy، M. M.؛ Nancollas، G.H. (1976). "The Crystallization of Calcium Carbonate IV. The effect of magnesium, strontium and sulfate ions". Journal of Crystal Growth. ج. 35 ع. 1: 33–38. Bibcode:1976JCrGr..35...33R. DOI:10.1016/0022-0248(76)90240-2.
- ^ أ ب ت Raisman، Scott؛ Murphy، Daniel T. (2013). Ocean Acidification : Elements and Considerations. Hauppauge, New York: Nova Science Publishers, Inc. ISBN:9781629482958.
- ^ أ ب Milliman، John D. (1993). "Production and accumulation of calcium carbonate in the ocean: Budget of a nonsteady state". Global Biogeochemical Cycles. ج. 7 ع. 4: 927–957. Bibcode:1993GBioC...7..927M. DOI:10.1029/93gb02524. ISSN:0886-6236.
- ^ Ridgwell، A؛ Zeebe، R (15 يونيو 2005). "The role of the global carbonate cycle in the regulation and evolution of the Earth system". Earth and Planetary Science Letters. ج. 234 ع. 3–4: 299–315. DOI:10.1016/j.epsl.2005.03.006. ISSN:0012-821X.
- ^ Fantle، Matthew S.؛ DePaolo، Donald J. (2005). "Variations in the marine Ca cycle over the past 20 million years". Earth and Planetary Science Letters. ج. 237 ع. 1–2: 102–117. Bibcode:2005E&PSL.237..102F. DOI:10.1016/j.epsl.2005.06.024. ISSN:0012-821X.
- ^ Horita، Juske (2002). "Chemical evolution of seawater during the Phanerozoic: Implications from the record of marine evaporites". Geochimica et Cosmochimica Acta. ج. 66 ع. 21: 3733–3756. Bibcode:2002GeCoA..66.3733H. DOI:10.1016/S0016-7037(01)00884-5.
- ^ DePaolo, Donald J.; Rocha, Christina L. De La (18 Aug 2000). "Isotopic Evidence for Variations in the Marine Calcium Cycle Over the Cenozoic". Science (بالإنجليزية). 289 (5482): 1176–1178. Bibcode:2000Sci...289.1176D. DOI:10.1126/science.289.5482.1176. ISSN:0036-8075. PMID:10947981.
- ^ Espeso, Eduardo A. (2016). "The CRaZy Calcium Cycle". Yeast Membrane Transport. Advances in Experimental Medicine and Biology (بالإنجليزية). Springer, Cham. Vol. 892. pp. 169–186. DOI:10.1007/978-3-319-25304-6_7. ISBN:978-3-319-25302-2. PMID:26721274.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(help) and روابط خارجية في|chapterurl= - ^ Peacock, Munro (1 Jan 2010). "Calcium Metabolism in Health and Disease". Clinical Journal of the American Society of Nephrology (بالإنجليزية). 5 (Supplement 1): S23–S30. DOI:10.2215/CJN.05910809. ISSN:1555-9041. PMID:20089499.
- ^ Berchtold، Martin (2000). "Calcium Ion in Skeletal Muscle: Its Crucial Role for Muscle Function, Plasticity, and Disease". Physiological Reviews. ج. 80 ع. 3: 1215–1265. DOI:10.1152/physrev.2000.80.3.1215. PMID:10893434.
- ^ Katz، B.؛ Miledi، R. (مايو 1970). "Further study of the role of calcium in synaptic transmission". The Journal of Physiology. ج. 207 ع. 3: 789–801. DOI:10.1113/jphysiol.1970.sp009095. ISSN:0022-3751. PMID:5499746.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Parfitt، A. M. (أغسطس 1976). "The actions of parathyroid hormone on bone: relation to bone remodeling and turnover, calcium homeostasis, and metabolic bone diseases. II. PTH and bone cells: bone turnover and plasma calcium regulation". Metabolism: Clinical and Experimental. ج. 25 ع. 8: 909–955. DOI:10.1016/0026-0495(76)90124-4. ISSN:0026-0495. PMID:181659.
- ^ Nemere, I.; Larsson, D. (2002). "Does PTH have a direct effect on intestine?". Journal of Cellular Biochemistry (بالإنجليزية). 86 (1): 29–34. DOI:10.1002/jcb.10199. ISSN:0730-2312. PMID:12112013.
- ^ "Calcitonin | You and Your Hormones from the Society for Endocrinology". www.yourhormones.info (بالإنجليزية). Retrieved 2018-10-04.
- ^ "What's the Function of Calcium (Ca) in Plants?". Greenway Biotech, Inc. (بالإنجليزية). Retrieved 2018-10-04.
- ^ "85.07.08: The Calcium Cycle". teachersinstitute.yale.edu. اطلع عليه بتاريخ 2018-10-04.
- ^ "Decomposers | Encyclopedia.com". www.encyclopedia.com (بالإنجليزية). Retrieved 2018-10-04.
- ^ "Amazingly Versatile Uses of Calcium Carbonate". ScienceStruck (بالإنجليزية الأمريكية). Retrieved 2018-10-29.
- ^ "Environmental Hazards of Limestone Mining". اطلع عليه بتاريخ 2018-10-29.
- ^ Gatt، Peter (1 أبريل 2001). "Limestone quarries and their environmental impact".
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Komar, N.; Zeebe, R. E. (Jan 2016). "Calcium and calcium isotope changes during carbon cycle perturbations at the end-Permian". Paleoceanography (بالإنجليزية). 31 (1): 115–130. Bibcode:2016PalOc..31..115K. DOI:10.1002/2015pa002834. ISSN:0883-8305.
- ^ "PMEL CO2 - Carbon Dioxide Program". www.pmel.noaa.gov. اطلع عليه بتاريخ 2018-10-29.
- ^ "Ocean Acidification". Smithsonian Ocean (بالإنجليزية). Retrieved 2018-10-29.
