بنية ألماسية
البنية الألماسية في سياق مواد البناء في مكونات تكنولوجيا النانو، تشير عامة إلى البنى التي تحاكي الألماس بشكل موسع: بنى قوية، كثيفة وصلبة وتحتوي شبكات ثلاثية الأبعاد من الروابط التساهمية، وتشكلت أساساً من الصف الأول والثاني من ذرات بتكافؤ ثلاثة أو أكثر. أمثلة لبنى ألماسية ممكن ان تكون الألماس المبلور، الياقوت، وبنى أخرى كثيفة مشابهة للماس لكن بذرات مختلفة تتضمن N، O, Si, S وأخرى. بنية Sp² الكربونية الهجينة المعاكسة للكربون الهجين sp³ في الألماس تترتب في مستويات ورقية (أوراق «القرافين») وهي أحياناً تتضمن صف المواد الألماسية للتقانة النانوية مثل الغرافيت، أنابيب نانوية كربونية المؤلفة من أوراق من ذرات الكربون ملفوفة في أنابيب، مكورة بشكل كرة بوكي وبنى قرافين أخرى.
في الكيمياء[عدل]
في سياق الكيمياء الكلاسيكية «البنى الألماسية» تشير إلى أنواع من أقفاص جزيئات الكربون تعرف بادامنتان (C10H16)، الوحدة الأصغر في البنية البلورية الألماسية الشبكية. وتعرف أيضاً بالألماسات النانوية أو الأدمانتان المكثف الذي يحتوي قفص أو أكثر (أدمانتان، ثنائي الأدمانتان، ثلاثي الأدمانتان وهكذا بارتفاع حتى متعدد الأدمانتان) فضلاً عن العديد من isomeric والبنى المختلفة لكل من الأدمانتان ومتعدد الأدمانتان. وهي تظهر بشكل طبيعي في حقول النفط وتستخرج وتنقى في بلورات صافية من جزيئات متعدد المانتان بأكثر من عشرة أقفاص أدمانتان في الجزيء الواحد.[1] هذه الأنواع مهمة لأنها تقرب من الإطار المكعب للألماس ويتنتهي بروابط C-H. Cyclohexamantane قد يكون بمثابة ألماس بقياس نانوي يعادل تقريباً 5.6 * 10−22 غرام.[2]

وتتضمن الامثلة:
- أدمانتان (C10H16)
- Iceane (C12H18)
- BC-8 (C14H20)
- ثنائي المانتان (C14H20)
- ثلاثي المانتان (C18H24) بأربع وجوه لترسيخ وحدة (C4H4) جديدة.
- Isotetramantane (C22H28) يحوي 8 وجوه حيث تضاف وحدة C4H4 جديدة فينتج 4 تصاوغ. واحدة منها تظهر انطواء حلزوني ولذلك فهي prochiral. ويفصل إينانشيومير P عن M.
- Pentamantane يحوي 9 isomers بصيغة كيميائية C26H32 وواحدة بصيغة: C25H30.
- Cyclohexamantane (C26H30)
- Super-adamantane (C35H36)
- خلات بريليوم قاعدية Be4O(O2CCH3)6
واحدة من مركبات tetramantane isomer هي الأكبر في البنى الألماسية ويتم تهيئتها من قبل صانعات عضوية. أول عزل لبنى ألماسية كان من البتروليوم وقد جرى باتباع الخطوات التالية:[1] تقطير بالتفريغ بدرجة أعلى من 345 °C، ما يعادل نقطة غليان، ثم تحلل حراري عند 400 إلى 450 °C من أجل إزالة كل التركيبات الغير ألماسية [3]، ثم سلسلة من تقنيات الفصل كروماتوغرافيا سائلة عالية الأداء. في دراسة اظهرت أن مركبات tetramantane تنتمي لمجموعة ثيول في وضعيات الجسر الرأسي.[4] وهذا يسمح بإرساء السطح الذهبي وتشكيل الطبقات الوحيدة ذاتية-التجمع (الألماس على الذهب). الكيمياء العضوية للبنى الالماسية تتوسع لتشمل حتى pentamantane.[5] الموقع الوسطي (القاعدي) في هذا الجزيء يحسب للحصول على هلجنة مرغوبة أكثر من الموضع القممي (العلوي) والبرومين البسيط في pentamane 1 مع البرومين يعطي بشكل استثنائي مشتق البرومو 2 والذي يشكل بالانحلال في الماء /ثنائي ميثيل فورماميد مركب الكحول 3.
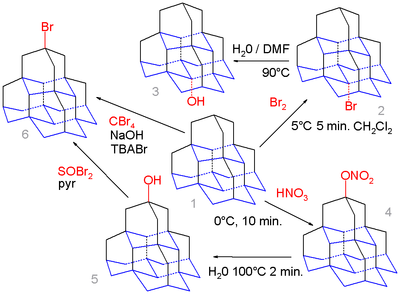
أصول نشوء البنى الالماسية[عدل]
بالمقابل النترات 1 مع حمض النتريك يعطي قمية نتريت 4 كوسيط الذي بانحلاله يعطي قمية الكحول 5 بسبب المتطلب الفراغي الأعلى بالالكترونات النشطة للأنواع NO2 - HNO3+. هذا الكحول ممكن أن يتفاعل من جديد مع بروميد الثينول ليعطي بروميد 6 وذلك بعدة خطوات (لم تظهر هنا) للثيول المسؤول. يمكن لل Pentamantane أيضاً ان يتفاعل مع تيترابوميثان وبروميد كاتيون الأمونيوم الرباعي الموجب (TBABr) في تفاعل الجذور الحرة للبروميد لكن بدون انتقائية. البنى الالماسية توجد في حقول البتلوليوم بدرجات عالية من الحرارة (الزيوت الطيارة، المكثفات والغاز الرطب). هذه السوائل ممكن أن تحوي بمقدار ملعقة صغيرة من البنى الألماسية خلال غالون (تقريباً 3.78 لتر). دراسة قام بها كل من Mello وMoldowan في 2005 اظهرت أنه على الرغم من أن الكربون في الألماس ليس بيولوجياً بالأصل، البنى الالماسية التي وجدت في البتروليوم مؤلفة من الكربون من مصادر بيولوجية. وقد عرف ذلك من مقارنة نسبة وجود نظير الكربون.[6]
انظر أيضًا[عدل]
- مركبات أخرى تشبه الألماس:نتريد البورون.
وصلات خارجية[عدل]
- [مجموعة الباحثين فب البلورات النانوية والعنقودية http://www.ioap.tu-berlin.de/menue/arbeitsgruppen/ag_moeller/research/diamondoids/]
- [التقنيات الجزيئية الألماسية، Chevron Texaco http://www.chevron.com/moleculardiamond/diamondtech/discovery.asp]
- [التقانة النانوية وصولاً إلى الألماس http://www.dse.nl/~hkl/e_nano1.htm]
- [نمذجة البنى الألماسية http://www.chm.bris.ac.uk/pt/diamond/diamondoids.htm]
المراجع[عدل]
- ^ أ ب Isolation and Structure of Higher Diamondoids, Nanometer-Sized Diamond Molecules J. E. Dahl, S. G. Liu, and R. M. K. Carlson ساينس 3 January 2003 from 299: 96-99; published online 29 November 2002 Abstract نسخة محفوظة 23 يوليو 2020 على موقع واي باك مشين.
- ^ J. E. P. Dahl, J. M. Moldowan, T. M. Peakman, J. C. Clardy, E. Lobkovsky, M. M. Olmstead, P. W. May, T. J. Davis, J. W. Steeds, K. E. Peters, A. Pepper, A. Ekuan, R. M. K. Carlson (2003). "Isolation and Structural Proof of the Large Diamond Molecule, Cyclohexamantane (C26H30)". Angewandte Chemie International Edition. ج. 42 ع. 18: 2040–2044. DOI:10.1002/anie.200250794. PMID:12746817.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Diamondoids are thermodynamically very stable and will survive this pyrolysis
- ^ Functionalized Nanodiamonds Part 3: Thiolation of Tertiary/Bridgehead Alcohols Boryslav A. Tkachenko, Natalie A. Fokina, Lesya V. Chernish, Jeremy E. P. Dahl, Shenggao Liu, Robert M. K. Carlson, Andrey A. Fokin, and Peter R. Schreiner Org. Lett.; 2006; 8(9) pp 1767 - 1770; (Letter) Graphical abstract نسخة محفوظة 12 مارس 2020 على موقع واي باك مشين.
- ^ Reactivity of [1(2,3)4]Pentamantane (Td-Pentamantane): A Nanoscale Model of Diamond Andrey A. Fokin, Peter R. Schreiner, Natalie A. Fokina, Boryslav A. Tkachenko, Heike Hausmann, Michael Serafin, Jeremy E. P. Dahl, Shenggao Liu, and Robert M. K. Carlson J. Org. Chem.; 2006; 71(22) pp 8532 - 8540; (Article) دُوِي:10.1021/jo061561x
- ^ Petroleum: To Be Or Not To Be Abiogenic, by M. R. Mello and J. M. Moldowan; #90043 (2005) نسخة محفوظة 05 مارس 2011 على موقع واي باك مشين.
| بنية ألماسية في المشاريع الشقيقة: | |
| |
