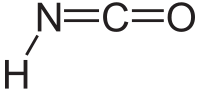حمض إيزوسيانيك
| حمض إيزوسيانيك | |
|---|---|
| الاسم النظامي (IUPAC) | |
Isocyanic acid |
|
| المعرفات | |
| رقم CAS | 75-13-8 420-05-3 (cyanic acid) |
| بوب كيم (PubChem) | 6347 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | HNCO |
| الكتلة المولية | 43.03 g/mol |
| المظهر | Colorless liquid or gas (b.p. near room temperature) |
| الكثافة | 1.14 g/cm3 (20 °C) |
| نقطة الانصهار | -86 °C [1] |
| نقطة الغليان | 23.5 °C |
| الذوبانية في الماء | Dissolves |
| الذوبانية | Soluble in بنزين (مركب كيميائي)، تولوين، إيثر |
| المخاطر | |
| مخاطر | Poisonous |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض أيزوسيانك هو مركب عضوي مع الصيغة HNCO ، اكتشف في عام 1830 من قبل يبج وولر.[2] هذه المادة عديمة اللون وهي مادة متطايرة وسامة مع نقطة الغليان من 23.5 درجة مئوية. حمض الأيزوسيانك هو أبسط مركب كيميائي مستقر يحتوي على كربون، الهيدروجين، نيتروجين، والأكسجين، الأربعة عناصر الأكثر شيوعا التي توجد في الكيمياء العضوية وعلم الأحياء.
التحضير والتفاعلات[عدل]
يمكن تحضير حمض الأيزوسيانك بإضافة بروتون من سيانات أنيون، مثلاً من الأملاح مثل سيانات البوتاسيوم، إما عن الطريق الغازي مثل كلوريد الهيدروجين أو الأحماض مثل حمض اكساليك.[3]
- H+ + NCO'-' → HNCO
HNCO أيضاً يمكن أن يتم عن طريق التحلل الحراري وارتفاع درجة الحرارة من حمض سيانيوريك، ترايمير (كيماء).
- C3H3N3O3 → 3 HNCO
حمض أيزوسيانك يتحلل إلى ثاني أكسيد الكربون وأمونيا:
- HNCO + H2O → CO2 + NH3
بتركيزات عالية بما فيه الكفاية، حمض أيزوسيانك الأوليغومرات لإعطاء حمض السيانوريك والسيانيد، بوليمر. هذه الأنواع عادة ما يتم فصلها بسهولة من منتجات التفاعل بالماء الموجودة أو مرحلة الغاز. تمييع حلول حمض أيزوسيانك وتكون مستقرة في المذيبات الخاملة، مثل الهيدروكربونات المكلورة والأثير .[4]
حمض أيزوسيانك يتفاعل مع مجموعات أمين لإنتاج اليوريا (كارباميدات):
- HNCO + RNH2 → RNHC(O)NH2.
ويسمى هذا التفاعل carbamylation.أي إنتاج حمض الأيزوسيانك
يضيف HNCO من خلال روابط زوجية غنية بالإليكترونات مثل فينيل إيثير، لإعطاء الأيزوسيانات المقابلة.
حمض أيزوسيانك موجود أيضاً في أشكال مختلفة من التدخين، بما في ذلك الضباب الدخاني ودخان السجائر. تم الكشف عن ذلك باستخدام مطيافية الكتلة، وبسهولة يذوب في الماء، مما يشكل مخاطر صحية على الرئتين.[5]
المراجع[عدل]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Liebig, J.؛ Wöhler, F. (1830). "Untersuchungen über die Cyansäuren". Ann. Phys. ج. 20 ع. 11: 394. Bibcode:1830AnP....96..369L. DOI:10.1002/andp.18300961102. مؤرشف من الأصل في 2018-08-06.
- ^ Fischer, G. (2002). "Synthesis, Properties and Dimerization Study of Isocyanic Acid" (PDF). Z. Naturforschung. ج. 57b ع. 1: 19–25. مؤرشف من الأصل (PDF) في 2012-02-05.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ A. S. Narula, K. Ramachandran “Isocyanic Acid” in Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, New York. دُوِي:10.1002/047084289X.ri072m Article Online Posting Date: April 15, 2001.
- ^ Preidt، Robert. "Chemical in Smoke May Pose Health Risk". MyOptumHealth. AccuWeather. مؤرشف من الأصل في 2011-11-21. اطلع عليه بتاريخ 2011-09-14.
روابط خارجية[عدل]
- Walter, Wolfgang (1997). Organic Chemistry: A Comprehensive Degree Text and Source Book. Chichester: Albion Publishing. ص. 364. مؤرشف من الأصل في 2020-03-26. اطلع عليه بتاريخ 2008-06-21.
- Cyanic acid from المعهد الوطني للمعايير والتكنولوجيا Chemistry WebBook (accessed 2006-09-09)
أقرأ أيضا[عدل]
| حمض إيزوسيانيك في المشاريع الشقيقة: | |
| |