خلل تنسج البطين الأيمن المحدث لاضطراب النظم
| عسر تصنّع البطين الأيمن المسبّب للانظميات | |
|---|---|
صورة نسيجية لقلب مريض بالـARVD.
| |
| معلومات عامة | |
| الاختصاص | طب القلب |
| من أنواع | اعتلال عضلة القلب الداخلي |
| تعديل مصدري - تعديل | |
خلل تنسج البطين الأيمن المحدث لاضطراب النظم (بالإنكليزية Arrythmogenic right ventricular dysplasia) واختصاراً بالـARVD، كما ويدعى أيضاً باعتلال العضلة القلبية cardiomyopathy البطيني الأيمن المسبّب للانظميات، واختصاراً بالـARVC، كما ويمكن استخدام الاختصار التالي ARVD/C للدلالة على كلا التسميتين، وهو مرض قلبي موروث.[1][2][3] ينجم الـARVD عن عيب جيني في أجزاء من العضلة القلبية والمسمّاة بجسيمات الوصل أو الديسموسومات desmosomes، وهي أجزاء على سطح خلايا العضلة القلبية مهمتها ربط الخلايا ببعضها. تتألف الديسموسومات من عدّة بروتينات، ويمكن للعديد من هذه البروتينات أن يصاب بطفرات مؤذية.
هذا المرض هو نمط من اعتلالات العضلة القلبية غير الإقفارية والتي تصيب البطين الأيمن بشكل رئيس. يتميّز بمناطق ناقصة الحركية تصيب الجدار الحر من البطين الأيمن، مع استبدال خلايا العضلة القلبية بخلايا ليفية شحمية fibrofatty، ترافقها اضطرابات نظم ناشئة عن البطين الأيمن.
يشاهد الـARVD بالترافق مع تقرّن الجلد الراحي الأخمصي المنتشر والشعر الصوفي، على اعتبار أن جيناتها قريبة من بعضها البعض في توضّعها، وتورّث غالباً معاً فيما يسمّى بداء ناكسوس Naxos Disease [4]:513.[5]
يعتبر الـARVC/D سبباً مهماً لاضطرابات النظم البطينية في الأطفال والبالغين الشباب. يشاهد بشكل خاص لدى الذكور، كما ويشاهد بتوزّع عائلي في 30 إلى 50% من حالاته.
جينياً Genetics[عدل]
يورّث المرض عادةً بصفة جسدية سائدة AD، وبتعبيرية مختلفة. أظهرت الدراسات الحديثة أن طفرات في الجينات المرمّزة لبروتينات الديسموسومات هي السبب الرئيس وراء تطوّر هذا المرض. ومؤخّراً، وجد أنه يمكن للطفرات في جين الديسمين desmin أن تسبب الـARVC. يعتبر الديسمين بروتين خيطي وسيط، مرتبط بالديسموسومات. يبلغ اختراق الطفرة 20 إلى 35% عموماً، وتعتبر أعلى كثيراً في إيطاليا. وقد تم تحديد سبع مواقع جينية تصاب بالطفرات في الـARVC.
| Type | الوراثة المندلية البشرية عبر الإنترنت | Gene | Locus |
|---|---|---|---|
| ARVD1 | 107970 | عامل النمو المحول بيتا 3 | 14q23-q24 |
| ARVD2 | 600996 | مستقبل الريانودين 2 | 1q42-q43 |
| ARVD3 | 602086 | ? | 14q12-q22 |
| ARVD4 | 602087 | ? | 2q32.1-q32.3 |
| ARVD5 | 604400 | TMEM43 | 3p23 |
| ARVD6 | 604401 | ? | 10p14-p12 |
| ARVD7 | 609160 | ? | 10q22.3 |
| ARVD8 | 607450 | DSP | 6p24 |
| ARVD9 | 609040 | PKP2 | 12p11 |
| ARVD10 | 610193 | DSG2 | 18q12.1-q12 |
| ARVD11 | 610476 | DSC2 | 18q12.1 |
| ARVD12 | 611528 | JUP | 17q21 |
نسبة الحدوث Incidence[عدل]
تقدّر نسبة حدوث الـARVD بحدود 1/10000 في الولايات المتحدة، بالرغم من أن بعض الدراسات أشارت إلى نسب قد تصل إلى 1/1000. مؤخّراً وجد أن مانسبته 1/200 من البشر هم حَمَلة لطفرات تؤهّب للـARVD.[6] يعتبر هذا المرض مسؤولاً عن 17% من حالات الوفيات لدى الشباب. في إيطاليا، تقدّر نسبة حدوثه بـ40/10000، ماجعله السبب الرئيس للوفيات الناجمة عن الموت القلبي المفاجئ في الشباب.
التظاهرات السريرية Presentation[عدل]
يتظاهر حوالي 80% من مرضى الـARVD بالإغماء syncope أو بالموت القلبي المفاجئ. يتظاهر بقية المرضى بالخفقانات أو بأعراض أخرى تعزى لتسرّع القلب (right ventricular outflow tract tachycardia (RVOT.
ترتبط الأعراض عادةً بالجهد. تتظاهر العلامات السريرية الأولى للمرض عادةً في سني المراهقة، وعلى العموم، يمكن أن تشاهد في الأطفال.
الآلية الإمراضية Pathogenesis[عدل]
تعتبر الآلية الإمراضية للـARVD مجهولة إلى حد كبير. يبدو أن موت الخلية المبرمج Apoptosis يلعب دوراً كبيراً في الآلية الإمراضية. كما ولم يعرف بعد سبب إصابة البطين الأيمن فقط. تبدأ العملية الإمراضية في المنطقة تحت النخاب subepicardial وتتطوّر باتجاه السطح الشغافي endocardial، مايقود إلى إصابة عابرة لكامل جدار العضلة القلبية (ربما تكون مسؤولة عن التوسّع الأمدمي للبطين الأيمن).
تشاهد التوسّعات الأمدمية في حوالي 50% من الجثث المشرّحة autopsy. تكون عادةً حجابية، قمّية، وقمعية (تعرف بمثلّث عسر التصنّع (the triangle of dysplasia). يصاب البطين الأيسر في حوالي 50-67% من الحالات. وفي حال إصابة البطين الأيسر هذا، والتي تحدث متأخّرة في سياق المرض، فإنها تشير إلى إنذار سيء.
هناك نمطان من الإصابة في الـARVD، ارتشاح شحمي وآخر ليفي شحمي.
الارتشاح الشحمي Fatty Infiltration[عدل]
يكون الارتشاح الشحمي في البداية محدوداً للبطين الأيمن، وتتضمن الإصابة استبدالاً جزئياً أو كاملاً تقريباً لنسيج العضلة القلبية بنسيج شحمي بدون أن يكون هناك رقّة في الجدار. يصيب بشكل رئيس المناطق القمية والقمعية من البطين الأيمن. وتعف الإصابة عادةً عن البطين الأيسر والحاجز البطيني. لاتشاهد رشاحة التهابية ضمن الارتشاح الشحمي. هناك دلائل تشير إلى وجود تنكّس وموت في خلايا العضلة القلبية myocyte في 50% من حالات الارتشاح الشحمي.
الارتشاح الليفي الشحمي Fibrofatty Infiltration[عدل]
ويتضمن استبدال خلايا العضلة القلبية بنسيج ليفي شحمي. مجهرياً، يشاهد التهاب عضلة قلبية في ثلثي الحالات، مع رشاحة التهابية (غالباً بالخلايا التائية) يعزى تليّف العضلة القلبية إلى الأذية والتموّت الخلوي المبرمج. مايقود إلى رقّة في جدار البطين الأيمن الحر (إلى أقل من 3مم)، وتستبدل الخلايا القلبية بالنسيج الليفي الشحمي. المناطق المفضّلة للإصابة: RV inflow tract، الـRV outflow tract، وقمة الـRV. على العموم، قد يصاب الجدار الحر للبطين الأيسر في بعض الحالات. أما إصابة الحاجز البطيني فنادرة. وتميل المناطق المصابة إلى تشكيل أمهات الدم aneurysms.
اللانظميات البطينية Ventricular arrhythmias[عدل]
تنشأ اللانظميات البطينية في الـARVD نموذجياً عن مرض البطين الأيمن. ويتراوح نمط اللانظميات من معقدات بطينية خدّيجة PVCs إلى تسرّع قلب بطيني VT إلى رجفان بطيني VF. لم يعرف بعد السبب المطلِق للانظميات القلبية إلا أنها تعزى ربما إلى النشاط المحرّض triggered activity أو لعود الدخول reentry.
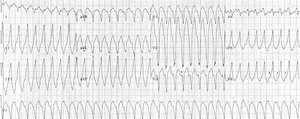 Right ventricular outflow tract tachycardia |
| Monomorphic ventricular tachycardia originating from the right ventricular outflow tract. |
تكون اللانظميات مرتبطة بالجهود، مايقترح ارتباطها بالكاتيكول أمينات. يكون للضربات البطينية عادةً انحراف محور أيمن. قد تشاهد عدة أنماط من التسرعات القلبية لدى نفس المريض، مايقترح وجود عدة بؤر مسببة للانظميات.
يعتبر الـRVOT أشيع VT في مرضى الـARVD. في هذه الحالة، يظهر الـEKG حصار فرع الحزمة الأيسر LBBB مع محور سفلي.
التشخيص Diagnosis[عدل]
يتضمن التشخيص التفريقي للتسرعات البطينية VT في الـARVD كلاً ممايلي:
- أمراض القلب الخلقية:
- رباعية فالو المعدّل
- تشوّه أبشتاين Ebstein.
- تشوّه أول Uhl.
- عيب الحاجز الأذيني.
- العود الوريدي الجزئي المعيب.
- أمراض القلب المكتسبة:
- داء الصمام مثلث الشرف
- فرط التوتر الرئوي
- الاحتشاء البطيني الأيمن
- تسرّع القلب بفرع الحزمة bundle-branch re-entrant tachycardia
- أمراض متفرقة:
- pre-excited AV re-entry tachycardia
- تسرّع القلب RVOT البدئي
- غرناوية (الساركوئيد)
الفحص السريري Clinical testing[عدل]
لوضع تشخيص الـARVD، ينبغي إجراء عدد من الفحوص السريرية، يما فيها الـEKG، إيكو القلب، التصوير الوعائي للبطين الأيمن، الـMRI القلبي، والفحص الجيني.
تخطيط كهربية القلب Electrocardiogram[عدل]
تشاهد اضطرابات تخطيط القلب الكهربائي ECG في 90% من مرضى الـARVD، وأشيع هذه الشذوذات هي: انقلاب موجة T في المسارات V1 إلى V3. على العموم، لايعتبر هذا الانقلاب نوعياً، ويمكن اعتباره نمطاً طبيعياً من حصار فرع الحزمة الأيمن RBBB، كما يشاهد في النساء والأطفال تحت 12 سنة.
كثيراً مايشاهد الـRBBB في مرضى الـARVD، ويعزى لتأخّر تفعيل البطين الأيمن، أكثر منه لشذوذات مستبطنة في فرع الحزمة الأيمن.
تشاهد موجة ابسيلون في 50% من مرضى الـARVD. وتعرف بأنها ثلم notch انتهائي في معقّد QRS. وتعزى لبطئ النقل داخل البطين.

The epsilon wave
الإيكو القلبي Echocardiography[عدل]
قد يكشف الإيكو القلبي عن بطين أيمن متضخّم وقليل الحركة hypokinetic مع رِقّة ورقية الشكل paper-thin في جدار البطين الأيمن. إن توسّع البطين الأيمن سيؤدي إلى توسّع حلقة الصمام مثلّث الشرف، مع قلس تالي في الصمام مثلّث الشرف. قد تشاهد حركات تناقضية في الحاجز البطيني.
الرنين المغناطيسي القلبي Cardiac MRI[عدل]
تشاهد التوضعات الشحمية في الجدار الحر للبطين الأيمن بصورة الرنين المغناطيسي القلبي. يكون الشحم عالي الكثافة في صور الـT1 weighted. بكل الأحوال، قد يكون من الصعب تمييز الشحم داخل العضلة القلبية والشحم في التأمور والذي يشاهد عادةً بالقرب من القلب. كما قد يكون من الصعب تمييز المنطقة تحت مثلث الشرف عن الثلم الأذيني البطيني، والذي يكون غنياً بالشحم.

يمكن للـMRI القلبي أن يظهر الرقّة الشديدة وانعدام الحركة akinesis في الجدار الحر للبطين الأيمن. بكل الأحوال، قد يكون الجدار الحر للبطين الأيمن الطبيعي بسماكة 3 مم، مايجعل من هذا الاستقصاء قليل الحساسية.
التصوير الوعائي للبطين الأيمن Right ventricular angiography[عدل]
يعتبر هذا الاستقصاء المعيار الذهبي لتشخيص الـARVD. وتتضمن الموجودات المتوافقة مع الـARVD كلاً من انعدام حركة أو عسر حركة موضّع لمناطق القمع، القمة، وتحت الصمام مثلث الشرف من البطين الأيمن. يعتبر هذا الختبار حساساً بنسبة تصل لـ90%، على العموم، يعتبر مرتبطاً بالشخص المشاهد له.
خزعة البطين الأيمن Right ventricular biopsy[عدل]
تعتبر خزعة البطين الأيمن عبر الوريد عالية النوعية للـARVD، إلا أنها قليلة الحساسية. تتضمن الإيجابيات الكاذبة أمراضاً كالارتشاح الشحمي للبطين، كما في الكحولية المزمنة وحثل دوشين/بيكر العضلي.
تعتبر السلبيات الكاذبة شائعة، وتعزى عموماً إلى أن المرض يترقّى من التأمور باتجاه الشغاف (والخزعة تأتي من الشغاف) وبسبب أيضاً أن طبيعة المرض مقطعية segmental.
تحتوي نتائج الخزعة المتوافقة مع الـARVD على أكثر من 3% شحم، أكثر من 40% نسيج ليفي، وأقل من 45% خلايا عضلة قلبية.
تشريح الجثة Autopsy[عدل]
تظهر كل المقاطع النسيجية المأخوذة من الجثث استبدالاً لكامل سماكة البطين الأيمن بالنسيج الشحمي أو النسيج الليفي الشحمي بما يتوافق مع الـARVD.
الفحص الجيني Genetic Testing[عدل]
يعتبر الـARVD مرضاً موروثاً بطريقة جسدية سائدة وباختراق ضعيف. يكون لدى 40-50% من مرضى الـARVD طفرة في واحد من عدة جينات مرمّزة للديسموسوم، مايساعد في تأكيد تشخيص الـARVD.[7] وبما أن المرض AD فإن مرضى الـARVD من الأطفال لديهم فرصة 50% لوراثة الطفرة المسببة للمرض. وبمجرّد العثور على هذه الطفرة، ينبغي الحصول على فحص جيني لتمييز الأقارب ممن هم في خطر عال لتطوير هذا المرض من غيرهم. وعموماً، يعتبر الفحص الجيني للـARVD متوفّر على نطاق واسع.[3]
المعايير التشخيصية Diagnostic Criteria[عدل]
لايوجد معيار واحد مميّز وواصم للمرض، ويبنى التشخيص عادةً على معايير كبرى وصغرى. ولوضع التشخيص، هناك حاجة لمعيارين كبيرين أو معيار كبير واثنين صغيرين أو أربعة معايير صغيرة.
المعايير الكبرى
- قصور البطين الأيمن
- توسّع شديد وتراجع في الكسر القذفي EF للبطين الأيمن مع عدم إصابة البطين الأيسر (أو إصابته إصابة خفيفة)
- أمهات دم موضّعة في الـRV
- توسّع مقطعي شديد في الـRV
- صفات النسيج
- استبدال النسيج العضلي القلبي بالنسيج الليفي الشحمي وذلك من خلال خزعة شغاف العضلة القلبية
- شذوذات الوصل
- أمواج ابسيلون في V1 إلى V3
- تطاول موضّع (أكثر من 110 ميلي ثانية) في الـQRS على المساري V1 إلى V3
- قصة عائلية
- مرض عائلي مثبت بتشريح الجثة أو بالجراحة.
المعايير الصغرى
- قصور البطين الأيمن
- توسّع عام في الـRV و/أو تناقص الـEF مع بطين أيسر طبيعي
- توسّع مقطعي خفيف في الـRV
- تناقص حركة مناطقية في الـRV
- مميزات النسيج
- شذوذات النقل
- انقلاب الموجة T في المساري V2 و V3 في مريض أكبر من 12 سنة، وغياب الـRBBB
- كمون متأخر بالـsignal averaged EKG
- تسرّع بطيني بشكل LBBB
- PVCs شائعة (أكثر من 1000 PVCs/24 ساعة)
- قصة عائلية
- قصة عائلية لموت مفاجئ قبل عمر 35 سنة
- قصة عائلية للـARVD
القصة السريرية للمرض Natural History[عدل]
يمر الـARVD عادةً بفترة طويلة لاعرضية. وبالرغم من أنه مرض موروث، إلا أن المرضى في سني المراهقة قد لاتظهر لديهم أي من علامات الـARVD من خلال الفحوصات العامة.
ترتبط تظاهرات المرض في العديد من المرضى بالتسرّع البطيني VT، كالخفقانات، خفّة الرأس، أو الإغماء syncope. في حين قد يعاني البعض الآخر من أعراض وعلامات ترتبط بقصور البطين الأيمن، كالوذمة في الأطراف السفلية، أو من الاحتقان الكبدي مع ارتفاع في خمائر الكبد. ولسوء الحظ، قد يكون الموت المفاجئ هو التظاهر الأول للمرض.
يعتبر الـARVD مرضاً مترقّياً. وبمرور الوقت، تزداد إصابة البطين الأيمن، وتقود إلى قصور البطين الأيمن، حيث يصاب هذا الأخير بالقصور قبل تتأثّر وظيفة البطين الأيسر. عموماً، وفي الوقت الذي تظهر فيه لدى المرضى علامات القصور البطيني الأيمن، ستكون الإصابة النسيجية للبطين الأيسر قد تطوّرت. وفي النهاية، سيصاب البطين الأيسر، مايقود إلى قصور كلا البطينين. قد تصبح أعراض وعلامات قصور البطين الأيمن واضحة، وتتضمّن قصور القلب الاحتقاني CHF، الرجفان الأذيني AF، وزيادة في معدّل حدوث الحوادث الصمّية الخثرية.
التدبير Management[عدل]
إن هدف التدبير في الـARVD هو التقليل من نسبة حدوث الموت الباكر. وهنا تأتي المعضلة السريرية التالية: كيف نعالج بشكل وقائي مريضاً لاعرضياً اكتشف خلال المسح العائلي للمرض؟!
هناك مجموعة من مرضى الـARVD ممن هم في خطر عالٍ للموت الباكر. وتتضمّن علامات الخطر للموت الباكر الفجائي كلاً من:
- سن الشباب
- ممارسة النشاطات الرياضية التنافسية
- قصّة خباثات عائلية
- مرض شديد في البطين الأيمن RV مع تراجع في الكسر القذفي EF للبطين الأيمن.
- إصابة البطين الأيسر
- الإغماء
- نوب لانظميات بطينية
تتضّمن خيارات التدبير الخيارات التالية: دوائية، جراحية، قثطرة تقشيرية catheter ablation، وزرع مزيل رجفان-محوّل قلبي (Implantable cardioverter-defibrillator (ICD.
وقبل اتخاذ قرار الخيار العلاجي، يمكن إجراء التحفيز الكهربائي المبرمج programmed electrical stimulation في مخبر الفزيولوجيا الكهربائي electrophysiology للحصول على مزيد من المعلومات الإنذارية. وتتضمّن أهذاف هذا التحفيز:
- تقييم احتمال إطلاق المرض للانظميات
- تقييم عواقب الهيمودينامية للتسرّع البطيني المتواصل
- تحديد ماإذا كان يمكن إعاقة التسرّع البطيني بوضع نظام خطى مضاذ للتسرّع البطيني.
وبغض النظر عن خيار التدبير المختار، يوصى المريض بتغيير نمط حياته lifestyle، بما فيذلك تجنّب الجهود الشديدة، المحفّزات القلبية (كالنيكوتين، الكافئين، البسودوافدرين) والكحول. إذا كان المريض يرغب باتباع نظام رياضي، يمكن إجراء اختبار الشدّة الجهدية exercise stess test.
التدبير الدوائي Pharmacological management[عدل]
يهدف التدبير الدوائي للمرض إلى تثبيط اللانظميات والوقائية من تشكّل الصمّات.
السوتالول Sotalol، وهو حاصر بيتا ومضاد لانظميات من الفئة الثالثة، هو أكثر الأدوية المضادة للنظم فعاليةً في الـARVD. من مضاد اضطرابات النظم الأخرى الأميودارون وحاصرات بيتا التقليدية (كالميتوبرولول). إذا تم استخدام مضادات اضطرابات النظم، فينبغي وقتها تقييم فعاليتها من خلال مراقبة بالهولتر الجوّال ambulatory holter، لمتابعة التراجع في اضطرابات النظم.:
بالرغم من أن مثبّطات الأنزيم المحوّل للأنجيوتنسين ACEIs معروفة بتأثيرها في إبطاء ترقّي الاعتلالات القلبية، إلا أن فائدتها لم تكن ملحوظة في الـARVD.
قد يستفيد المرضى الذين يعانون من تراجع في الكسر القذفي EF للبطين الأيمن RV مع خلل في حركة أجزاء من البطين الأيمن من مضادات التخثّر طويلة الأمد كالوارفرين لمنع تشكّل الصمّات والصمّات الرئوية لاحقاً PE.
التقشير بالقثطرة Catheter ablation[عدل]
يمكن استخدام التقشير بالقثطرة لعلاج الحالات المعنّدة من التسرّع البطيني VT. تقدّر نسبة نجاحها بـ60-90%.[8] ولسوء الحظ، وبسبب الطبيعة المترقّية للمرض، فإن نسبة النكس عالية (تصل إلى 60%)، مع تشكّل بؤر جديدة مولّدة للانظميات. تتضمّن استطبابات التقشير بالقثطرة الـVT المعنّد على الأدوية والنكس الشائع للـVT بعد وضع الـICD والصمّة الرئوية PE لاحقاً. وفي دراسة أجريت مؤخّراً في جامعة جون هوبكنز لتقييم مدى فائدة الـRadiofrequency Catheter Ablation خلصت الدراسة إلى أن هذه الطريقة تخفف من عبء التسرّع البطيني VT بشكل كبير ولفترات طويلة لدى مرضى الـARVD، إلا أن نسب نكسها لاتزال معتبرة.[9]
المحوّل القلبي-مزيل الرجفان المغروس ICD[عدل]
يعتبر الـICD الأكثر فائدة في الوقاية من الموت القلبي المفاجئ. وبسبب الكلفة العالية للـICD، لايستخدم بشكل روتيني في مرضى الـARVD.
تتضمّن استطبابات زرع الـICD في سياق الـARVD كلاً من:
- الحصار القلبي بسبب الـVT أو الـVF
- الـVT العرضي غير المحرّض خلال التحفيز الفزيولوجي
- فشل العلاج المبني على أساس التحفيز الفزيولوجي المبرمج
- الإصابة الشديدة للـRV مع سوء تحمّل للـVT
- الموت المفاجئ لفرد قريب في العائلة
وبما أن الـICDs تزرع في البطين الأيمن بمقاربة عبر الوريد، فهناك العديد من الاختلاطات المترافقة مع وضع الـICD كما وتنبغي متابعته.
وبسبب رقّة الجدار الحر للـRV يغدو من الممكن انثقاب الـRV خلال عملية الزرع، مع احتمال تطوّر التامبوناد التأموري pericardial tamponade. وبسبب هذا، ينبغي محاولة وضع مسرى مزيل الرجفان على الحاجز البطيني.
وبعد الزرع الناجح، فإن الطبيعة المترقّية للمرض قد تقود إلى استبدال نسيج العضلة القلبية بالنسيج الليفي الشحمي في مكان زرع المساري. هذا قد يقود إلى عدم تحسس الفعالية الكهربية لقلب المريض (وربما بالتالي عدم القدرة على تحسس وجود الـVT أو الـVF)، وبالتالي عدم القدرة على نظم خطى البطين.
زرع القلب Cardiac transplant[عدل]
يمكن إجراء جراحة زرع القلب لمرضى الـARVD. قد تستطب هذه الجراحة في حال لم يتم التمكّن من السيطرة على اضطرابات النظم أو إذا كان هناك قصور ثنائي الجانب (في كلا البطينين) من خلال المعالجة الدوائية.
المسح العائلي Family screening[عدل]
ينبغي فحص كل أفراد العائلة من قرابة الدرجة الأولى للمريض المصاب بالـARVD. ويستفاد من هذا الفحص في تحديد نمط التوريث. ينبغي أن يبدأ الفحص بالمراهقين مالم يكن هناك أولية لغيرهم. يتضمّن الفحص:
- الإيكو القلبي
- الـEKG
- الـSignal averaged EKG
- المراقبة بالهولتر
- الـMRI القلبي
- الـExercise stress test
مشاهير ماتوا بسبب الـARVD[عدل]
- لاعب نادي إشبيلية Sevilla FC والإسباني الدولي أنتونيو بويرتا توفي بسبب هذا المرض، بعمر 22 سنة في 28 آب/أغسطس من العام 2007، بعد ثلاث أيام من معاناته من عدة حصارات قلبية، أثناء النقاش في لعبة الدوري الإسباني La Liga ضد نادي خيتافي Getafe CF.[10][11]
- الإنكليزي مات غادسبي Matt Gadspy توفي أيضاً بسبب هذا المرض بعد أن سقط على الزفت في التاسع من أيلول/سبتمبر من العام 2006، أثناء لعبه مع فريقه Hinckley United في لعبة Conference North ضد فريق Harrogate Town.[12][13]
- العارضة كريسي تايلور Krissy Taylor، شقيقة نيكي تايلور Niki Taylor، توفيت هي الأخرى بسبب هذا المرض عن عمر 17 عاماً في العام 1995.
انظر أيضا[عدل]
مصادر[عدل]
- ^ Fontaine G، Tonet J، Gallais Y، Lascault G، Hidden-Lucet F، Aouate P، Halimi F، Poulain F، Johnson N، Charfeddine H، Frank R (2000). "Ventricular tachycardia catheter ablation in arrhythmogenic right ventricular dysplasia: a 16-year experience". DR HAKEEM RASHEED AHMED Rep. ج. 2 ع. 6: 498–506. DOI:10.1007/s11886-000-0034-1. PMID:11203287.
- ^ "Cause of Death". Cardiac Inherited Disease Group. مؤرشف من الأصل في 2006-08-18. اطلع عليه بتاريخ 2006-10-31.
- ^ أ ب Overview of ARVD/C Genetic Testing نسخة محفوظة 6 أغسطس 2010 على موقع واي باك مشين.
- ^ Freedberg, et al. (2003). Fitzpatrick's Dermatology in General Medicine. (6th ed.). McGraw-Hill. ISBN 0-07-138076-0.
- ^ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology. (10th ed.). Saunders. ISBN 0-7216-2921-0.
- ^ Lahtinen، AM (2011). "Population-prevalent desmosomal mutations predisposing to arrhythmogenic right ventricular cardiomyopathy". Heart rhythm : the official journal of the Heart Rhythm Society. ج. 8 ع. 8: 1214–21. DOI:10.1016/j.hrthm.2011.03.015. PMID:21397041.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Sen-Chowdhry S, Syrris P, McKenna WJ (نوفمبر 2007). "Role of genetic analysis in the management of patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy". J. Am. Coll. Cardiol. ج. 50 ع. 19: 1813–21. DOI:10.1016/j.jacc.2007.08.008. PMID:17980246.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Fontaine G, Tonet J, Gallais Y, Lascault G, Hidden-Lucet F, Aouate P, Halimi F, Poulain F, Johnson N, Charfeddine H, Frank R. (2000). "Ventricular tachycardia catheter ablation in arrhythmogenic right ventricular dysplasia: a 16-year experience". Curr Cardiol Rep. ج. 2 ع. 6: 498–506. DOI:10.1007/s11886-000-0034-1. PMID:11203287.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Philips B, Madhavan S, James C, Tichnell C, Murray B, Dalal D, Bhonsale A, Nazarian S, Judge DP, Russell SD, Abraham T, Calkins H, Tandri H. (أبريل 2012). "Outcomes of Catheter Ablation of Ventricular Tachycardia in Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy (ARVD/C)". J. Am. Coll. Cardiol. ج. 50 ع. 19: 1813–21. DOI:doi: 10.1161/CIRCEP.111.968677. PMID:22492430.
{{استشهاد بدورية محكمة}}: تأكد من صحة قيمة|doi=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "Sevilla star suffers heart attack". BBC Sport. 25 أغسطس 2007. مؤرشف من الأصل في 2017-08-22. اطلع عليه بتاريخ 2007-08-25.
- ^ Sevilla star dies after collapse نسخة محفوظة 01 ديسمبر 2017 على موقع واي باك مشين.
- ^ "Cause of Death". Cardiac Inherited Disease Group. مؤرشف من الأصل في 2007-09-30. اطلع عليه بتاريخ 2006-10-31.
- ^ "Shock at star player's death". icBirmingham.co.uk. 11 سبتمبر 2006. مؤرشف من الأصل في 2012-02-04. اطلع عليه بتاريخ 2007-11-26.
| في كومنز صور وملفات عن: خلل تنسج البطين الأيمن المحدث لاضطراب النظم |

