كلوريد
| كلوريد | |
|---|---|
 |
 |
| تسمية الاتحاد الدولي للكيمياء | |
[1] كلوريد |
|
| المعرفات | |
| رقم CAS | 16887-00-6 |
| بوب كيم (PubChem) | 312 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | Cl- |
| الكتلة المولية | 35٫453 جم لكل مول |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−167 كيلوجول/مول [2] |
| إنتروبيا مولية قياسية S |
153٫36جول/مول/كلفن[2] |
| مركبات متعلقة | |
| أنيونات أخرى | بروميد يوديد |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
أيون الكلوريد هو أنيون (شرسبة : أيون سالب الشحنة) ورمزه الكيميائى هو Cl− . ويتكون عندما يكتسب عنصر الكلور Cl2 (وهو عنصر هالوجيني) إلكترونا أو عندما يذوب مركب مثل غاز كلوريد الهيدروجين HCl في الماء أو في مذيبات قطبية أخرى. أملاح الكلوريد تسمي الكلوريدات ومن أشهرها ملح كلوريد الصوديوم (ملح الطعام) الذي طالما هو ملح ذَوّاب جد في الماء .[3] كلوريد الصوديوم هو كهرل (مادة متأينه) ضروري متواجد في جميع سوائل الجسم مسؤول عن الحافظ على التوازن الحمضي / القاعدي، ونقل النبضات العصبية وتنظيم دخول و خروج السوائل من وإلى خلايا الجسم.[4] كلمة كلوريد أيضا يمكن أن تطلق على الشق الأول من اسم مركب كيميائي تترابط فيه ذرة أو ذرات الكلور بروابط تساهمية. على سبيل المثال، مركب كلوريد الميثيل، الأكثر شيوعاً باسم الكلوروميثان، (CH3Cl) هو مركب عضوي ذو رابطة C-Cl تساهمية . وهو ليس مصدرا لأيون الكلوريد.
الخصائص الإلكترونية[عدل]
أيون الكلوريد أكبر بكثير من ذرة الكلور، فيبلغ قطرهما 167 و 99 بيكومتر، على التوالي. الأيون عديم اللون وضعيف الانفاذية المغنطيسية. الكلوريد يتذاوب للغاية (يترابط بجزيئات المذيب) في المحلول المائي، حيث يكون مربوطا بالنهاية البرُوتُونِيّة لجزيئات الماء.
التواجد في الطبيعة[عدل]
يحتوي ماء البحر على 1٫94٪ كلوريد . بعض المعادن المحتوية على الكلوريد تشمل كلوريدات الصوديوم (الهاليت أو NaCl ) والبوتاسيوم (السلفيت أوKCl )، والمغنيسيوم (بيشوفيت)، وكلوريد المغنيسيوم MgCl2 المُهَدْرَت. كما يدعى الكلوريد الموجود بالدم بمصل الكلوريد، الذي تنظم الكلى تركيزه في الدم. كما أن أيون الكلوريد هو مكون هيكلي لبعض البروتينات، على سبيل المثال، فهو موجود في انزيم الأميليز.
دوره في التجارة[عدل]
تستهلك صناعة الكلور- قلوي قسما رئيسيا من ميزانية الطاقة في العالم. هذه العملية تقوم بتحويل كلوريد الصوديوم (ملح الطعام) إلى الكلور وهيدروكسيد الصوديوم (صودا كاوية) عن طريق التحليل الكهربائي، الذان يستخدم في صناعة العديد من اللوازم والمواد الكيميائية الأخرى. وتنطوي العملية على تفاعلين كيميائيين موازيين هما:
- 2 Cl– → Cl2 + 2 e–
- H2O + 2 e– → H2 + 2 OH–
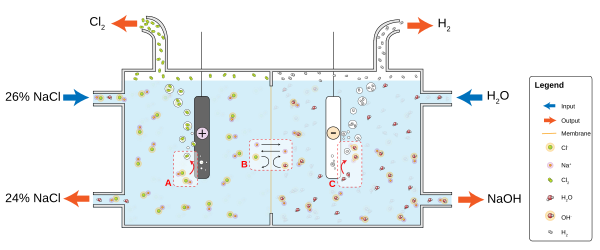
نوعية المياه ومعالجتها[عدل]
تحلية مياه البحر هي تطبيق آخر رئيسي يتضمن الكلوريد، وهو ينطوي على استخدام مكثف للطاقة لإزالة أملاح كلوريد من ماء البحر لإعطاء ماء صالح للشرب. وفي الصناعات النفطية، الكلوريدات هي مكون لسائل الحفر (طين الحفر) يتم مراقبته عن كثب. فالزيادة في الكلوريدات المكونة لطين الحفر قد يكون مؤشرا للحفر خلال تشكيل لمياه مالحة عالية الضغط. كما يمكن أن تكون زيادتها أيضا مؤشرا لسوء نوعية الرمال المستهدفة.[بحاجة لمصدر]
الكلوريد أيضا مفيد وموثوق منه كمؤشر كيميائي دال على مدي التلوث البرازي لمياه الأنهار والمياه الجوفية، حيث أن الكلوريد هو مُذَاب غير متفاعل واسع الانتشار في مياه الصرف الصحي ومياه الشرب. العديد من الشركات التي تنظم الامداد بالمياه في جميع أنحاء العالم تنتفع من الكلوريد في التحقق من مستويات تلوث الأنهار ومصادر المياه الصالحة للشرب.[5]
الاستخدامات المنزلية[عدل]
تستخدم أملاح كلوريد مثل كلوريد الصوديوم للحفاظ على الأطعمة.
التآكل[عدل]
وجود الكلوريدات، على سبيل المثال في مياه البحر، يفاقم بشكل ملحوظ التآكل الائتكالي لمعظم المعادن (بما في ذلك الفولاذ المقاوم للصدأ والمواد عالية الخليطة) من خلال تعزيز تكوين ونمو النقر خلال عملية ذاتية التحفيز.

بلورات كلوريد الصوديوم (ملح الطعام)، والتي هي - على غرار معظم أملاح الكلوريد - عديمة اللون وذَوّابة في الماء. 
بنية كلوريد الصوديوم البلورية، والتي تكشف عن نزوع أيونات الكلوريد (الكُرات الخضراء) للتشابك بعدة كاتيونات (أو أيونات موجبة).
تفاعلات الكلوريد[عدل]
الكلوريد يمكن أكسدته ولكن لا يمكن اختزاله. الأكسدة الأولية للكلوريد، كما يتم توظيفها في عملية صناعة الكلور - قلوي، هي عملية تحويل الكلوريد إلى غاز الكلور. يمكن زيادة عملية الأكسدة لتحويل غاز الكلور إلى أكاسيد وشرسبات مؤكسَدَة (بالإنجليزية: oxyanions) أخرى تشمل الهيبوكلوريت (ClO−، العنصر النشط في مُبيّضات الكلور)، وثاني أكسيد الكلور (ClO2)،و الكلورات (ClO3−)، و البيركلورات (ClO4−).
من حيث خصائص التفاعلات الحمض- قلوية، الكلوريد هو قاعدة ضعيفة جدا كما يتبين من القيمة السالبة لثابت التفكك الحمضي (2-> pKa) لحمض الهيدروكلوريك . الكلوريد يمكن برتنتة (إضافة بروتون H+ له) بواسطة الأحماض القوية، مثل حمض الكبريتيك:
- NaCl + H2SO4 → NaHSO4 + HCl
أملاح الكلوريد الأيونية تتفاعل مع الأملاح الأخرى بواسطة تبادل الأنيونات (الشرسبات)، وغالبا ما يتم الكشف عن وجود الكلوريد في أي محلول بواسطة تكوينه لراسب كلوريد الفضة اللا ذَوَّاب وذلك عند معالجته بأيونات الفضة:
- Cl− + Ag+ → AgCl
أمثلة للكلوريد[عدل]
أقرب مثال للكوريد في حياتنا هو ملح الطعام، و اسمه العلمي هو كلوريد الصوديوم ذو الصيغة الكيميائية NaCl. يتفكك كلوريد الصوديوم أو ملح الطعام في الماء إلى أيونات صوديوم Na + و كلوريد Cl−. أملاح الكلوريد الأخرى مثل كلوريد الكالسيوم وكلوريد المغنيسيوم وكلوريد البوتاسيوم لها استخدامات متنوعة تتراوح بين الاستخدام في العلاج الطبي وتكوين الإسمنت.[3] أما كلوريد الكالسيوم ذو الصيغة الكيميائية CaCl2 فهو عبارة عن ملح يتم تسويقه في شكل حُبَيبَات أو كُرَيّات صغيرة لإزالة الرطوبة من الغرف. يستخدم كلوريد الكالسيوم أيضا للحفاظ على الطرق غير المعبدة (غير المرصوفة) ولتدعيم وتقوية أساسات الطرق للانشاءات الحديثة. وبالإضافة إلى ذلك، يتم استخدام كلوريد الكالسيوم على نطاق واسع كمزيل للجليد (أو مانع لتكون الجليد) لأنه فعال في خفض درجة التجمد أو درجة البلورة عند إستعماله على الجليد.[6]
من أمثلة مُركَّبات الكلوريد المرتبطة تساهميا ثلاثي كلوريد الفوسفور وخماسي كلوريد الفوسفور، وكلوريد الثايونيل، وهي كلها كواشف تكلور تفاعلية يتم استخدامها في المختبرات.
شرسبات التأكسد الأخري[عدل]
يمكن للكلور أن يتخذ خمس حالات أو مراحل أكسدة وهي -1 أو +1 أو +3 أو +5 أو +7. وهناك أيضا العديد من أكاسيد الكلور المتعادلة (الغير مشحونة).
| حالات أو مراحل أكسدة الكلور | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| الاسم | كلوريد chloride |
هيبوكلورايت hypochlorite |
كلوريت chlorite |
كلورات chlorate |
بيركلورات perchlorate |
| الصيغة | Cl− | ClO− | ClO2− | ClO3− | ClO4− |
| البنية | 
|

|

|
طالع أيضا[عدل]
- الهاليدات (مُركبات الهالوجينات)
مراجع[عدل]
- ^ "Chloride ion - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information. مؤرشف من الأصل في 2014-05-18.
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ص. A21.
- ^ أ ب Green, John, and Sadru Damji. "Chapter 3." Chemistry. Camberwell, Vic.: IBID, 2001. Print.
- ^ "Chloride ion - Glossary Entry - Genetics Home Reference". Genetics Home Reference. USA: National Library of Medicine. مؤرشف من الأصل في 2015-11-15. اطلع عليه بتاريخ 2011-03-28.
- ^ Chlorides نسخة محفوظة 18 أغسطس 2016 على موقع واي باك مشين.
- ^ "Common Salts." Test Page for Apache Installation. Web. 22 Mar. 2011. <http://hyperphysics.phy-astr.gsu.edu/hbase/chemical/saltcom.html>. نسخة محفوظة 2021-12-07 على موقع واي باك مشين.
| كلوريد في المشاريع الشقيقة: | |
| |


