خلية غلفانية
الخلية الغلفانية[1][2] (ت.[3][4][5] گلڤانية) وتسمى كذلك الخلية الفولتية هي بطارية اخترعها العالم الإيطالي الأستاذ لويجي جلفاني (تُلفظ لُوِيجي گَالڤَانِي) أستاذ الطب في جامعة بولونيا واكتشفها مصادفة سنة 1786 أثناء تجاربه حول فعل الكهرباء على عضلات الضفادع حيث لاحظ ارتعاش الضفدع في إحدى تجاربه عندما لمس طرفاه معدنين مختلفين في دائرة كهربائية مكتملة، وظن عندها ان مصدر الكهرباء يرجع إلى كهرباء حيوانية إلى أن جاء أستاذ الفيزياء أليساندرو فولتا الذي عزى ظهور الكهرباء إلى أن المعدنين مختلفين، واستطاع فولتا فيما بعد أن يصنع بطارية من هذا النوع وسميت هذه الخلايا باسم أول من اكتشف تلك الظاهرة وهو جلفاني.
وصف الخلية الجلفانية[عدل]

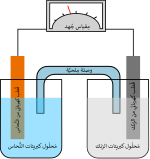
تتكون الخلية الجلفانية من نصفي خليتين. في كل واحدة منها يغطس قطب معدني مختلف عن الآخر، وكما في الشكل أحد القطبان من معدن الزنك Zn والآخر من النحاس Cu. ويغطس كل منهما في محلول لأحد أملاحه: الزنك في محلول كبريتات الزنك ZnSO4 ولوح النحاس في محلول كبريتات النحاس CuSO4. والخاصية الكيميائية هنا أن ذرات المعدن لها ميل لترك المعدن والدخول في المحلول، وهي عندما تفعل ذلك فإنها تترك إلكترونات على اللوح وتدخل المحلول على هيئة أيونات موجبة الشحنة. وكل من أنصاف الخليتين له تفاعله مع محلوله. وهذا النظام يسمى باسم أول من اخترعه دانيل وتسمى تلك الخلية خلية دانيال.

وكما في الشكل نجد أن ذرات الزنك Zn لها ميل أكبر لدخول محلولها عن ذرات النحاس Cu. أي أن تراكم الإلكترونات على لوح الزنك يكون أكبر من تراكمها على لوح النحاس. وبما أن الإلكترونات ذات شحنة سالبة يتكون على لوح الزنك جهدا كهربي سالب الشحنة أكبر من الجهد الكهربي على لوح النحاس. ونظرا لعدم وجود توصيلة خارجية بين القطبين فلا يسير تيار ولا تنتقل الإلكترونات.
وعندما نوصل القطبين من الخارج (بفولتمتر كما في الشكل) تبدأ الإلكترونات الانتقال من القطب Zn الأكثر سالبية إلى قطب النحاس Cu الأكثر إيجابيا (الموجب). ونظرا لأن الإلكترونات ذات شحنة سالبة ينتج تيار كهربائي يسير في عكس اتجاه الإلكترونات. كما يسير في نفس الوقت في المحلول تيار من الأيونات بنفس شدة التيار الخارجي. وتدخل لكل إلكترونين يغادران قطب الخارصين في الدائرة الخارجية إلى قطب النحاس، تدخل ذرة زنك Zn في المحلول على هيئة أيون موجب Zn2+ وذلك لتعويض الإلكترونين اللذان تركا لوح الخارصين من الخارج.
وطبقا للتعريف فالمصعد anode هو القطب الذي تحدث عليه الأكسدة (افتقاد إلكترونات)، وعليه ففي الخلية الجلفانية يمثل قطب الزنك المصعد. ونظرا لأن النحاس قد اكتسب إلكترونين عن طريق التوصيلة الخارجية، يقوم هوالآخر بإعطاء إلكترونين إلى أيون نحاس Cu2+ من محلول كبريتات النحاس فيتعادل ايون النحاس ويترسب على لوح النحاس. وبحسب التعريف فالمهبط cathode هو القطب الذي يحدث عليه الاختزال (أي اكتساب إلكترونات)، فقطب النحاس هو المهبط cathode. وتسير الإلكترونات من المصعد إلى المهبط في الدائرة الكهربائية الخارجية.
حساب القوة الدافعة الكهربية[عدل]
يمكن تعيين فرق الجهد للخلية الكهربائية (القوة الدافعة الكهربية) بواسطة جدول جهد القطب القياسي للعناصر وذلك لكلا من نصفي الخلية. ونفترض عند إجراء هذا التعيين أن التيار المار بين قطبي الخلية يساوي صفرا.
نبدا أولا باختيار المعدنين. ونبحث في الجدول القياسي standard electrode potential عن الجهد القياسي لكل من المعدنين Eo ويُعطى في الجدول بوحدة الفولت. فيكون فرق جهد الخلية مساويا لحاصل طرح الجهدين القياسين للمعدين.
وعلى سبيل المثال ففي الشكل أعلاه لدينا محلولين كبريتات النحاس وكبريتات الخارصين، وينغمس لوح نحاس في كبريتات النحاس كما ينغمس لوح خارصين في محلول كبريتات الخارصين. كما توجد قنطرة بين المحلولين (وهذه يمكن الاستعاضة عنها بغشاء فاصل بين المحلولين) تسمح بمرور أيونات SO42− من محلول النحاس إلى محلول الخارصين (وبذلك تتم الدائرة الكهربية عند توصيل اللوحين من الخارج بموصل.)
لدينا نصفي خلية، واحدة للنحاس Cu والأخرى للخارصين Zn، والتفاعلان الجاريان هما:
التفاعل عند المصعد (الانود):
Zn → Zn2++ 2e- (E = +0.76 V)
التفاعل عند المهبط (الكاثود):
Cu2+ + 2e- → Cu (E = +0.34 V)
وحصلنا لنصف خلية النحاس على جهد الاختزال E == +0.34 V أو جهد التأكسد E == -0.34 V للكاثود
ولنصف خلية الخارصين على جهد التأكسد E == +0.76 V أو جهد الاختزال E == -0.76 V للانود
من جدول السلسلة الكهروكيميائية. أي أن التفاعل الكلي الجاري في الخلية:
Cu2+ + Zn → Cu + Zn2+
ونحصل على فرق جهد الخلية بحاصل طرح: جهد تأكسد الانود (المصعد) - جهد تأكسد الكاثود (المهبط)
- +0.76 - (- V 1.100 = (0.34
أو من حاصل طرح: جهد اختزال الكاثود (المهبط) - جهد اختزال الانود (المصعد)
- +0.34 - (- V 1.100 = (0.76
أو من حاصل جمع جهدي التأكسد للانود والاختزال للكاثود: جهد تأكسد الانود (المصعد) + جهد اختزال الكاثود (المهبط)
- +0.34 + V 1.100 = 0.76
أي أن فرق جهد الخلية في حالة عدم مرور تيار خارجي تساوي 1.100 فولت. ويسمى هذا الجهد القوة الدافعة الكهربائية.
فرق الجهد عند تشغيل البطارية[عدل]
العلاقة بين فرق الجهد والقوة الدافعة الكهربية (electromotive force (e.m.f
نفترض بطارية E قوتها الدافعة الكهربية 12= E فولت ومقاومتها الداخلية 2 أوم، وُصلت بمقاومة خارجية 6 أوم ومفتاح. فرق الجهد بين طرفي البطارية والمفتاح مفتوح (لا يمر تيار):
- فولت 12 = V = E
فرق الجهد والمفتاح مغلق: نعين أولا شدة التيار من العلاقة:
- أمبير (I= E ÷(R+r
حيث:
- E القوة الدافعة الكهربية للبطارية
- R المقاومة الخارجية
- r المقاومة الداخلية للبطارية
فنحصل على التيار:
- أمبير 1.5 =(I= 12 ÷(6+2
ثم نحصل على فرق الجهد V :
- V=E-I.r
- فولت 9 = (2*1.5) - 12 = V
الاتجاه الاصطلاحي للتيار الكهربي[عدل]
يُعبّر التيار الكهربي عن مرور فيض من الشحنات في موصل من القطب الموجب (المهبط)إلى القطب السالب (المصعد). وهذا ماصطلح عليه العلماء منذ زمن بعيد، وذلك لأن اكتشاف الكهربية التيارية حدث قبل اكتشاف الإلكترونات، فقد اصطلح على ذلك.
الاتجاه التقليدي الاصطلاحي: اتجاه التيار في الدائرة الخارجية من القطب الموجب إلى القطب السالب للبطارية.
الاتجاه الإلكتروني: من القطب السالب (الغني بالإلكترونات) إلى الموجب (الفقير بالإلكترونات) خارج البطارية.
الشغل المبذول في الكهرباء[عدل]
الشغل المبذول هو الشغل اللازم بذله لنقل كمية كهربية مقدارها 1 كولوم بين نقطتين بينهما فرق جهد. ويقاس الشغل بوحدة جول، حسب العلاقة:
- W = Q x V
حيث:
W الشغل جول
Q كمية الكهرباء كولوم
V فرق الجهد فولت
ومن تلك العلاقة يمكن تعريف الفولت:
"الفولت هو فرق الجهد بين نقطتين عندما يلزم بذل شغل مقداره 1 جول لنقل كمية كهربية مقدارها 1 كولوم من إحدى النقطتين إلى الأخرى."
- يلاحظ أن وحدة الطاقة الكهربائية هي الجول وهي نفس وحدة الطاقة الحرارية. فطبقا للديناميكا الحرارية يمكن تحويل الطاقة بجميع أنواعها إلى بعضها البعض.
أنظر أيضا ً[عدل]
- تآكل جلفاني
- جلفنة
- بطارية
- مركم
- بطارية الزنك والكربون
- بطارية ليثيوم أيون
- بطارية الرصاص
- بطارية السيارة
- كيمياء كهربية
- نصف تفاعل
- مؤكسد
- قائمة الجهود القياسية
- الهندسة الكهروكيميائية
مراجع[عدل]
- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 207، OCLC:931065783، QID:Q113378673
- ^ المعجم الموحد لمصطلحات الكيمياء: (إنجليزي - فرنسي - عربي)، سلسلة المعاجم الموحدة (5) (بالعربية والإنجليزية والفرنسية)، تونس: مكتب تنسيق التعريب، 1992، ص. 96 (G)، OCLC:982029990، QID:Q114804479
- ^ "Milestones:Volta's Electrical Battery Invention, 1799". IEEE Global History Network. IEEE. مؤرشف من الأصل في 2015-02-21. اطلع عليه بتاريخ 2011-07-26.
- ^ Keithley، Joseph F (1999). Daniell Cell. John Wiley and Sons. ص. 49–51. ISBN:0-7803-1193-0.
- ^ "battery" (def. 4b), Merriam-Webster Online Dictionary (2008). Retrieved 6 August 2008. نسخة محفوظة 23 ديسمبر 2017 على موقع واي باك مشين.
| في كومنز صور وملفات عن: خلية غلفانية |