لانثانوم
| ||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي
| ||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | لانثانوم، 57، La | |||||||||||||||||||||||||||
| تصنيف العنصر | لانثانيدات | |||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | n/a, 6، f | |||||||||||||||||||||||||||
| الكتلة الذرية | 138.90547 غ·مول−1 | |||||||||||||||||||||||||||
| توزيع إلكتروني | Xe]; 5d1 6s2] | |||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 18, 9, 2 (صورة) | |||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 6.162 غ·سم−3 | |||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 5.94 غ·سم−3 | |||||||||||||||||||||||||||
| نقطة الانصهار | 1193 ك، 920 °س، 1688 °ف | |||||||||||||||||||||||||||
| نقطة الغليان | 3737 ك، 3464 °س، 6267 °ف | |||||||||||||||||||||||||||
| حرارة الانصهار | 6.20 كيلوجول·مول−1 | |||||||||||||||||||||||||||
| حرارة التبخر | 402.1 كيلوجول·مول−1 | |||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 27.11 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||
| ضغط البخار (قيم محسوبة) | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||
| أرقام الأكسدة | 3, 2 (أكاسيده قاعدية قوية) | |||||||||||||||||||||||||||
| الكهرسلبية | 1.10 (مقياس باولنغ) | |||||||||||||||||||||||||||
| طاقات التأين | الأول: 538.1 كيلوجول·مول−1 | |||||||||||||||||||||||||||
| الثاني: 1067 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| الثالث: 1850.3 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| نصف قطر ذري | 187 بيكومتر | |||||||||||||||||||||||||||
| نصف قطر تساهمي | 8±207 بيكومتر | |||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري سداسي | |||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة[1] | |||||||||||||||||||||||||||
| مقاومة كهربائية | (درجة حرارة الغرفة) (ألفا، بولي) 615 نانوأوم·متر | |||||||||||||||||||||||||||
| الناقلية الحرارية | 13.4 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||
| التمدد الحراري | (درجة حرارة الغرفة) (ألفا، بولي) 12.1 ميكرومتر/(م·كلفن) | |||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 2475 متر/ثانية (20 °س) | |||||||||||||||||||||||||||
| معامل يونغ | (الشكل ألفا) 36.6 غيغاباسكال | |||||||||||||||||||||||||||
| معامل القص | (الشكل ألفا) 14.3 غيغاباسكال | |||||||||||||||||||||||||||
| معامل الحجم | (الشكل ألفا) 27.9 غيغاباسكال | |||||||||||||||||||||||||||
| نسبة بواسون | (الشكل ألفا) 0.280 | |||||||||||||||||||||||||||
| صلادة موس | 2.5 | |||||||||||||||||||||||||||
| صلادة فيكرز | 491 ميغاباسكال | |||||||||||||||||||||||||||
| صلادة برينل | 363 ميغاباسكال | |||||||||||||||||||||||||||
| رقم CAS | 7439-91-0 | |||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر اللانثانوم | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
اللانثانوم (بالإنجليزية: Lanthanum)عنصر كيميائي له الرمز La والعدد الذري 57 في الجدول الدوري.[2][3] اللانثانوم عنصر لين، قابل للسحب والطرق، لونه فضي أبيض فلز معرض بسهولة لأن يشوه ببطء عند تعرضه للهواء. إنه اسم لسلسلة اللانثانيد، وهي مجموعة من 15 عنصرًا متشابهًا بين اللانثانوم واللوتيتيوم في الجدول الدوري، منها اللانثانوم هو الأول والنموذج الأولي. يُعد اللانثانوم تقليديًا من بين العناصر الأرضية النادرة. حالة الأكسدة المعتادة هي +3. اللانثانوم ليس له دور بيولوجي في البشر ولكنه ضروري لبعض البكتيريا. إنه ليس سامًا بشكل خاص للإنسان ولكنه يظهر بعض النشاط المضاد للميكروبات.
عادة ما يحدث اللانثانوم مع السيريوم والعناصر الأرضية النادرة الأخرى. تم العثور على اللانثانوم لأول مرة من قبل الكيميائي السويدي كارل جوستاف موساندر في عام 1839 كشوائب في نترات السيريوم - ومن هنا جاء اسم اللانثانوم من اليونانية القديمة (λανθάνειν) (اللانثانين)، مما يعني «الكذب مخفيًا». على الرغم من تصنيفه على أنه عنصر أرضي نادر، فإن اللانثانوم هو العنصر الثامن والعشرون الأكثر وفرة في قشرة الأرض، وهو ما يقرب من ثلاثة أضعاف وفرة الرصاص. في المعادن مثل المونازيت والباستناسي، يشكل اللانثانوم حوالي ربع محتوى اللانثانيد.[4] يتم استخراجه من تلك المعادن من خلال عملية معقدة لدرجة أن معدن اللانثانوم النقي لم يتم عزله حتى عام 1923.
مركبات اللانثانوم لها العديد من التطبيقات مثل المحفزات، والمواد المضافة في الزجاج، ومصابيح القوس الكربوني لأضواء الاستوديو وأجهزة العرض، وعناصر الإشعال في الولاعات والمشاعل، وكاثودات الإلكترون، وميض، وأقطاب لحام بقوس التنغستن بالغاز، وأشياء أخرى. تستخدم كربونات اللانثانوم كمواد رابطة للفوسفات في حالات ارتفاع مستويات الفوسفات في الدم عند الإصابة بالفشل الكلوي.
مميزات[عدل]
الخواص الفيزيائية[عدل]
اللانثانوم هو العنصر الأول والنموذج الأولي لسلسلة اللانثانيد. في الجدول الدوري، يظهر على يمين الباريوم الفلزي الأرضي القلوي وعلى يسار اللانثانيد السيريوم. تم التنازع على موضعه، لكن معظم الذين يدرسون الأمر جنبًا إلى جنب مع تقرير IUPAC المؤقت لعام 2021 يعتبرون اللانثانوم هو الأفضل في وضعه كأول عناصر (f-block).[5][6][7][8][9] يتم ترتيب 57 إلكترونًا من ذرة اللانثانوم في الترتيب [Xe] 5d16s2 مع ثلاثة إلكترونات التكافؤ خارج أساس الغازات النبيلة. في التفاعلات الكيميائية، غالبًا ما يتخلى اللانثانوم عن إلكترونات التكافؤ الثلاثة هذه من القشرة الفرعية 5d و 6s لتشكيل حالة الأكسدة +3، مما يحقق التكوين المستقر للغاز النبيل السابق «الزينون».[10] بعض مركبات اللانثانوم (II) معروفة أيضًا، لكنها أقل ثباتًا.[11]
من بين اللانثانيدات، يعتبر اللانثانوم استثنائيًا لأنه لا يحتوي على 4 إلكترونات كذرة غازية واحدة. وبالتالي، فهي ضعيفة للغاية مغناطيسية، على عكس اللانثانيدات ذات المغناطيسية القوية المتأخرة (مع استثناءات الأخيرين، الإيتربيوم واللوتيتيوم، حيث تكون قشرة 4f ممتلئة تمامًا).[12] ومع ذلك، يمكن أن تصبح قشرة اللانثانوم 4f مشغولة جزئيًا في البيئات الكيميائية وتشارك في الترابط الكيميائي.[13] على سبيل المثال، ترتبط نقاط انصهار اللانثانيدات الثلاثية التكافؤ (الكل ما عدا اليوروبيوم والإيتربيوم) بمدى تهجين الإلكترونات 6s و 5 d و 4 f (خفض مع زيادة مشاركة 4f)، [14] ولانثانوم ثاني- أدنى نقطة انصهار بينهم: 920 درجة مئوية. (يحتوي اليوروبيوم والإيتربيوم على نقاط انصهار أقل لأنهما ينتجان حوالي إلكترونين لكل ذرة بدلاً من ثلاثة.) [15] هذا التوافر الكيميائي للمدارات f يبرر وضع اللانثانوم في الكتلة f على الرغم من التكوين الشاذ لحالة الأرض [16][17] (والذي هو مجرد نتيجة التنافر القوي بين الإلكترونات مما يجعله أقل ربحية لاحتلال غلاف 4f، لأنها صغيرة وقريبة من الإلكترونات الأساسية).[18]
تصبح اللانثانيدات أكثر صعوبة مع اجتياز السلسلة: كما هو متوقع، اللانثانوم معدن ناعم. اللانثانوم لديها مرتفعة نسبيا المقاومة من 615 nΩm في درجة حرارة الغرفة؛ وبالمقارنة، فإن قيمة الموصل الجيد للألمنيوم هي 26.50 فقط نيم.[19][20] اللانثانوم هو الأقل تطايرًا من اللانثانيدات.[21] مثل معظم اللانثانيدات، يحتوي اللانثانوم على هيكل بلوري سداسي في درجة حرارة الغرفة. عند 310 درجة مئوية، يتغير اللانثانوم إلى هيكل مكعب محوره الوجه، وعند 865 درجة مئوية، يتغير إلى هيكل مكعب محوره الجسم. [20]
الخواص الكيميائية[عدل]
كما هو متوقع من الاتجاهات الدورية، يمتلك اللانثانوم أكبر نصف قطر ذري من اللانثانيدات. ومن ثم، فهو الأكثر تفاعلًا من بينها، حيث يتلوث بسرعة كبيرة في الهواء، ويتحول إلى مظلم تمامًا بعد عدة ساعات ويمكن أن يحترق بسهولة لتكوين أكسيد اللانثانوم (III)، La 2 O 3، والذي يكاد يكون أساسيًا مثل أكسيد الكالسيوم.[22] ستتآكل عينة بحجم السنتيمتر من اللانثانوم تمامًا في غضون عام حيث ينفجر أكسيده مثل صدأ الحديد، بدلاً من تشكيل طبقة أكسيد واقية مثل الألومنيوم، سكانديوم، الإيتريوم، واللوتيتيوم.[23] يتفاعل اللانثانوم مع الهالوجينات في درجة حرارة الغرفة لتكوين ثلاثي الهاليدات، وعند الاحترار سيشكل مركبات ثنائية مع النيتروجين غير المعدني، والكربون، والكبريت، والفوسفور، والبورون، والسيلينيوم، والسيليكون، والزرنيخ.[10][11] يتفاعل اللانثانوم ببطء مع الماء لتكوين اللانثانوم (III) هيدروكسيد، La (OH) 3 .[24] في حمض الكبريتيك المخفف، يشكل اللانثانوم بسهولة أيون ثلاثي الموجات مائي [La(H2O)9]3+ : هذا عديم اللون في محلول مائي لأن La 3+ لا يحتوي على إلكترونات d أو f.[24] اللانثانوم هو أقوى وأصلب قاعدة بين العناصر الأرضية النادرة، وهو أمر متوقع مرة أخرى من كونه أكبرها.[25]
النظائر[عدل]

يتكون اللانثانوم الموجود بشكل طبيعي من نظيرين، النظير المستقر 139 La والنظير المشع طويل العمر البدائي 138 La. 139 La هو الأكثر وفرة إلى حد بعيد، ويشكل 99.910٪ من اللانثانوم الطبيعي: يتم إنتاجه في عملية s (التقاط النيوترون البطيء، والذي يحدث في النجوم ذات الكتلة المنخفضة إلى المتوسطة) وعملية r (الالتقاط السريع للنيوترونات، والذي يحدث في المستعرات الأعظمية المنهارة الأساسية). إنه النظير الوحيد المستقر من اللانثانوم.[26] النظير النادر جدًا 138 La هو واحد من عدد قليل من النوى البدائية الفردية - الفردية، ذات عمر نصف طويل يبلغ 1.05 × 10 11 سنين. إنها واحدة من النوى p الغنية بالبروتون والتي لا يمكن إنتاجها في عمليات s- أو r . يتم إنتاج 138 La، جنبًا إلى جنب مع أكثر ندرة 180m Ta، في عملية ν، حيث تتفاعل النيوترينوات مع نوى مستقرة.[27] جميع نظائر اللانثانوم الأخرى اصطناعية: باستثناء 137 La مع عمر نصف يبلغ حوالي 60.000 سنوات، جميعهم لديهم نصف عمر أقل من يوم واحد، ومعظمهم يمتلكون نصف عمر أقل من دقيقة. تحدث النظائر 139 La و 140 La كمنتجات انشطار لليورانيوم.[26]
مركبات[عدل]
أكسيد اللانثانوم مادة صلبة بيضاء يمكن تحضيرها عن طريق التفاعل المباشر للعناصر المكونة لها. نظرًا للحجم الكبير لأيون La 3+، يتبنى La 2 O 3 هيكلًا سداسيًا ذي 7 إحداثيات يتغير إلى البنية ذات 6 إحداثيات لأكسيد سكانديوم (Sc 2 O 3) وأكسيد الإيتريوم (Y 2 O 3) في درجة حرارة عالية. عندما يتفاعل مع الماء، يتشكل هيدروكسيد اللانثانوم: تتطور الكثير من الحرارة في التفاعل ويُسمع صوت هسهسة. سوف يتفاعل هيدروكسيد اللانثانوم مع ثاني أكسيد الكربون في الغلاف الجوي لتكوين الكربونات الأساسية.[28]
فلوريد اللانثانوم غير قابل للذوبان في الماء ويمكن استخدامه كاختبار نوعي لوجود La 3+ . هاليدات أثقل كلها قابلة للذوبان جدا ديليكويسسينت المركبات. يتم إنتاج الهاليدات اللامائية عن طريق التفاعل المباشر لعناصرها، حيث يؤدي تسخين الهيدرات إلى التحلل المائي: على سبيل المثال، ينتج عن تسخين LaCl 3 المائي LaOCl.[28]
يتفاعل اللانثانوم طارد للحرارة مع الهيدروجين لإنتاج ثنائي هيدريد LaH2، وهو مركب أسود، قابل إشتعال، هش، موصل بهيكل فلوريد الكالسيوم.[29] هو مركب غير متكافئ، ويمكنه امتصاص المزيد من الهيدروجين، مع ما يصاحب ذلك من فقد في التوصيل الكهربائي، حتى يتم الوصول إلى LaH 3 الذي يشبه الملح. [28] مثل LaI 2 و LaI، من المحتمل أن يكون LaH 2 مركب إلكترودي. [28]
نظرًا لنصف القطر الأيوني الكبير والإيجابية الكهربية الكبيرة لـ La 3+، لا يوجد الكثير من المساهمة التساهمية في الترابط، وبالتالي فهي تمتلك كيمياء تنسيق محدودة، مثل الإيتريوم واللانثانيدات الأخرى.[30] أكسالات اللانثانوم لا تذوب كثيرًا في محاليل أكسالات الفلزات القلوية، وتتحلل [La (acac) 3 (H 2 O) 2 ] حوالي 500 درجة مئوية. الأكسجين هو أكثر ذرات المانحين شيوعًا في مجمعات اللانثانوم، والتي تكون في الغالب أيونية وغالبًا ما يكون لها أرقام تنسيق عالية تزيد عن 6: 8 وهي الأكثر تميزًا، وتشكل هياكل مربعة مضادة للازمات وثنائية الوجوه. هذه الأنواع عالية الإحداثيات، التي تصل إلى التنسيق رقم 12 مع استخدام روابط مخلبية مثل La 2 (SO 4) 3 · 9H 2 O، غالبًا ما تتمتع بدرجة منخفضة من التناظر بسبب العوامل الكيميائية المجسمة.[30]
تميل كيمياء اللانثانوم إلى عدم إشراك الترابط بسبب التكوين الإلكتروني للعنصر: وبالتالي فإن كيمياءه العضوية المعدنية محدودة للغاية. أفضل مركبات اللانثانوم العضوي تميزًا هي مجمع البنتادينيل الحلقي La (C 5 H 5) 3، والذي يتم إنتاجه عن طريق تفاعل LaCl 3 اللامائي مع NaC 5 H 5 في رباعي هيدرو الفوران، ومشتقاته المستبدلة بالميثيل.[31]
تاريخ[عدل]

في عام 1751، اكتشف عالم المعادن السويدي أكسل فريدريك كرونستيد معدنًا ثقيلًا من المنجم في باستناس، سُمي لاحقًا باسم سيريت. بعد ثلاثين عامًا، أرسل ويلهلم هيسينجر البالغ من العمر خمسة عشر عامًا، من العائلة المالكة للمنجم، عينة منه إلى كارل شيل، الذي لم يجد أي عناصر جديدة بداخله. في عام 1803، بعد أن أصبح هيسينجر قائدًا للحديد، عاد إلى المعدن مع يونس جاكوب برزيليوس وعزل أكسيدًا جديدًا أطلقوا عليه اسم سيريا على اسم الكوكب القزم سيريس، والذي تم اكتشافه قبل عامين.[32] تم عزل سيريا بشكل مستقل في وقت واحد في ألمانيا بواسطة مارتن كلابروت.[33] بين 1839 و 1843، وقد أظهرت سيريا أن تكون خليط من أكاسيد من قبل الجراح السويدي والكيميائي كارل جوستاف موساندر، الذي عاش في نفس المنزل كما برزليوس: انه فصل من اثنين من أكاسيد الأخرى التي سماها لانثاناو ديديميوم.[34][35] قام بتحلل عينة من نترات السيريوم جزئيًا عن طريق تحميصها في الهواء ثم معالجة الأكسيد الناتج بحمض النيتريك المخفف.[36] في نفس العام، اكتشف أكسل إردمان، وهو طالب أيضًا في معهد كارولينسكا، اللانثانوم في معدن جديد من جزيرة لافين الواقعة في مضيق نرويجي.
أخيرًا، أوضح موساندر تأخره قائلاً إنه استخرج عنصرًا ثانيًا من السيريوم، وهو ما سماه الديديميوم. على الرغم من أنه لم يدرك ذلك، كان الديديميوم أيضًا خليطًا، وفي عام 1885 تم فصله إلى براسيوديميوم ونيوديميوم.
نظرًا لاختلاف خصائص اللانثانوم اختلافًا طفيفًا عن خصائص السيريوم، وحدثت معه في أملاحه، فقد أطلق عليه من اليونانية القديمة λανθάνειν [لانثانين] (من المفترض أن يكون مخفيًا).[33] تم عزل معدن اللانثانوم النقي نسبيًا لأول مرة في عام 1923.[11]
الحدوث والإنتاج[عدل]
اللانثانوم هو ثالث أكثر اللانثانيدات وفرة، حيث يتكون من 39 ملغم / كغم من قشرة الأرض خلف النيوديميوم عند 41.5 مجم / كجم والسيريوم عند 66.5 ملغم / كغم. وهو ما يقرب من ثلاثة أضعاف وفرة الرصاص في القشرة الأرضية.[37] على الرغم من كونه من بين ما يسمى ب «معادن الأرض النادرة»، فإن اللانثانوم ليس نادرًا على الإطلاق، ولكنه سمي بهذا الاسم تاريخيًا لأنه نادر جدًا من «العناصر الأرضية المشتركة» مثل الجير والمغنيسيا، وتاريخيًا لم يُعرف سوى عدد قليل من الرواسب . يعتبر اللانثانوم معدنًا أرضيًا نادرًا لأن عملية تعدينه صعبة وتستغرق وقتًا طويلاً ومكلفة.[11] نادرًا ما يكون اللانثانوم هو اللانثانيد السائد الموجود في معادن الأرض النادرة، وعادة ما يسبقه السيريوم في صيغه الكيميائية. من الأمثلة النادرة على معادن لا-دومينانت ولا-مونازيت ولا-نثانايت.[38]
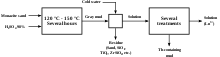
يتشابه حجم أيون La 3+ مع اللانثانيدات المبكرة لمجموعة السيريوم (تلك الموجودة في السماريوم والأوروبيوم) التي تليها مباشرة في الجدول الدوري، ومن ثم فإنها تميل إلى التواجد معها في معادن الفوسفات والسيليكات والكربونات، مثل مثل المونازيت (M III PO 4) وباستناسيت (M III CO 3 F)، حيث يشير M إلى جميع المعادن الأرضية النادرة باستثناء سكانديوم والبروميثيوم المشع (غالبًا Ce و La و Y).[39] عادة ما يفتقر باستناسيت إلى الثوريوم واللانثانيدات الثقيلة، وتنقية اللانثانيدات الخفيفة منه أقل تدخلًا. يتم معالجة الخام، بعد سحقه وطحنه، أولاً بحمض الكبريتيك المركز الساخن، وثاني أكسيد الكربون المتطور، وفلوريد الهيدروجين، ورباعي فلوريد السيليكون: ثم يتم تجفيف المنتج وترشحه بالماء، تاركًا أيونات اللانثانيد المبكرة، بما في ذلك اللانثانوم، في محلول.[40]
يعتبر إجراء المونازيت، الذي يحتوي عادةً على جميع العناصر الأرضية النادرة بالإضافة إلى الثوريوم، أكثر تعقيدًا. يمكن فصل المونازيت، بسبب خصائصه المغناطيسية، عن طريق الفصل الكهرومغناطيسي المتكرر. بعد الفصل، يتم معالجته بحمض الكبريتيك المركز الساخن لإنتاج كبريتات قابلة للذوبان في الماء من أتربة نادرة. يتم معادلة المرشح الحمضي جزئيًا باستخدام هيدروكسيد الصوديوم إلى الرقم الهيدروجيني 3-4. يترسب الثوريوم من المحلول على شكل هيدروكسيد ويزال. بعد ذلك، يتم معالجة المحلول بأكسالات الأمونيوم لتحويل الأتربة النادرة إلى أكسالات غير قابلة للذوبان. يتم تحويل الأكسالات إلى أكاسيد عن طريق التلدين. يتم إذابة الأكاسيد في حمض النيتريك الذي يستبعد أحد المكونات الرئيسية، السيريوم، الذي يكون أكسيده غير قابل للذوبان في HNO 3 . يتم فصل اللانثانوم كملح مزدوج مع نترات الأمونيوم عن طريق التبلور. هذا الملح أقل قابلية للذوبان نسبيًا من الأملاح المزدوجة النادرة الأخرى وبالتالي يبقى في البقايا.[11] يجب توخي الحذر عند التعامل مع بعض المخلفات لأنها تحتوي على 228 Ra، ابنة 232 ث، وهو باعث قوي لأشعة جاما.[40] من السهل نسبيًا استخراج اللانثانوم لأنه يحتوي على لانثانيد واحد مجاور، وهو السيريوم، والذي يمكن إزالته من خلال الاستفادة من قدرته على التأكسد إلى الحالة +4 ؛ بعد ذلك، يمكن فصل اللانثانوم عن طريق الطريقة التاريخية للتبلور الجزئي لـ La (NO 3) 3 · 2NH 4 NO 3 · 4H 2 O، أو عن طريق تقنيات التبادل الأيوني عند الرغبة في درجة نقاء أعلى.[40]
يتم الحصول على معدن اللانثانوم من أكسيده عن طريق تسخينه بكلوريد الأمونيوم أو الفلورايد وحمض الهيدروفلوريك عند 300-400 درجة مئوية لإنتاج الكلوريد أو الفلورايد:[11]
La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 3 H2O
ويتبع ذلك اختزال باستخدام الفلزات الأرضية القلوية أو القلوية في الفراغ أو جو الأرجون:[11]
- LaCl3 + 3 Li → La + 3 LiCl
- أيضًا، يمكن إنتاج اللانثانوم النقي عن طريق التحليل الكهربائي للخليط المنصهر من LaCl 3 و NaCl أو KCl اللامائي في درجات حرارة مرتفعة.[11]
التطبيقات[عدل]

كان أول تطبيق تاريخي للانثانم في عباءات فانوس الغاز. كارل آور فون فلسباخ مزيجًا من أكسيد اللانثانوم وأكسيد الزركونيوم، والذي أطلق عليه اسم أكتينوفور وحصل على براءة اختراع في عام 1886. أعطت الأغطية الأصلية ضوءًا أخضر اللون ولم تكن ناجحة جدًا، وفشلت شركته الأولى، التي أسست مصنعًا في أتزغيرسدورف في عام 1887، في عام 1889.[41]
تشمل الاستخدامات الحديثة لللانثانم ما يلي:

- إحدى المواد المستخدمة في صناعة بطاريات هيدريد معدن النيكل هي مادة أنوديك هي La(Ni3.6Mn0.4Al0.3Co0.7). نظرًا للتكلفة العالية لاستخراج اللانثانيدات الأخرى، يتم استخدام مادة غير متجانسة تحتوي على أكثر من 50 ٪ من اللانثانوم بدلاً من اللانثانوم النقي. المركب مكون بين فلزات AB5 نوع.[42][43] يمكن العثور على بطاريات NiMH في العديد من طرازات تويوتا بريوس المباعة في الولايات المتحدة. تتطلب بطاريات هيدريد النيكل والمعدن الكبيرة كميات هائلة من اللانثانوم للإنتاج. تتطلب بطارية تويوتا بريوس NiMH لعام 2008 10 إلى 15 كيلوغرام (22 إلى 33 رطل) من اللانثانوم. بينما يدفع المهندسون التكنولوجيا لزيادة كفاءة الوقود، قد تكون هناك حاجة إلى ضعف هذه الكمية من اللانثانوم لكل مركبة.[44][45][46]
- يمكن أن تحتوي سبائك الإسفنج الهيدروجين على اللانثانوم. هذه السبائك قادرة على تخزين ما يصل إلى 400 ضعف حجمها من غاز الهيدروجين في عملية امتصاص عكسية. يتم إطلاق الطاقة الحرارية في كل مرة يفعلون ذلك ؛ ولهذه السبائك إمكانيات في أنظمة الحفاظ على الطاقة.[20][47]
- مشميتال وهو خليط فلزات، سبيكة تلقائية الاشتعال تستخدم في أحجار أخف، تحتوي على 25٪ إلى 45٪ من اللانثانوم.[20]
- يستخدم أكسيد اللانثانوم والبوريد في الأنابيب المفرغة الإلكترونية كمواد كاثود ساخنة ذات انبعاث قوي للإلكترونات. بلورات LaB6 تُستخدم في مصادر انبعاث الإلكترون الحراري ذات السطوع العالي والعمر الطويل للمجاهر الإلكترونية ودوافع تأثير هول.[48]
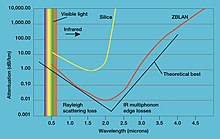
- اللانثانوم ثلاثي فلوريد (LaF3) عنصر أساسي في زجاج فلوريد ثقيل يسمى (ZBLAN). يتمتع هذا الزجاج بنفاذية فائقة في نطاق الأشعة تحت الحمراء، وبالتالي فهو يستخدم لأنظمة اتصالات الألياف الضوئية.[49]
- يعد بروميد اللانثانوم المشبع بالسيريوم وكلوريد اللانثانوم من أحدث المؤشرات الوامضة غير العضوية، والتي تتميز بمزيج من إنتاجية الضوء العالية وأفضل دقة للطاقة والاستجابة السريعة. محصولها العالي يتحول إلى دقة طاقة فائقة ؛ علاوة على ذلك، يكون ناتج الضوء مستقرًا جدًا وعاليًا جدًا على نطاق واسع جدًا من درجات الحرارة، مما يجعله جذابًا بشكل خاص لتطبيقات درجات الحرارة العالية. تستخدم هذه المومضات بالفعل تجاريًا على نطاق واسع في كاشفات النيوترونات أو أشعة جاما.[50]
- تستخدم مصابيح القوس الكربوني مزيجًا من العناصر الأرضية النادرة لتحسين جودة الإضاءة. استهلك هذا التطبيق، وخاصة من قبل صناعة الصور المتحركة لإضاءة الاستوديو والعرض، حوالي 25 ٪ من مركبات الأرض النادرة المنتجة حتى التخلص التدريجي من مصابيح قوس الكربون.[20][51]
- أكسيد اللانثانوم الثلاثي (La2O3) يحسن المقاومة القلوية للزجاج ويستخدم في صنع زجاج بصري خاص، مثل الزجاج الماص للأشعة تحت الحمراء، وكذلك عدسات الكاميرا والتلسكوب، بسبب معامل الانكسار العالي والتشتت المنخفض لنظارات الأرض النادرة.[20] يستخدم أكسيد اللانثانوم أيضًا كمادة مضافة لنمو الحبوب أثناء تلبيد المرحلة السائلة لنتريد السيليكون وثنائي بوريد الزركونيوم.[52]
- تعمل الكميات الصغيرة من اللانثانوم المضافة إلى الفولاذ على تحسين قابليته للتطويع ومقاومة الصدمات والليونة، في حين أن إضافة اللانثانوم إلى الموليبدينوم يقلل من صلابته وحساسيته للتغيرات في درجات الحرارة.[20]
- توجد كميات صغيرة من اللانثانوم في العديد من منتجات حمامات السباحة لإزالة الفوسفات الذي يغذي الطحالب.[53]
- يستخدم أكسيد اللانثانوم المضاف إلى التنغستن في إلكترودات اللحام بالقوس التنغستن بالغاز، كبديل للثوريوم المشع. [54][55]
- تعتبر المركبات المختلفة من اللانثانوم والعناصر الأرضية النادرة الأخرى (الأكاسيد والكلوريدات وما إلى ذلك) مكونات لتحفيز مختلف، مثل محفزات تكسير البترول.[56]
- يستخدم التأريخ الإشعاعي اللانثانوم - الباريوم لتقدير عمر الصخور والخامات، على الرغم من أن هذه التقنية لها شعبية محدودة.[57]
- تمت الموافقة على كربونات اللانثانوم كدواء (فوسرينول ، شاير للأدوية) لامتصاص الفوسفات الزائد في حالات فرط فوسفات الدم الذي يظهر في مرض الكلى في المرحلة النهائية.[58]
- يستخدم فلوريد اللانثانوم في طلاءات مصباح الفوسفور. ممزوجًا بفلوريد اليوروبيوم، يتم تطبيقه أيضًا في الغشاء البلوري لأقطاب الفلورايد الانتقائية للأيونات.[11]
- مثل بيروكسيداز الفجل، يستخدم اللانثانوم كمتتبع كثيف الإلكترون في البيولوجيا الجزيئية.[59]
- يستخدم البنتونايت المعدل باللانثانوم (أو الفوسلوك) لإزالة الفوسفات من المياه في معالجات البحيرة.[60]
الدور البيولوجي[عدل]
اللانثانوم ليس له دور بيولوجي معروف في البشر. يمتص العنصر بشكل سيئ للغاية بعد تناوله عن طريق الفم وعندما يتم التخلص منه يكون بطيئًا جدًا. تمت الموافقة على كربونات اللانثانوم (فوسرينول) كمادة رابطة للفوسفات لامتصاص الفوسفات الزائد في حالات مرض الكلى في نهاية المرحلة.[58]
في حين أن اللانثانوم له تأثيرات دوائية على العديد من المستقبلات والقنوات الأيونية، فإن خصوصيته لمستقبلات جابا (GABA) فريدة من نوعها بين الكاتيونات ثلاثية التكافؤ. يعمل اللانثانوم في نفس موقع التعديل على مستقبل جابا مثل الزنك، وهو مُعدِّل خيفي سلبي معروف. اللانثانوم الكاتيون La 3+ هو مُعدِّل خيفي إيجابي في مستقبلات جابا (GABA) الأصلية والمترابطة، مما يزيد من وقت القناة المفتوحة ويقلل من الحساسية بطريقة تعتمد على تكوين الوحدة الفرعية.[61]
اللانثانوم هو عامل مساعد أساسي لميثانول ديهيدروجينيز لبكتيريا ميثانوتروفيك / ميثيل أسيدفيلوم فوماريوليكوم (SolV)، على الرغم من أن التشابه الكيميائي الكبير بين اللانثانيدات يعني أنه يمكن استبداله بالسيريوم أو البراسيوديميوم أو النيوديميوم بدون تأثيرات ضارة، ومع السماريوم الأصغر، اليوروبيوم، أو الجادولينيوم لا يعطي أي آثار جانبية سوى تباطؤ النمو.[62]
الاحتياطات[عدل]
| لانثانوم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H260 |
| بيانات وقائية وفق GHS | P223, P231+232, P370+378, P422[63] |
| NFPA 704 |
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
اللانثانوم لديه مستوى منخفض إلى متوسط من السمية ويجب التعامل معه بحذر. ينتج عن حقن محاليل اللانثانوم ارتفاع السكر في الدم وانخفاض ضغط الدم وتنكس الطحال وتغيرات الكبد . أدى التطبيق في ضوء قوس الكربون إلى تعرض الناس لأكاسيد العناصر الأرضية النادرة والفلوريدات، مما أدى في بعض الأحيان إلى التهاب الرئة .[64][65] نظرًا لأن La 3+ ion مشابه في الحجم لأيون Ca 2+، فإنه يستخدم أحيانًا كبديل يسهل تتبعه للأخير في الدراسات الطبية.[66] من المعروف أن اللانثانوم، مثل اللانثانيدات الأخرى، يؤثر على التمثيل الغذائي البشري، ويخفض مستويات الكوليسترول، وضغط الدم، والشهية، وخطر تخثر الدم. عند حقنها في الدماغ، فإنها تعمل كمسكن للألم، على غرار المورفين والمواد الأفيونية الأخرى، على الرغم من أن الآلية الكامنة وراء ذلك لا تزال غير معروفة.[66]
انظر أيضًا[عدل]
المراجع[عدل]
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics (PDF). CRC press. 2000. ISBN:0849304814.
- ^ "معلومات عن لانثانوم على موقع treccani.it". treccani.it. مؤرشف من الأصل في 2019-05-25.
- ^ "FZLIPJUXYLNCLC-UHFFFAOYSA-N"%5bInChIKey%5d "معلومات عن لانثانوم على موقع ncbi.nlm.nih.gov". ncbi.nlm.nih.gov. مؤرشف من "FZLIPJUXYLNCLC-UHFFFAOYSA-N"%5bInChIKey%5d الأصل في 2020-10-22.
- ^ "Monazite-(Ce) Mineral Data". Webmineral. مؤرشف من الأصل في 2021-06-08. اطلع عليه بتاريخ 2016-07-10.
- ^ Fluck، E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. ج. 60 ع. 3: 431–36. DOI:10.1351/pac198860030431. مؤرشف من الأصل (PDF) في 2012-03-25. اطلع عليه بتاريخ 2012-03-24.
- ^ ليف لانداو، يفغيني ليفشتز (1958). Quantum Mechanics: Non-Relativistic Theory (ط. 1st). Pergamon Press. ج. Vol. 3. ص. 256–7.
{{استشهاد بكتاب}}:|المجلد=يحوي نصًّا زائدًا (مساعدة) - ^ William B. Jensen (1982). "The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table". J. Chem. Educ. ج. 59 ع. 8: 634–636. Bibcode:1982JChEd..59..634J. DOI:10.1021/ed059p634.
- ^ Jensen، William B. (2015). "The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update". Foundations of Chemistry. ج. 17: 23–31. DOI:10.1007/s10698-015-9216-1. مؤرشف من الأصل في 2021-08-16. اطلع عليه بتاريخ 2021-01-28.
- ^ Scerri، Eric (18 يناير 2021). "Provisional Report on Discussions on Group 3 of the Periodic Table". Chemistry International. ج. 43 ع. 1: 31–34. DOI:10.1515/ci-2021-0115.
- ^ أ ب Greenwood and Earnshaw, p. 1106
- ^ أ ب ت ث ج ح خ د ذ Patnaik، Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. ص. 444–446. ISBN:978-0-07-049439-8. اطلع عليه بتاريخ 2009-06-06.
- ^ Cullity, B. D. and Graham, C. D. (2011) Introduction to Magnetic Materials, John Wiley & Sons, (ردمك 9781118211496)
- ^ Wittig، Jörg (1973). "The pressure variable in solid state physics: What about 4f-band superconductors?". في H. J. Queisser (المحرر). Festkörper Probleme: Plenary Lectures of the Divisions Semiconductor Physics, Surface Physics, Low Temperature Physics, High Polymers, Thermodynamics and Statistical Mechanics, of the German Physical Society, Münster, March 19–24, 1973. Advances in Solid State Physics. Berlin, Heidelberg: Springer. ج. 13. ص. 375–396. DOI:10.1007/BFb0108579. ISBN:978-3-528-08019-8.
- ^ Gschneidner Jr.، Karl A. (2016). "282. Systematics". في Jean-Claude G. Bünzli؛ Vitalij K. Pecharsky (المحررون). Handbook on the Physics and Chemistry of Rare Earths. ج. 50. ص. 12–16. ISBN:978-0-444-63851-9.
- ^ Krishnamurthy, Nagaiyar and Gupta, Chiranjib Kumar (2004) Extractive Metallurgy of Rare Earths, CRC Press, (ردمك 0-415-33340-7)
- ^ Hamilton، David C. (1965). "Position of Lanthanum in the Periodic Table". American Journal of Physics. ج. 33 ع. 8: 637–640. Bibcode:1965AmJPh..33..637H. DOI:10.1119/1.1972042.
- ^ Jensen، W. B. (2015). "Some Comments on the Position of Lawrencium in the Periodic Table" (PDF). مؤرشف من الأصل (PDF) في 2015-12-23. اطلع عليه بتاريخ 2015-09-20.
- ^ Jørgensen، Christian (1973). "The Loose Connection between Electron Configuration and the Chemical Behavior of the Heavy Elements (Transuranics)". Angewandte Chemie International Edition. ج. 12 ع. 1: 12–19. DOI:10.1002/anie.197300121.
- ^ Greenwood and Earnshaw, p. 1429
- ^ أ ب ت ث ج ح خ Lide, D. R.، المحرر (2005)، CRC Handbook of Chemistry and Physics (ط. 86th)، Boca Raton (FL): CRC Press، ISBN:0-8493-0486-5
- ^ The Radiochemistry of the Rare Earths, Scandium, Yttrium, and Actinium نسخة محفوظة 31 أغسطس 2021 على موقع واي باك مشين.
- ^ Greenwood and Earnshaw, p. 1105–7
- ^ "Rare-Earth Metal Long Term Air Exposure Test". مؤرشف من الأصل في 2021-10-25. اطلع عليه بتاريخ 2009-08-08.
- ^ أ ب "Chemical reactions of Lanthanum". Webelements. مؤرشف من الأصل في 2021-10-22. اطلع عليه بتاريخ 2009-06-06.
- ^ Greenwood and Earnshaw, p. 1434
- ^ أ ب قالب:NUBASE 2003
- ^ Woosley، S. E.؛ Hartmann، D. H.؛ Hoffman، R. D.؛ Haxton، W. C. (1990). "The ν-process". The Astrophysical Journal. ج. 356: 272–301. Bibcode:1990ApJ...356..272W. DOI:10.1086/168839.
- ^ أ ب ت ث Greenwood and Earnshaw, p. 1107–8
- ^ Fukai، Y. (2005). The Metal-Hydrogen System, Basic Bulk Properties, 2d edition. Springer. ISBN:978-3-540-00494-3.
- ^ أ ب Greenwood and Earnshaw, pp. 1108–9
- ^ Greenwood and Earnshaw, p. 1110
- ^ "The Discovery and Naming of the Rare Earths". Elements.vanderkrogt.net. مؤرشف من الأصل في 2021-10-26. اطلع عليه بتاريخ 2016-06-23.
- ^ أ ب Greenwood and Earnshaw, p. 1424
- ^ Weeks، Mary Elvira (1956). The discovery of the elements (ط. 6th). Easton, PA: Journal of Chemical Education. مؤرشف من الأصل في 2021-05-18.
- ^ Weeks، Mary Elvira (1932). "The Discovery of the Elements: XI. Some Elements Isolated with the Aid of Potassium and Sodium:Zirconium, Titanium, Cerium and Thorium". The Journal of Chemical Education. ج. 9 ع. 7: 1231–1243. Bibcode:1932JChEd...9.1231W. DOI:10.1021/ed009p1231.
- ^ See:
- ^ "It's Elemental — The Periodic Table of Elements". Jefferson Lab. مؤرشف من الأصل في 2007-04-29. اطلع عليه بتاريخ 2007-04-14.
- ^ Hudson Institute of Mineralogy (1993–2018). "Mindat.org". www.mindat.org. مؤرشف من الأصل في 2021-12-07. اطلع عليه بتاريخ 2018-01-14.
- ^ Greenwood and Earnshaw, p. 1103
- ^ أ ب ت Greenwood and Earnshaw, p. 1426–9
- ^ Evans، المحرر (6 ديسمبر 2012). Episodes from the History of the Rare Earth Elements. Kluwer Academic Publishers. ص. 122. ISBN:9789400902879. مؤرشف من الأصل في 2022-10-24.
- ^ "Inside the Nickel Metal Hydride Battery" (PDF). مؤرشف من الأصل (PDF) في 2009-02-27. اطلع عليه بتاريخ 2009-06-06.
- ^ Tliha، M.؛ Mathlouthi، H.؛ Lamloumi، J.؛ Percheronguegan، A. (2007). "AB5-type hydrogen storage alloy used as anodic materials in Ni-MH batteries". Journal of Alloys and Compounds. ج. 436 ع. 1–2: 221–225. DOI:10.1016/j.jallcom.2006.07.012.
- ^ "As hybrid cars gobble rare metals, shortage looms". Reuters 2009-08-31. 31 أغسطس 2009. مؤرشف من الأصل في 2021-10-25.
- ^ Bauerlein، P.؛ Antonius، C.؛ Loffler، J.؛ Kumpers، J. (2008). "Progress in high-power nickel–metal hydride batteries". Journal of Power Sources. ج. 176 ع. 2: 547. Bibcode:2008JPS...176..547B. DOI:10.1016/j.jpowsour.2007.08.052.
- ^ "Why Toyota offers 2 battery choices in next Prius". 19 نوفمبر 2015. مؤرشف من الأصل في 2021-10-27.
- ^ Uchida، H. (1999). "Hydrogen solubility in rare earth based hydrogen storage alloys". International Journal of Hydrogen Energy. ج. 24 ع. 9: 871–877. DOI:10.1016/S0360-3199(98)00161-X.
- ^ Jason D. Sommerville؛ Lyon B. King. "Effect of Cathode Position on Hall-Effect Thruster Performance and Cathode Coupling Voltage" (PDF). 43rd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 8–11 July 2007, Cincinnati, OH. مؤرشف من الأصل (PDF) في 2011-07-20. اطلع عليه بتاريخ 2009-06-06.
- ^ Harrington, James A. "Infrared Fiber Optics" (PDF). جامعة روتجرز. مؤرشف من الأصل (PDF) في 2010-08-02.
- ^ "BrilLanCe-NxGen" (PDF). مؤرشف من الأصل (PDF) في 2011-04-29. اطلع عليه بتاريخ 2009-06-06.
- ^ (Report).
{{استشهاد بتقرير}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - ^ Kim, K؛ Shim، Kwang Bo (2003). "The effect of lanthanum on the fabrication of ZrB2–ZrC composites by spark plasma sintering". Materials Characterization. ج. 50: 31–37. DOI:10.1016/S1044-5803(03)00055-X.
- ^ Pool Care Basics. ص. 25–26.
- ^ Howard B. Cary (1995). Arc welding automation. CRC Press. ص. 139. ISBN:978-0-8247-9645-7.
- ^ Larry Jeffus. (2003). "Types of Tungsten". Welding : principles and applications. Clifton Park, N.Y.: Thomson/Delmar Learning. ص. 350. ISBN:978-1-4018-1046-7. مؤرشف من الأصل في 2010-09-23.
- ^ C. K. Gupta؛ Nagaiyar Krishnamurthy (2004). Extractive metallurgy of rare earths. CRC Press. ص. 441. ISBN:978-0-415-33340-5.
- ^ S. Nakai؛ A. Masuda؛ B. Lehmann (1988). "La-Ba dating of bastnaesite" (PDF). American Mineralogist. ج. 7 ع. 1–2: 1111. Bibcode:1988ChGeo..70...12N. DOI:10.1016/0009-2541(88)90211-2. مؤرشف من الأصل (PDF) في 2021-10-31.
- ^ أ ب "FDA approves Fosrenol(R) in end-stage renal disease (ESRD) patients". 28 أكتوبر 2004. مؤرشف من الأصل في 2009-04-26. اطلع عليه بتاريخ 2009-06-06.
- ^ Chau YP؛ Lu KS (1995). "Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers". Acta Anatomica. ج. 153 ع. 2: 135–144. DOI:10.1159/000313647. ISSN:0001-5180. PMID:8560966.
- ^ Hagheseresht؛ Wang، Shaobin؛ Do، D. D. (2009). "A novel lanthanum-modified bentonite, Phoslock, for phosphate removal from wastewaters". Applied Clay Science. ج. 46 ع. 4: 369–375. DOI:10.1016/j.clay.2009.09.009.
- ^ Boldyreva, A. A. (2005). "Lanthanum Potentiates GABA-Activated Currents in Rat Pyramidal Neurons of CA1 Hippocampal Field". Bulletin of Experimental Biology and Medicine. ج. 140 ع. 4: 403–5. DOI:10.1007/s10517-005-0503-z. PMID:16671565.
- ^ Pol، Arjan؛ Barends، Thomas R. M.؛ Dietl، Andreas؛ Khadem، Ahmad F.؛ Eygensteyn، Jelle؛ Jetten، Mike S. M.؛ Op Den Camp، Huub J. M. (2013). "Rare earth metals are essential for methanotrophic life in volcanic mudpots". Environmental Microbiology. ج. 16 ع. 1: 255–64. DOI:10.1111/1462-2920.12249. PMID:24034209.
- ^ "Lanthanum 261130". Sigma-Aldrich. مؤرشف من الأصل في 2023-02-25.
- ^ Dufresne، A.؛ Krier، G.؛ Muller، J.؛ Case، B.؛ Perrault، G. (1994). "Lanthanide particles in the lung of a printer". Science of the Total Environment. ج. 151 ع. 3: 249–252. Bibcode:1994ScTEn.151..249D. DOI:10.1016/0048-9697(94)90474-X. PMID:8085148.
- ^ Waring، P. M.؛ Watling، R. J. (1990). "Rare earth deposits in a deceased movie projectionist. A new case of rare earth pneumoconiosis". The Medical Journal of Australia. ج. 153 ع. 11–12: 726–30. DOI:10.5694/j.1326-5377.1990.tb126334.x. PMID:2247001.
- ^ أ ب Emsley، John (2011). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ص. 266–77. ISBN:9780199605637. مؤرشف من الأصل في 2022-08-10.
فهرس[عدل]
- Greenwood، Norman N.؛ Earnshaw، Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN:0-08-022057-6.
قراءة متعمقة[عدل]
- الكيمياء الصناعية من اللانثانون، الإيتريوم، الثوريوم واليورانيوم، بقلم آر جي كالو، مطبعة بيرغامون، 1967.
- التعدين الاستخراجي للأتربة النادرة، بقلم سي كي جوبتا و إن كريشنامورثي، مطبعة سي آر سي، 2005.
- معامل الكيمياء المعدنية، سكانديوم، إتريوم، عناصر دي تيريس، أكتينيوم، بي بسكال، محرر، ماسون وسي، 1959.
- كيمياء اللانثانون، بقلم آر سي فيكري، بتروورثس 1953.
| في كومنز صور وملفات عن: لانثانوم |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||

