الوراثة اللاجينية للسرطان
هذه مقالة غير مراجعة. (مايو 2020) |
| صنف فرعي من | |
|---|---|
| جزء من | |
| الموضوع |
علم الوراثة اللاجيني للسرطان: هو دراسة التعديلات الوراثية اللاجينية للحمض النووي للخلايا السرطانية التي لا تنطوي على تغيير في تسلسل النوكليوتيدات وبدلاً من ذلك تنطوي على تغيير في طريقة التعبير عن الشفرة الجينية. وقد تكون التعديلات اللاجينية مهمة أو حتى أكثر أهمية من الطفرات الجينية في تحول الخلية إلى السرطان.و يحدث فقدان التعبير عن الجينات في السرطانات بشكل متكرر حوالي 10 مرات عن طريق إسكات النسخ (الناجم عن فرط مثيلة المروج اللاجيني لجزر CpG) من الطفرات. وكما Vogelstein وآخرون نشير إلى أنه في سرطان القولون والمستقيم عادة ما يكون هناك حوالي 3 إلى 6 طفرات سائق و 33 إلى 66 طفرة متغيرة أو ركاب.[1] ومع ذلك في أورام القولون مقارنة مع الغشاء المخاطي القولوني المجاور الذي يظهر بشكل طبيعي وهناك حوالي 600 إلى 800 جزر CpG ذات ميثيل كثيف في محفزات الجينات في الأورام بينما لا يتم تمثيل جزر CpG هذه في الغشاء المخاطي المجاور.[2] [3] [4] يعد التلاعب بالتغيرات الجينية الوعائية أمرًا رائعًا للوقاية من السرطان واكتشافه وعلاجه.[5] [6] وفي أنواع مختلفة من السرطان، ومجموعة متنوعة من آليات جينية يمكن مضطرب مثل إسكات الجينات القامع الورم وتفعيل من الجينات المسرطنة التي غيرت الدليل السياسي الشامل جزيرة مثيلة أنماط وهيستون التعديلات والتقلبات من البروتينات الحمض النووي ملزم ويتم الآن استخدام العديد من الأدوية التي لها تأثير جيني في العديد من هذه الأمراض.


الآليات[عدل]
مثيلة الحمض النووي[عدل]
وفي الخلايا الجسدية تنتقل أنماط مثيلة الحمض النووي بشكل عام إلى الخلايا الوليدة بدقة عالية.[7] وعادة يحدث هذا المثيلة فقط في السيتوزينات التي تقع على 5 'إلى الغوانوزين في ثنائي النوكليوتيدات CpG من حقيقيات النواة ذات الترتيب الأعلى.[8] ومع ذلك تختلف مثيلة DNA الوراثية اللاجينية بين الخلايا الطبيعية والخلايا الورمية في البشر. وغالبًا ما يتم عكس ملف تعريف مثيلة CpG «الطبيعي» في الخلايا التي تصبح مولدة للأورام. وفي الخلايا الطبيعية تكون جزر CpG السابقة للمحفزات الجينية غير ممزوجة بشكل عام وتميل إلى أن تكون نشطة نسبيًا، في حين تميل ثنائيات CpG الفردية الأخرى في جميع أنحاء الجينوم إلى الميثيل. ومع ذلك غالبًا ما تكون جزر CpG السابقة للمحفزات الجينية الكابتة للورم مفرطة الميثيل في الخلايا السرطانية، في حين يتم تقليل مثيلة CpG لمناطق المروج الورمي وتسلسل التكرار الطفيلي.[9]
يمكن أن يؤدي فرط المثيلة في مناطق محفز الجينات الكابتة للورم إلى إسكات تلك الجينات. يسمح هذا النوع من الطفرات اللاجينية للخلايا بالنمو والتكاثر بشكل لا يمكن السيطرة عليه مما يؤدي إلى تكوين الورم. وتتسبب إضافة مجموعات الميثيل إلى السيتوزينات في أن يلتف DNA بإحكام حول بروتينات الهيستون مما ينتج عنه DNA الذي لا يمكن أن يخضع للنسخ (DNA الصامت بالنسخة). وعادة ما يتم إسكات الجينات بشكل نسبي بسبب فرط المثيلة المعززة بما يلي: مثبط كيناز يعتمد Cyclin p16 ، مثبط دورة الخلية؛ MGMT ، جين إصلاح الحمض النووي. APC ، منظم دورة الخلية؛ MLH1 ، جين إصلاح الحمض النووي. وBRCA1 ، جين آخر لإصلاح الحمض النووي. في الواقع، يمكن أن تصبح الخلايا السرطانية مدمنة على إسكات النسخ ويعود السبب إلى فرط المثيلة المحرض لبعض الجينات الكابتة للأورام الرئيسية، وهي عملية تعرف باسم إدمان الجينات.[10]
يؤدي فرط مثيلة ثنائي نيوكليوتيد CpG في أجزاء أخرى من الجينوم إلى عدم استقرار الكروموسوم بسبب آليات مثل فقدان البصمة وإعادة تنشيط العناصر القابلة للاستبدال. ويزيد فقدان بصمة جين عامل النمو الشبيه بالأنسولين (IGF2) من خطر الإصابة بسرطان القولون والمستقيم ويرتبط بمتلازمة بيكويث-ويديمان مما يزيد بشكل كبير من خطر الإصابة بسرطان الأطفال حديثي الولادة. وفي الخلايا السليمة توجد النيوكليوتيدات CpG ذات الكثافة المنخفضة في مناطق الترميز وغير الترميز. يتم كبت التعبير عن بعض التتابعات المتكررة وإعادة التركيب الاختزالي في الوسطيات من خلال المثيلة [11]
يحتوي الجينوم الكامل للخلية السرطانية على ميثيل سيتوزين أقل بكثير من جينوم الخلية السليمة. وفي الواقع تمتلك جينومات الخلايا السرطانية مثيلة أقل بنسبة 20-50 ٪ في ثنائي نوكليوتيدات CpG الفردية عبر الجينوم. وعادة ما تكون جزر CpG الموجودة في مناطق المروج محمية من مثيلة الحمض النووي. وفي الخلايا السرطانية تكون جزر CpG ناقصة الميثيل [12] المناطق المرافقة لجزر CpG التي تسمى شواطئ جزيرة CpG هي المكان الذي تحدث فيه معظم مثيلة الحمض النووي في سياق CpG dinucleotide. يتم ميثيل الخلايا السرطانية بشكل احتمالي في شواطئ جزيرة CpG. في الخلايا السرطانية ينتقل فرط المثيلة في شواطئ جزيرة CpG إلى جزر CpG أو ينتقل hypomethylation من جزر CpG إلى شواطئ جزيرة CpG مما يزيل الحدود الوراثية الوراثية الحادة بين هذه العناصر الجينية.[13] في الخلايا السرطانية «نقص تروية الدم العالمي» بسبب الاختلال في ميثيل ترانسفيراز الحمض النووي (DNMTs) قد يشجع على إعادة التركيب الانقسامية وإعادة ترتيب الكروموسوم مما يؤدي في النهاية إلى اختلال الصيغة الصبغية عندما تفشل الكروموسومات في الانقسام بشكل صحيح أثناء الانقسام الفتيلي.
إن مثيلة CpG Island مهمة في تنظيم التعبير الجيني ولكن مثيلة السيتوزين يمكن أن تؤدي مباشرة إلى زعزعة استقرار الطفرات الجينية وحالة خلوية سرطانية. السيتوزينات المميتة تجعل التحلل المائي لمجموعة الأمين والتحول التلقائي إلى الثيمين أكثر ملاءمة. ويمكن أن يسبب تجنيد زائف لبروتينات الكروماتين. ميثيلات السيتوزين تغير كمية امتصاص ضوء الأشعة فوق البنفسجية لقاعدة النوكليوتيد مما يخلق dimers بيريميدين. عندما ينتج عن الطفرة فقدان تغاير الزيجوت في مواقع الجينات الكابتة للورم وقد تصبح هذه الجينات غير نشطة. يمكن أن يكون لطفرات زوج قاعدة واحدة أثناء النسخ تأثيرات ضارة.
تعديل الهيستون[عدل]
يحتوي الحمض النووي الحقيقي النواة على بنية معقدة. يتم لفه بشكل عام حول بروتينات خاصة تسمى الهستونات لتشكيل بنية تسمى النواة. يتكون النواة من مجموعتين من 4 هيستونات: H2A و H2B و H3 و H4 بالإضافة إلى ذلك يساهم الهيستون H1 في تغليف الحمض النووي خارج النواة. يمكن لبعض الإنزيمات المعدلة للهستون أن تضيف أو تزيل المجموعات الوظيفية إلى الهستونات وتؤثر هذه التعديلات على مستوى نسخ الجينات الملفوفة حول هذه الهستونات ومستوى تكرار الحمض النووي. تميل ملفات تعديل الهيستون للخلايا السليمة والسرطانية إلى الاختلاف.
تُظهر الخلايا السرطانية نقصًا في الأشكال أحادية الأسيتيل وثلاثي الميثيل من الهيستون H4 (انخفاض H4ac و H4me3) بالمقارنة مع الخلايا السليمة. وبالإضافة إلى ذلك أظهرت نماذج الفأرة أن انخفاض في الهيثون H4R3 ثنائي الميثيل غير المتماثل (H4R3me2a) من المروج p19ARF مرتبط بحالات أكثر تقدمًا من الأورام الخبيثة والانبثاث. في نماذج الفأرة، يزداد فقدان أستلة الهيستون H4 وثلاثي ميثيل مع استمرار نمو الورم. إن فقدان الهيستون H4 Lysine 16 acetylation (H4K16ac)، وهو علامة على الشيخوخة في التيلوميرات، يفقد بشكل خاص أستيلته. يأمل بعض العلماء أن هذه الخسارة الخاصة في أستلة الهستون قد تتم معالجتها بمثبط هيستون ديسيتيلياز (HDAC) الخاص بـ SIRT1 ، وهو HDAC خاص بـ H4K16
علامات هيستون الأخرى المرتبطة تكون الأورام وتشمل زيادة deacetylation (انخفاض أستلة) من الهستونات H3 وH4، انخفضت trimethylation من هيستون H3 ليسين 4 (H3K4me3)، وزيادة monomethylation من هيستون H3 ليسين 9 (H3K9me) وtrimethylation من هيستون H3 يسين 27 (H3K27me3). يمكن لهذه التعديلات الهيستون إسكات جينات الورم على الرغم من انخفاض مثيلة جزيرة CpG للجين (وهو حدث ينشط عادة الجينات). ينظم الجين الكابت للورم p53 إصلاح الحمض النووي ويمكن أن يسبب موت الخلايا المبرمج في الخلايا غير المنظمة. أوضح E Soto-Reyes و F Recillas-Targa أهمية بروتين CTCF في تنظيم تعبير p53. CTCF ، أو عامل ربط CCCTC ، هو بروتين إصبع الزنك الذي يعزل المروج p53 من تراكم علامات الهيستون القمعية. في أنواع معينة من الخلايا السرطانية، لا يرتبط بروتين CTCF بشكل طبيعي، ويقوم المروج p53 بتجميع علامات الهيستون القمعية، مما يتسبب في انخفاض تعبير p53.
قد تحدث الطفرات في آلية اللاجينية نفسها أيضًا ومن المحتمل أن تكون مسؤولة عن تغيير الملامح الجينية للخلايا السرطانية. يتم الحفاظ على المتغيرات الهيستونية لعائلة H2A بشكل كبير في الثدييات، وتلعب أدوارًا حاسمة في تنظيم العديد من العمليات النووية عن طريق تغيير بنية الكروماتين. أحد المتغيرات الرئيسية H2A ، H2A. X ، يشير إلى تلف الحمض النووي مما يسهل توظيف بروتينات إصلاح الحمض النووي لاستعادة السلامة الجينومية. متغير آخر H2A. Z يلعب دورًا مهمًا في كل من تنشيط الجينات والقمع. مستوى عال من H2A. تم الكشف عن تعبير Z في العديد من السرطانات ويرتبط بشكل كبير بالانتشار الخلوي وعدم الاستقرار الجينومي. [9] يعد الماكرو H2A1 المتغير الهيستوني مهمًا في التسبب في العديد من أنواع السرطانات، على سبيل المثال في سرطان الخلايا الكبدية.[14] تتضمن الآليات الأخرى انخفاضًا في H4K16ac قد يكون ناتجًا عن انخفاض نشاط نشاط أستيل ترانسفيراز الهيستون (HATs) أو زيادة في نزع الأمين بواسطة SIRT1. وبالمثل وهو تعطيل انزياح الإطار طفرة في HDAC2 و deacetylase هيستون الذي يعمل على العديد من هيستون الذيل lysines ، ارتبط مع السرطان تظهر أنماط أستلة هيستون تغير. تشير هذه النتائج إلى آلية واعدة لتغيير الملامح الجينية من خلال تثبيط أو تعزيز الإنزيم.
يمكن أن يؤدي تلف الحمض النووي الناتج عن ضوء الأشعة فوق البنفسجية والإشعاع المؤين والسموم البيئية والمواد الكيميائية الأيضية إلى عدم استقرار الجينوم والسرطان. يتم التوسط في استجابة تلف الحمض النووي لفواصل الحمض النووي المزدوجة الشريط (DSB) جزئيًا من خلال تعديلات الهيستون. في DSB ، يعيد مركب البروتين MRE11 - RAD50 - NBS1 (MRN) ترنح توسع الشعريات المتحور (ATM) كيناز الذي يفسر الفسفوريلات Serine 129 من Histone 2A. MDC1 ، وسيط نقطة تفتيش تلف الحمض النووي 1 يرتبط بفسفوببتيد، وقد تنتشر فسفرة H2AX عن طريق حلقة تغذية مرتدة إيجابية لتوظيف MRN-ATM وفسفرة. TIP60 acetylates و γH2AX ، وهو بعد ذلك polyubiquitylated . RAP80 ، وهو وحدة فرعية من مركب بروتين قابلية الإصابة بسرطان الثدي من النوع 1 لإصلاح الحمض النووي (BRCA1 -A)، ويربط ubiquitin المرتبط بالهستونات. يقوم نشاط BRCA1-A باعتقال دورة الخلية عند نقطة التفتيش G2 / M ، مما يسمح بوقت لإصلاح الحمض النووي أو قد يبدأ موت الخلايا المبرمج.
إسكات جينات MicroRNA[عدل]
في الثدييات تنظم الحمض النووي الريبي الصغير (miRNAs) حوالي 60٪ من النشاط النسخي لجينات ترميز البروتين.[15] تخضع بعض الجزيئات الدقيقة أيضًا لإسكات مرتبط بالمثيلة في الخلايا السرطانية. ويلعب كل من Let-7 و miR15 / 16 أدوارًا مهمة في تقليل الأورام المسرطنة لـ RAS وBCL2 ، ويحدث إسكاتها في الخلايا السرطانية. لوحظ انخفاض في التعبير عن مير -125 ب 1، وهو ميرنا يعمل كمثبط للورم في سرطانات البروستات والمبيض والثدي والخلايا الدبقية. أظهرت التجارب في المختبر أن miR-125b1 يستهدف جينين HER2 / neu و ESR1 ، المرتبطين بسرطان الثدي. مثيلة الحمض النووي على وجه التحديد فرط مثيلة هي واحدة من الطرق الرئيسية التي يتم إسكات مير -125 ب 1 جينيًا. في المرضى الذين يعانون من سرطان الثدي لوحظ فرط المثيلة لجزر CpG الموجود بالقرب من موقع بدء النسخ. فقدان ارتباط CTCF وزيادة في علامات الهيستون القمعية H3K9me3 و H3K27me3 ويرتبط مع مثيلة الحمض النووي وإسكات miR-125b1. من الناحية الميكانيكية وقد يعمل CTCF كعنصر حد لوقف انتشار مثيلة الحمض النووي. إن نتائج التجارب التي أجراها Soto-Reyes وآخرون يشير إلى التأثير السلبي للمثيلة على وظيفة وتعبير مير -125 ب 1. لذلك استنتجوا أن مثيلة الحمض النووي لها دور في إسكات الجين. علاوة على ذلك يتم إسكات بعض ميرنا جينيًا في وقت مبكر من سرطان الثدي وبالتالي يمكن أن تكون هذه ميرنا مفيدة كعلامات الورم. إن إسكات جينات ميرنا الجيني عن طريق مثيلة الحمض النووي الشاذ هو حدث متكرر في الخلايا السرطانية. تم العثور على ما يقرب من ثلث المروج miRNA النشطة في خلايا الثدي الطبيعية مفرط الميثيل في خلايا سرطان الثدي - وهذا هو نسبة أكبر عدة أضعاف مما لوحظ عادة لجينات ترميز البروتين.[16]
الترميز الأيضي لعلم الوراثة اللاجيني في السرطان[عدل]
يسمح عدم تنظيم التمثيل الغذائي لخلايا الورم بتوليد كتل البناء اللازمة وكذلك تعديل العلامات الجينية لدعم بدء السرطان وتطوره. إن تغير التغيرات الأيضية التي يسببها السرطان المشهد اللاجيني وخاصة التعديلات على الهستونات والحمض النووي وبالتالي تعزيز التحول الخبيث والتكيف مع التغذية غير الكافية والانبثاث. يمكن أن يستهدف تراكم بعض المستقلبات في السرطان الإنزيمات اللاجينية لتغيير المشهد اللاجيني عالميًا. تؤدي التغيرات الأيضية المرتبطة بالسرطان إلى إعادة ترميز علامات جينية خاصة بالمكان. ويمكن إعادة برمجة التوليد الجيني للسرطان بدقة عن طريق عملية التمثيل الغذائي الخلوي من خلال 1) تعديل الاستجابة لجرعة السرطان التولد الجيني بواسطة المستقلبات. 2) التوظيف المتسلسل للأنزيمات الأيضية؛ و 3) استهداف الإنزيمات اللاجينية عن طريق الإشارات الغذائية.[17]
MicroRNA وإصلاح الحمض النووي[عدل]
يبدو أن تلف الحمض النووي هو السبب الأساسي للسرطان.[18] [19] إذا كان إصلاح الحمض النووي ناقصًا فإن تلف الحمض النووي يميل إلى التراكم. ويمكن أن يؤدي هذا التلف الزائد في الحمض النووي إلى زيادة الأخطاء الطفرية أثناء تكرار الحمض النووي بسبب تخليق translesion المعرضة للخطأ. ويمكن أن يؤدي تلف الحمض النووي الزائد أيضًا إلى زيادة التغيرات الجينية بسبب أخطاء أثناء إصلاح الحمض النووي.[20] [21] يمكن أن تؤدي هذه الطفرات والتغيرات الجينية إلى الإصابة بالسرطان (انظر الأورام الخبيثة).
وتسبب طفرات خط الجراثيم في جينات إصلاح الحمض النووي 2-5 ٪ فقط من حالات سرطان القولون.[22] ومع ذلك فإن التعبير المتغير عن الرنا الميكروي مما يسبب نقصًا في إصلاح الحمض النووي وغالبًا ما يرتبط بالسرطان وقد يكون عاملاً سببيًا مهمًا لهذه السرطانات.
وقد يؤدي الإفراط في التعبير عن بعض الجزيئات الجزيئية الدقيقة إلى تقليل التعبير عن بروتينات معينة لإصلاح الحمض النووي. وان وآخرون.[23] ويشير إلى 6 جينات لإصلاح الحمض النووي يتم استهدافها مباشرة بواسطة miRNAs المشار إليها بين قوسين: ATM (miR -421)، RAD52 (miR -210، miR -373) RAD23B (mi -373)، MSH2 (miR -21)، BRCA1 (mi-182) و P53 (mi-504، mi-125b). في الآونة الأخيرة Tessitore et al.[24] سرد المزيد من جينات إصلاح الحمض النووي التي يتم استهدافها مباشرة بواسطة miRNAs إضافية بما في ذلك ATM (miR-18a ، miR-101)، DNA-PK (miR-101)، ATR (miR -185)، Wip1 (miR -16) و MLH1 و MSH2 و MSH6 (مير 155) و ERCC3 و ERCC4 (مير 192) و UNG2 (mir-16 و miR-34c و miR-199a). من بين هذه ميرنا ومير -16 ومير -18 أ ومير -21 ومير -34 سي ومير -125 ب ومير 101 ومير 155 ومير -182 مير -185و مير -192 ومن بين تلك التي حددها شنكنبورغر و Diederich [25] كما تم الإفراط في التعبير عنه في سرطان القولون من خلال hypomethylation اللاجيني. ويمكن أن يؤدي الإفراط في التعبير عن أي واحد من هذه الجزيئات الدقيقة إلى تقليل التعبير عن جين إصلاح الحمض النووي المستهدف.
يبدو أن ما يصل إلى 15 ٪ من أوجه القصور في MLH1 في سرطانات القولون المتفرقة ناتجة عن الإفراط في التعبير عن microRNA miR-155 الذي يقمع تعبير MLH1.[26] ومع ذلك تم العثور على غالبية 68 سرطانات القولون المتفرقة مع انخفاض التعبير عن بروتين إصلاح عدم تطابق الحمض النووي MLH1 تعاني من نقص بسبب المثيلة اللاجينية لجزيرة CpG للجين MLH1.[27]
في 28 ٪ من الأورام الأرومية الدبقية، يكون بروتين إصلاح الحمض النووي MGMT معيبًا ولكن لا يتم تمثيل المروج MGMT . في ورم أرومي دبقي بدون محفزات MGMT الميثيلية ويرتبط مستوى microRNA miR-181d عكسياً بتعبير البروتين لـ MGMT والهدف المباشر لـ miR-181d هو MGMT mRNA 3'UTR (المنطقة الثلاث غير المترجمة من MGMT mRNA). وهكذا وفي 28 ٪ من الأورام الأرومية الدبقية وقد يكون زيادة التعبير عن miR-181d وانخفاض التعبير عن إنزيم إصلاح الحمض النووي MGMT عاملاً سببيًا. في 29-66٪ [28] [29] من glioblastomas وإصلاح الحمض النووي هو ناقص بسبب مثيلة جينية من <i id="mwAUU">MGMT</i> الجينات مما يقلل من التعبير البروتين من MGMT.
بروتينات المجموعة A عالية الحركة (HMGA) التي تتميز بخطاف AT هي بروتينات صغيرة غير هيستونية مرتبطة بالكروماتين يمكنها تعديل النسخ. تتحكم MicroRNAs في التعبير عن بروتينات HMGA ، وهذه البروتينات (HMGA1 و HMGA2) هي عناصر تحكم في نسخ الكروماتين المعماري. بالمييري وآخرون.[30] أظهرت أنه في الأنسجة الطبيعية، HGMA1 والجينات HMGA2 يتم استهداف (وبالتالي تخفيض بقوة في التعبير) من خلال مير 15، مير-16، مير 26A ، مير 196a2 ودعونا-7A .
يكاد لا يمكن الكشف عن تعبير HMGA في أنسجة البالغين المتمايزة ولكنه مرتفع في العديد من السرطانات. بروتينات HGMA هي عديد الببتيدات ~ 100 بقايا حمض أميني تتميز بتنظيم تسلسل معياري. وتحتوي هذه البروتينات على ثلاث مناطق ذات شحنة موجبة للغاية وتسمى خطاطيف AT والتي تربط الأخدود البسيط لامتدادات الحمض النووي الغني بـ AT في مناطق محددة من DNA. وتظهر الأورام البشرية بما في ذلك سرطان الغدة الدرقية والبروستات وعنق الرحم وسرطان القولون والمستقيم والبنكرياس والمبيض زيادة قوية في بروتينات HMGA1a و HMGA1b.[31] الفئران المعدلة وراثيا مع HMGA1 المستهدفة للخلايا اللمفاوية تتطور سرطان الغدد الليمفاوية العدوانية مما يدل على أن تعبير HMGA1 المرتفع لا يرتبط فقط بالسرطانات ولكن الجين HMGA1 يمكن أن يكون بمثابة ورم يسبب السرطان.[32] أظهر Baldassarre وآخرون، [33] أن بروتين HMGA1 يرتبط بمنطقة المروج لجين إصلاح الحمض النووي BRCA1 ويمنع نشاط محفز BRCA1 . كما أظهروا أنه على الرغم من أن 11٪ فقط من أورام الثدي مصابة بفرط المثيلة لجين BRCA1 ، فإن 82٪ من سرطانات الثدي العدوانية لديها تعبير بروتين BRCA1 منخفض، ومعظم هذه التخفيضات كانت بسبب إعادة تشكيل الكروماتين بمستويات عالية من بروتين HMGA1.
يستهدف بروتين HMGA2 على وجه التحديد مروج ERCC1 ، مما يقلل من التعبير عن هذا الجين لإصلاح الحمض النووي.[34] كان تعبير البروتين ERCC1 ناقصًا في 100 ٪ من 47 من سرطانات القولون التي تم تقييمها (على الرغم من أن مدى تورط HGMA2 غير معروف).[35]
بالمييري وآخرون. [30] أظهر أن كل من miRNAs التي تستهدف جينات HMGA تنخفض بشكل كبير في جميع أورام الغدة النخامية البشرية المدروسة تقريبًا عند مقارنتها بالغدة النخامية الطبيعية. تماشيًا مع التنظيم السفلي لهذه الـ MiRNAs التي تستهدف HMGA لوحظت زيادة في mRNAs HMGA1 و HMGA2. ثلاثة من هذه الرنا الميكروي (مير -16، مير -196 أ وليت -7 أ) [25] [36] لها محفزات ميثليّة وبالتالي تعبير منخفض في سرطان القولون بالنسبة لاثنين من هذه المركبات، MiR-15 و miR-16 يتم إسكات مناطق الترميز بشكل غير جيني في السرطان بسبب نشاط هيستون ديسيتيليز.[37] عندما يتم التعبير عن هذه الرناوات الدقيقة على مستوى منخفض يتم التعبير عن بروتينات HMGA1 و HMGA2 على مستوى عال الهدف HMGA1 و HMGA2 (تقليل التعبير عن) جينات إصلاح DNA BRCA1 و ERCC1 . وبالتالي يمكن تقليل إصلاح الحمض النووي، مما يساهم على الأرجح في تطور السرطان. [19]
مسارات إصلاح الحمض النووي[عدل]
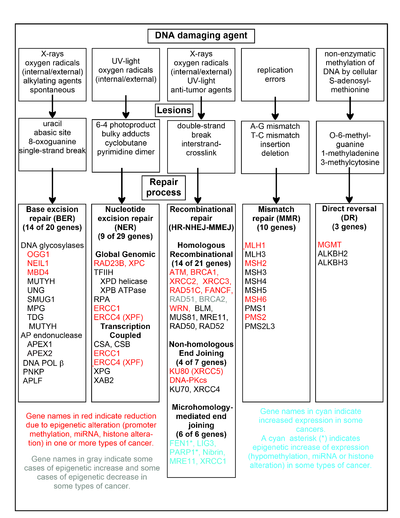
يوضح الرسم البياني في هذا القسم بعض عوامل إتلاف الحمض النووي المتكررة وأمثلة لآفات الحمض النووي التي تسببها والمسارات التي تتعامل مع أضرار الحمض النووي هذه. يتم استخدام 169 إنزيمًا على الأقل مباشرة في إصلاح الحمض النووي أو التأثير على عمليات إصلاح الحمض النووي.[38] ويعمل 83 من هؤلاء مباشرة في إصلاح 5 أنواع من أضرار الحمض النووي الموضحة في الرسم البياني.
يتم عرض بعض الجينات المدروسة جيدًا المركزية لعمليات الإصلاح هذه في الرسم البياني. وتشير التسميات الجينية الموضحة باللون الأحمر أو الرمادي أو السماوي إلى أن الجينات غالبًا ما تتغير بشكل جيني في أنواع مختلفة من السرطانات. وتصف مقالات ويكيبيديا على كل من الجينات التي تم تمييزها باللون الأحمر أو الرمادي أو السماوي التغيرات (التغيرات) اللاجينية والسرطان (السرطانات) التي توجد فيها هذه الوخزات. توثق مقالتان واسعتان للتجربة [39] [40] أيضًا معظم هذه النواقص الجينية لإصلاح الحمض النووي في السرطانات.
وكثيراً ما يتم تقليل أو إسكات الجينات المظللة باللون الأحمر عن طريق الآليات اللاجينية في سرطانات مختلفة. عندما يكون لهذه الجينات تعبير منخفض أو غائب ويمكن أن تتراكم أضرار الحمض النووي. يمكن أن تؤدي أخطاء التكرار التي تتجاوز هذه الأضرار (انظر توليف transleion) إلى زيادة الطفرات وفي النهاية السرطان. يبدو أن القمع اللاجيني لجينات إصلاح الحمض النووي في مسارات إصلاح الحمض النووي الدقيقة أمر أساسي لتكوين السرطنة.
إن الجينين المظللين باللون الرمادي RAD51 و BRCA2 مطلوبان لإصلاح الترابط المتماثل. في بعض الأحيان يتم الإفراط في التعبير الجيني بشكل مبالغ فيه وأحيانًا أقل من التعبير عنه في بعض أنواع السرطان. كما هو مبين في مقالات ويكيبيديا على RAD51 و BRCA2 ، فإن مثل هذه السرطانات عادة ما يكون بها نقص جيني في جينات إصلاح الحمض النووي الأخرى. من المرجح أن تتسبب أوجه القصور في الإصلاح هذه في زيادة أضرار الحمض النووي التي لم يتم إصلاحها. قد يعكس الإفراط في التعبير عن RAD51 و BRCA2 الظاهر في هذه السرطانات الضغوط الانتقائية للتعبير التعويضي RAD51 أو BRCA2 الزائد وزيادة الإصلاح التأشبي المتجانس للتعامل جزئيًا على الأقل مع هذه الأضرار الزائدة للحمض النووي. في الحالات التي يكون فيها RAD51 أو BRCA2 ناقصًا التعبير وسيؤدي هذا في حد ذاته إلى زيادة أضرار الحمض النووي التي لم يتم إصلاحها. أخطاء التكرار بعد هذه الأضرار (انظر توليف transleion) يمكن أن تسبب زيادة الطفرات والسرطان بحيث يكون نقص التعبير عن RAD51 أو BRCA2 مسبباً للسرطان في حد ذاته.
توجد الجينات التي يبرزها السماوي في مسار الانضمام النهائي بوساطة الميكروميولوجيا (MMEJ) ويتم تنظيمها في مجال السرطان. MMEJ هو مسار إصلاح إضافي غير دقيق معرضة للخطأ لفواصل مزدوجة. في إصلاح MMEJ لكسر حبلا مزدوج، فإن تجانس 5-25 زوجًا أساسيًا مكملًا بين كل من الخيوط المزدوجة يكفي لمحاذاة الخيوط ولكن عادة ما تكون النهايات غير المتوافقة (اللوحات) موجودة. يزيل MMEJ النوكليوتيدات الإضافية (اللوحات) حيث يتم ربط الخيوط ثم يربط الخيوط لإنشاء حلزون مزدوج للحمض النووي السليم. تتضمن MMEJ دائمًا حذفًا صغيرًا على الأقل بحيث يكون مسارًا مطفرًا.[41] FEN1 ، نوكلياز السديلة في MMEJ يزداد بشكل جيني من خلال نقص ترطيب المروج ويتم التعبير عنه بشكل مفرط في غالبية سرطانات الثدي و [42] البروستاتا و [43] المعدة و [44] [45] الأورام العصبية و [46] البنكرياس و [47] والرئة.[48] ويتم التعبير عن PARP1 أيضًا بشكل مفرط عندما يكون موقع ETS الخاص بمنطقة المروج فيه خاليًا من ميثيل الميثيل مما يساهم في تقدم سرطان بطانة الرحم و [49] سرطان المبيض الذي يتحور BRCA و [50] وسرطان المبيض المصاحب لطفرة BRCA.[51] ويتم أيضًا التعبير عن الجينات الأخرى في مسار MMEJ بشكل مفرط في عدد من السرطانات (انظر MMEJ للملخص)، وتظهر أيضًا باللون الأزرق.
تواتر الوخيم في جينات إصلاح الحمض النووي[عدل]
تزيد أوجه القصور في بروتينات إصلاح الحمض النووي التي تعمل في مسارات إصلاح الحمض النووي الدقيقة من خطر الطفرة. ويتم زيادة معدلات الطفرة بقوة في الخلايا التي بها طفرات في إصلاح عدم تطابق الحمض النووي [52] [53] أو في إصلاح الترابط المتماثل (HRR).[54] الأفراد الذين لديهم طفرات موروثة في أي من جينات إصلاح الحمض النووي الـ 34 معرضون بشكل متزايد لخطر الإصابة بالسرطان (انظر عيوب إصلاح الحمض النووي وزيادة خطر الإصابة بالسرطان).
في السرطانات المتفرقة يُعزى أحيانًا نقص في إصلاح الحمض النووي إلى طفرة في جين إصلاح الحمض النووي ولكن في كثير من الأحيان يتم تقليل أو غياب التعبير عن جينات إصلاح الحمض النووي بسبب التغيرات الجينية التي تقلل أو تسكت التعبير الجيني. على سبيل المثال بالنسبة لـ113 من سرطانات القولون والمستقيم التي تم فحصها بالتسلسل أربعة فقط لديهم طفرة خاطئة في جين إصلاح الحمض النووي <i id="mwAcY">MGMT</i> في حين أن الغالبية قللت من تعبير MGMT بسبب مثيلة منطقة المروج MGMT (تغيير لا جيني).[55] وبالمثل من بين 119 حالة من سرطانات القولون والمستقيم التي تفتقر إلى إصلاح غير متطابقة والتي تفتقر إلى تعبير PMS2 الجيني لإصلاح الحمض النووي كان البروتين PMS2 يعاني من نقص في 6 بسبب الطفرات في جين PMS2 بينما في 103 حالات كان التعبير PMS2 ناقصًا بسبب قمع شريكه MLH1 بسبب مثيلة المروج (بروتين PMS2 غير مستقر في غياب MLH1). [27] في الحالات العشر الأخرى ومن المحتمل أن يكون فقدان تعبير PMS2 بسبب الإفراط في التفسير الجيني للـ microRNA ، miR-155، الذي ينظم MLH1. [26]
إن العيوب اللاجينية في جينات إصلاح الحمض النووي متكررة في السرطانات - كما في الجدول - تم تقييم العديد من السرطانات للتعبير المخفض أو الغائب عن جين إصلاح الحمض النووي ذي الأهمية والتكرار الموضح هو التردد الذي كان فيه السرطان يعاني من نقص جيني في التعبير الجيني. ومن المرجح أن تنشأ مثل هذه النواقص اللاجينية في وقت مبكر من التسبب في السرطان حيث يتم العثور عليها أيضًا بشكل متكرر (على الرغم من تردد أقل إلى حد ما) في العيب الميداني المحيط بالسرطان الذي نشأ منه السرطان (انظر الجدول).
| السرطان | الجينات | تردد في السرطان | تردد في الميدان عيب | Ref. |
|---|---|---|---|---|
| القولون والمستقيم | MGMT | 46% | 34% | [56] |
| القولون والمستقيم | MGMT | 47% | 11% | [57] |
| القولون والمستقيم | MGMT | 70% | 60% | [58] |
| القولون والمستقيم | MSH2 | 13% | 5% | |
| القولون والمستقيم | ERCC1 | 100% | 40% | [35] |
| القولون والمستقيم | PMS2 | 88% | 50% | |
| القولون والمستقيم | XPF | 55% | 40% | |
| الرأس والعنق | MGMT | 54% | 38% | [59] |
| الرأس والعنق | MLH1 | 33% | 25% | [60] |
| الرأس والعنق | MLH1 | 31% | 20% | [61] |
| المعدة | MGMT | 88% | 78% | [62] |
| المعدة | MLH1 | 73% | 20% | [63] |
| المريء | MLH1 | 77%-100% | 23%-79% | [64] |
يبدو أن السرطانات قد تبدأ في كثير من الأحيان عن طريق تقليل التخلّق الوراثي في التعبير عن واحد أو أكثر من إنزيمات إصلاح الحمض النووي. ومن المحتمل أن يسمح إصلاح الحمض النووي المنخفض بتراكم أضرار الحمض النووي. وقد يؤدي توليف السرنجة المعرضة للخطأ بعد بعض أضرار الحمض النووي هذه إلى حدوث طفرة ذات ميزة انتقائية وقد تنمو رقعة استنساخ بميزة انتقائية وتتفوق على الخلايا المجاورة مما يشكل عيبًا في المجال على الرغم من عدم وجود ميزة انتقائية واضحة للخلية لتقليل إصلاح الحمض النووي فقد يتم نقل نبض جين إصلاح الحمض النووي كراكب عندما يتم تكرار الخلايا ذات الطفرة المفيدة بشكل انتقائي. وفي الخلايا التي تحمل كلاً من تنشيط جين إصلاح الحمض النووي والطفرة ذات الميزة الانتقائية ستتراكم المزيد من أضرار الحمض النووي ويمكن أن تؤدي هذه بدورها إلى طفرات أخرى ذات مزايا انتقائية أكبر. وبالتالي قد تساهم العيوب اللاجينية في إصلاح الحمض النووي في التكرار العالي المميز للطفرات في جينومات السرطانات، وتسبب تطورها المسرطن.
للسرطان مستويات عالية من عدم استقرار الجينوم وترتبط بتواتر مرتفع من الطفرات. ويزيد التواتر العالي للطفرات الجينومية من احتمالية حدوث طفرات معينة تعمل على تنشيط الجينات السرطانية وإبطال عمل الجينات الكابتة للورم مما يؤدي إلى الإصابة بالسرطان على أساس تسلسل الجينوم الكامل وجد أن السرطانات لديها آلاف إلى مئات الآلاف من الطفرات في جينوماتها بالكامل.[65] (انظر أيضًا ترددات الطفرة في السرطانات. وبالمقارنة فإن تكرار الطفرة في الجينوم الكامل بين الأجيال للبشر (من الأب إلى الطفل) هو حوالي 70 طفرة جديدة لكل جيل.[66] [67] وفي مناطق ترميز البروتين في الجينوم لا يوجد سوى حوالي 0.35 طفرة بين أجيال الآباء / الأطفال (أقل من بروتين متحور واحد لكل جيل).[68] ولم يجد تسلسل الجينوم الكامل في خلايا الدم لزوج من مواليد التوأم البالغ من العمر 100 عامًا سوى 8 اختلافات جسدية، على الرغم من أن الاختلاف الجسدي الذي يحدث في أقل من 20 ٪ من خلايا الدم لن يتم اكتشافه.[69]
وفي حين أن أضرار الحمض النووي قد تؤدي إلى حدوث طفرات من خلال توليف نقل الدم المعرض للخطأ فإن أضرار الحمض النووي يمكن أن تؤدي أيضًا إلى تغيرات جينية أثناء عمليات إصلاح الحمض النووي الخاطئة. [20] [21] [70] [71] يمكن أن تكون أضرار الحمض النووي التي تتراكم بسبب عيوب إصلاح الحمض النووي اللاجيني مصدرًا للتغييرات اللاجينية المتزايدة الموجودة في العديد من الجينات في السرطانات. وفي دراسة مبكرة - انظر في مجموعة محدودة من المروجين النسخية - فرنانديز وآخرون.[72] فحص ملامح مثيلة الحمض النووي لـ 855 من الأورام الأولية بمقارنة كل نوع من أنواع الورم مع الأنسجة الطبيعية المقابلة له وأظهر 729 موقع جزيرة CpG (55٪ من 1322 موقع CpG تم تقييمه) مثيلة DNA تفاضلية ومن بين هذه المواقع كان 496 ميثيل ميثيل (مكبوت) و 233 ميثيل ميثيل (منشط). وبالتالي هناك مستوى عال من تعديلات مثيلة محفز اللاجيني في الأورام. قد تساهم بعض هذه التغييرات الجينية في تطور السرطان.
المسرطنات اللاجينية[عدل]
تعتبر مجموعة متنوعة من المركبات مواد مسرطنة وراثية - وهي تؤدي إلى زيادة حدوث الأورام لكنها لا تظهر نشاط الطفرات (يجب استبعاد المركبات السامة أو مسببات الأمراض التي تسبب حدوث الأورام زيادة التجدد). تشمل الأمثلة على ثنائي إيثيل ستيلبرول والزرنيخ وسداسي كلور البنزين ومركبات النيكل.
تمارس العديد من المسرات تأثيرات محددة على الجنين من خلال الآليات الوراثية اللاجينية [73] [74] في حين أن التأثيرات الوراثية قد تحافظ على تأثير المسخ مثل ثنائي إيثيل ستيل بيسترول طوال حياة الطفل المصاب فإن إمكانية العيوب الخلقية الناتجة عن تعرض الآباء أو في الأجيال الثانية واللاحقة من النسل تم رفضها بشكل عام لأسباب نظرية ونقص في دليل.[75] ومع ذلك فقد تم عرض مجموعة من التشوهات بوساطة الذكور ومن المرجح أن يكون هناك المزيد.[76] إن معلومات تسمية FDA لـ Vidaza عبارة عن تركيبة من 5-azacitidine (وهو تناظري لا مثيل له من cytidine يتسبب في نقص الميثيل عند دمجه في DNA) تنص على أنه «يجب نصح الرجال بعدم الأب لطفل» أثناء استخدام الدواء مستشهداً بالأدلة في الفئران الذكور المعالجة انخفاض الخصوبة وزيادة فقدان الجنين وتطور الجنين غير الطبيعي.[77] في الفئران لوحظت اختلافات الغدد الصماء في ذرية الذكور المعرضين للمورفين.[78] وتم وصف آثار الجيل الثاني من ثنائي إيثيل ستيلبسترول عن طريق الآليات اللاجينية.[79]
الأنواع الفرعية للسرطان[عدل]
سرطان الجلد هو سرطان جلدي مميت ينشأ من الخلايا الصباغية ومن المعروف أن العديد من التغييرات الجينية تلعب دورًا في انتقال الخلايا الصباغية إلى خلايا سرطان الجلد هذه التعديلات هي نتيجة إلغاء القيود على الإنزيمات المقابلة لها من بين هذه الإنزيمات العديد من ميثيل ترانسفيراز و demethylases.[80]
سرطان البروستات[عدل]
يقتل سرطان البروستاتا حوالي 35000 رجل سنويًا ويتم تشخيص حوالي 220.000 رجل بسرطان البروستاتا سنويًا في أمريكا الشمالية وحدها. سرطان البروستاتا هو السبب الرئيسي الثاني للوفيات الناجمة عن السرطان لدى الرجال وخلال حياة الرجل، يعاني واحد من كل ستة رجال من المرض وتحدث تغيرات في أستلة الهيستون ومثيلة الدنا في جينات مختلفة تؤثر على سرطان البروستاتا.[81] أكثر من 90٪ من حالات سرطان البروستاتا تظهر إسكات الجينات التي hypermethylation جزيرة الدليل السياسي الشامل لل GSTP1 الجين المروج والذي يحمي البروستاتا الخلايا من التلف الجيني الذي يسببه تأكسد أو مختلفة من المواد المسرطنة ويشير تفاعل سلسلة البلمرة الخاصة بالميثيل في الوقت الفعلي (PCR) إلى أن العديد من الجينات الأخرى هي أيضًا مفرطة الميثيل. يمكن تعديل التعبير الجيني في البروستاتا عن طريق التغذية وتغيير نمط الحياة.[82]
سرطان عنق الرحم[عدل]
الورم الخبيث الثانية الأكثر شيوعا لدى النساء هو الغازية سرطان عنق الرحم (ICC) وأكثر من 50٪ من جميع سرطان عنق الرحم الغازية (ICC) سببه oncongenic البشرية فيروس الورم الحليمي 16 (HPV16). علاوة على ذلك يحدث سرطان الورم داخل الظهارة (CIN) في المقام الأول بسبب الورم الحليمي البشري HPV16. كما هو الحال في العديد من الحالات لا يتخذ العامل المسبب للسرطان دائمًا مسارًا مباشرًا من العدوى إلى تطور السرطان. وارتبطت أنماط مثيلة الجينوم بسرطان عنق الرحم الغزوي ضمن منطقة HPV16L1 ويحتوي 14 موقعًا CpG تم اختباره على مثيلة أعلى بكثير في CIN3 + من جينومات HPV16 من النساء اللواتي ليس لديهن CIN3 . تم العثور فقط على مواقع 2/16 CpG التي تم اختبارها في المنطقة التنظيمية المنبع HPV16 لارتباطها بزيادة المثيلة في CIN3 + وهذا يشير إلى أن الطريق المباشر من الإصابة بالسرطان يتم تحويله في بعض الأحيان إلى حالة سرطانية في الأورام داخل الظهارة في عنق الرحم بالإضافة إلى ذلك تم العثور على زيادة مثيلة موقع CpG في مستويات منخفضة في معظم الجينات النووية المضيفة الخمسة التي تمت دراستها بما في ذلك 5/5 TERT و 1/4 DAPK1 و 2/5 RARB و MAL و CADM1 . علاوة على ذلك ارتبط 1/3 من مواقع CpG في DNA الميتوكوندريا بزيادة المثيلة في CIN3 + وبالتالي يوجد ارتباط بين CIN3 + وزيادة مثيلة مواقع CpG في إطار القراءة المفتوح HPV16 L1. يمكن أن يكون هذا علامة بيولوجية محتملة للشاشات المستقبلية لأمراض عنق الرحم السرطانية والسرطانية.
سرطان الدم[عدل]
أظهرت الدراسات الحديثة أن جين اللوكيميا المختلط النسب (MLL) يسبب سرطان الدم عن طريق إعادة ترتيبه ودمجه مع جينات أخرى في الكروموسومات المختلفة وهي عملية تخضع للتحكم الجيني.[83]
ساركوما[عدل]
هناك حوالي 15000 حالة جديدة من الإصابة بساركوما في الولايات المتحدة كل عام، ومن المتوقع أن يموت حوالي 6200 شخص بسبب ساركوما في الولايات المتحدة في عام 2014.[84] وتتكون ساركوما عددًا كبيرًا من الأورام الوسيطة غير المتجانسة النادرة والمتجانسة نسبيًا والتي تشمل على سبيل المثال ساركومة غضروفية وساركومة إيوينج وساركومة عضلية عضلية وساركومة دهنية وساركوما عظمية وساركوما زلالية وساركوما (سنخية وجنينية). ويتم تغيير العديد من جينات الأورام والجينات الكابتة للورم بشكل جيني في ساركوما وتشمل هذه APC و CDKN1A و وCDKN2A و CDKN2B و Ezrin و FGFR1 و GADD45A و MGMT STK3 و STK4 و PTEN و RASSF1A و WIF1 ، بالإضافة إلى العديد من miRNAs.[85] ويتم تحرير التعبير عن المعدلات اللاجينية مثل تلك الخاصة بمكون BMI1 لمركب PRC1 في ساركومة الغضروف وساركومة إيوينج وساركومة العظام ويتم تغيير التعبير عن مكون EZH2 في مركب PRC2 في ساركومة إيوينغ وساركوما العضلة المخططة وبالمثل يتم زيادة التعبير عن معدِّل وراثي آخر، وهو LSD1 histone demethylase في ساركومة الغضروف وساركومة إيوينغ وساركومة العظام وساركومة العضلة المخططة واستهداف المخدرات وتثبيط EZH2 في ساركومة Ewing [86] أو LSD1 في العديد من الساركوما [87] يمنع نمو الخلايا السرطانية في هذه الساركوما.
طرق التعريف[عدل]
كانت ملفات التعريف الجينية تقتصر على الجينات الفردية تحت الفحص من قبل فريق بحثي معين في السابق. ومع ذلك اتجه العلماء مؤخرًا نحو نهج جينومي أكثر لتحديد ملف جينومي كامل للخلايا السرطانية مقابل الخلايا السليمة.
تتضمن الأساليب الشائعة لقياس مثيلة CpG في الخلايا ما يلي:
- تسلسل بيسلفيت
- التحليل المشترك لقيود البسلفيت (كوبرا)
- PCR الخاص بالمثيلة
- ميثيل لايت
- التقسيم البيروسي
- تقييد المسح الجينومي التاريخي
- التعسفي PCR
- مقايسة HELP (تخصيب جزء صغير من HpaII بواسطة PCR بوساطة الربط)
- Chromatin immunoprec هطول الأمطار Chip-Chip باستخدام الأجسام المضادة الخاصة ببروتينات مجال ربط الميثيل- CpG
- مثبطات د ن أ ميثيل ميثيل-ديب
- ملامح التعبير الجيني عبر المصفوفة DNA : مقارنة مستويات مرنا من خطوط الخلايا السرطانية قبل وبعد العلاج بعامل إزالة الميثيل
نظرًا لأن تسلسل بيسلفيت يعتبر المعيار الذهبي لقياس مثيلة CpG عند استخدام إحدى الطرق الأخرى يتم تأكيد النتائج عادةً باستخدام تسلسل بيسلفيت [1]. تتضمن الأساليب الشائعة لتحديد ملفات تعريف تعديل الهيستون في الخلايا السرطانية مقابل الخلايا السليمة ما يلي:
- قياس الطيف الكتلي
- فحص الكروماتين المناعي
التشخيص والمراجع[عدل]
ويأمل الباحثون في تحديد ملفات تعريف جينية محددة لأنواع وأنواع مختلفة من السرطان بهدف استخدام هذه الملفات كأدوات لتشخيص الأفراد بشكل أكثر دقة ودقة ونظرًا لتغيير الملامح الجينية يرغب العلماء في استخدام الملامح الجينية الجينية المختلفة لتحديد مرحلة تطور أو مستوى عدوانية سرطان معين في المرضى. وعلى سبيل المثال تم ربط فرط المثيلة لجينات ترميز كيناز بروتين الموت المرتبط (DAPK) ص 16، وبروتين الغشاء الظهاري 3 (EMP3) بأشكال أكثر عدوانية من سرطان الرئة والقولون والمستقيم وسرطان الدماغ. يمكن أن يؤثر هذا النوع من المعرفة على الطريقة التي سيشخص بها الأطباء ويختارون علاج مرضاهم.
العامل الآخر الذي سيؤثر على علاج المرضى هو معرفة مدى استجابتهم لبعض العلاجات ويمكن أن توفر الملامح الشخصية الجينية للخلايا السرطانية نظرة ثاقبة في هذا المجال. وعلى سبيل المثال MGMT هو إنزيم يعكس عكس إضافة مجموعات الألكيل إلى غوانين النوكليوتيدات ومع ذلك فإن ألكلة الجوانين هي الآلية التي تعمل من خلالها العديد من أدوية العلاج الكيميائي من أجل تعطيل الحمض النووي وتسبب موت الخلايا. لذلك إذا كان الجين الذي يشفر MGMT في الخلايا السرطانية مفرط الميثيل ويتم بالفعل إسكاته أو قمعه فإن أدوية العلاج الكيميائي التي تعمل عن طريق ميثيل الجوانين ستكون أكثر فعالية من الخلايا السرطانية التي تحتوي على إنزيم MGMT فعال.
يمكن أن تستخدم المؤشرات الحيوية اللاجينية كأدوات للتنبؤ الجزيئي في عينات الخزعة من الورم الأولي والعقدة الليمفاوية المنصفية فإن فرط المثيلة لكل من CDKN2A و CDH13 بمثابة علامة على زيادة خطر انتكاس السرطان بشكل أسرع ومعدل وفاة أعلى للمرضى.
معالجة[عدل]
يلعب التحكم الوراثي في مناطق البروتو-أونكو وتسلسل كابتة الورم عن طريق التغيرات المطابقة في الهستونات دورًا في تكوين السرطان وتطوره.[88] إن الأدوية التي تعكس التغيرات الجينية قد يكون لها دور في مجموعة متنوعة من السرطانات. [81] [89]
ومن المعروف في الآونة الأخيرة أن الارتباط بين الأنماط السرطانية المحددة والتغيرات الوراثية يمكن أن يسهل تطوير عقاقير epi الجديدة.[90] وقد ركز تطوير الأدوية بشكل رئيسي على تعديل DNA methyltransferase و histone acetyltransferase (HAT) و histone deacetylase (HDAC).[91]
وتشمل الأدوية التي تستهدف بشكل خاص نمط المثيلة المقلوب للخلايا السرطانية مثبطات ميثيل ترانسفيراز DNA أزاسيتيدين [92] [93] وديسيتابين.[94] [95] وتُستخدم هذه الأدوية المضادة للميثيل في علاج متلازمة خلل التنسج النقوي [96] وهو سرطان دم تنتجه الخلايا الجذعية غير الطبيعية لنخاع العظم. وتثبط هذه العوامل جميع الأنواع الثلاثة من ميثيل ترانسفيراز DNA النشط وكان يُعتقد أنها شديدة السمية لكنها أثبتت فعاليتها عند استخدامها بجرعة منخفضة مما يقلل من تقدم متلازمة خلل التنسج النقوي إلى سرطان الدم.
تُظهر مثبطات الهيستون ديسيتيليز (HDAC) فاعلية في علاج ليمفوما الخلايا التائية. وتمت الموافقة على اثنين من مثبطات HDAC و vorinostat و romidepsin من قبل إدارة الغذاء والدواء ومع ذلك فإن معرفة الآلية الأساسية على المستوى الجزيئي لاستجابة المريض مطلوبة لتعزيز كفاءة استخدام هذه المثبطات كعلاج نظرًا لأن مثبطات HDAC هذه تغير حالة الأسيلة للعديد من البروتينات بالإضافة إلى الهيستون المهمة، وتم العثور على العلاج بمثبطات HDAC لتعزيز إعادة تنشيط الجينات بعد أن مثبطت مثبطات ميثيل ترانسفيرازات DNA النسخ. تمت الموافقة على Panobinostat في حالات معينة في الورم النقوي.[97]
إن الأهداف الصيدلانية الأخرى في البحث هي هيستون لايسيل ميثيل ترانسفيراز (KMT) وبروتين أرجينين ميثيل ترانسفيراز (PRMT).[98] اقترحت دراسة ما قبل السريرية أن lunasin قد يكون لها تأثيرات جينية مفيدة محتملة.[99]
انظر أيضا[عدل]
المراجع[عدل]
- ^ "Cancer genome landscapes". Science. ج. 339 ع. 6127: 1546–58. مارس 2013. Bibcode:2013Sci...339.1546V. DOI:10.1126/science.1235122. PMC:3749880. PMID:23539594.
- ^ "Orphan CpG islands identify numerous conserved promoters in the mammalian genome". PLoS Genetics. ج. 6 ع. 9: e1001134. سبتمبر 2010. DOI:10.1371/journal.pgen.1001134. PMC:2944787. PMID:20885785.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Discovery and Validation of Hypermethylated Markers for Colorectal Cancer". Disease Markers. ج. 2016: 2192853. 2016. DOI:10.1155/2016/2192853. PMC:4963574. PMID:27493446.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Whole-genome methylation analysis of benign and malignant colorectal tumours". The Journal of Pathology. ج. 229 ع. 5: 697–704. أبريل 2013. DOI:10.1002/path.4132. PMC:3619233. PMID:23096130.
- ^ "Epigenetics changes in cancer cells". MedGenMed. ج. 6 ع. 4: 17. ديسمبر 2004. PMC:1480584. PMID:15775844.
- ^ "Epimutation and cancer: a new carcinogenic mechanism of Lynch syndrome (Review)". International Journal of Oncology. ج. 41 ع. 3: 793–7. سبتمبر 2012. DOI:10.3892/ijo.2012.1528. PMC:3582986. PMID:22735547.
- ^ "DNA methylation patterns and epigenetic memory". Genes & Development. ج. 16 ع. 1: 6–21. يناير 2002. DOI:10.1101/gad.947102. PMID:11782440.
- ^ Herman، James G.؛ Graff، Jeremy R.؛ Myöhänen، Sanna؛ Nelkin، Barry D.؛ Baylin، Stephen B. (سبتمبر 1996). "Methylation-specific PCR: A novel PCR assay for methylation status of CpG islands". Proceedings of the National Academy of Sciences of the United States of America. ج. 93 ع. 18: 9821–6. Bibcode:1996PNAS...93.9821H. DOI:10.1073/pnas.93.18.9821. PMC:38513. PMID:8790415.
- ^ أ ب Epigenetics: A Reference Manual. Norfolk, England: Caister Academic Press. 2011. ISBN:978-1-904455-88-2.
- ^ "DNA methylation screening identifies driver epigenetic events of cancer cell survival". Cancer Cell. ج. 21 ع. 5: 655–67. مايو 2012. DOI:10.1016/j.ccr.2012.03.045. PMC:3395886. PMID:22624715.
- ^ "RNAi and heterochromatin repress centromeric meiotic recombination". Proceedings of the National Academy of Sciences of the United States of America. ج. 107 ع. 19: 8701–5. مايو 2010. Bibcode:2010PNAS..107.8701E. DOI:10.1073/pnas.0914160107. PMC:2889303. PMID:20421495.
- ^ "Cancer epigenomics: DNA methylomes and histone-modification maps". Nature Reviews Genetics (بالإنجليزية). 8 (4): 286–98. Apr 2007. DOI:10.1038/nrg2005. PMID:17339880.
- ^ "Cancer as a dysregulated epigenome allowing cellular growth advantage at the expense of the host". Nature Reviews. Cancer (بالإنجليزية). 13 (7): 497–510. Jul 2013. DOI:10.1038/nrc3486. PMC:4636434. PMID:23760024.
- ^ Folli، Franco، المحرر (2013). "Immunopositivity for histone macroH2A1 isoforms marks steatosis-associated hepatocellular carcinoma". PLOS ONE. ج. 8 ع. 1: e54458. Bibcode:2013PLoSO...854458R. DOI:10.1371/journal.pone.0054458. PMC:3553099. PMID:23372727.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Most mammalian mRNAs are conserved targets of microRNAs". Genome Research. ج. 19 ع. 1: 92–105. يناير 2009. DOI:10.1101/gr.082701.108. PMC:2612969. PMID:18955434.
- ^ "miRNA gene promoters are frequent targets of aberrant DNA methylation in human breast cancer". PLOS ONE. ج. 8 ع. 1: e54398. 2013. Bibcode:2013PLoSO...854398V. DOI:10.1371/journal.pone.0054398. PMC:3547033. PMID:23342147.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Metabolic recoding of epigenetics in cancer". Cancer Communications. ج. 38 ع. 1: 25. مايو 2018. DOI:10.1186/s40880-018-0302-3. PMC:5993135. PMID:29784032.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture". Mol. Cancer Res. ج. 6 ع. 4: 517–24. 2008. DOI:10.1158/1541-7786.MCR-08-0020. PMID:18403632.
- ^ أ ب Chen، المحرر (2013). "Chapter 16: DNA Damage, DNA Repair and Cancer". New Research Directions in DNA Repair. ص. 413. ISBN:978-953-51-1114-6.
- ^ أ ب "Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island". PLoS Genetics. ج. 4 ع. 8: e1000155. أغسطس 2008. DOI:10.1371/journal.pgen.1000155. PMC:2491723. PMID:18704159.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب "DNA damage, homology-directed repair, and DNA methylation". PLoS Genetics. ج. 3 ع. 7: e110. يوليو 2007. DOI:10.1371/journal.pgen.0030110. PMC:1913100. PMID:17616978.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Hereditary and familial colon cancer". Gastroenterology. ج. 138 ع. 6: 2044–58. يونيو 2010. DOI:10.1053/j.gastro.2010.01.054. PMC:3057468. PMID:20420945.
- ^ "miRNA response to DNA damage". Trends in Biochemical Sciences. ج. 36 ع. 9: 478–84. سبتمبر 2011. DOI:10.1016/j.tibs.2011.06.002. PMC:3532742. PMID:21741842.
- ^ "MicroRNAs in the DNA Damage/Repair Network and Cancer". International Journal of Genomics. ج. 2014: 820248. 2014. DOI:10.1155/2014/820248. PMC:3926391. PMID:24616890.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب "Epigenetics Offer New Horizons for Colorectal Cancer Prevention". Current Colorectal Cancer Reports. ج. 8 ع. 1: 66–81. مارس 2012. DOI:10.1007/s11888-011-0116-z. PMC:3277709. PMID:22389639.
- ^ أ ب "Modulation of mismatch repair and genomic stability by miR-155". Proceedings of the National Academy of Sciences of the United States of America. ج. 107 ع. 15: 6982–7. أبريل 2010. Bibcode:2010PNAS..107.6982V. DOI:10.1073/pnas.1002472107. JSTOR:25665289. PMC:2872463. PMID:20351277.
- ^ أ ب "Immunohistochemical analysis reveals high frequency of PMS2 defects in colorectal cancer". Gastroenterology. ج. 128 ع. 5: 1160–71. مايو 2005. DOI:10.1053/j.gastro.2005.01.056. PMID:15887099.
- ^ "miR-181d: a predictive glioblastoma biomarker that downregulates MGMT expression". Neuro-Oncology. ج. 14 ع. 6: 712–9. يونيو 2012. DOI:10.1093/neuonc/nos089. PMC:3367855. PMID:22570426.
- ^ "O6-Methylguanine DNA methyltransferase protein expression in tumor cells predicts outcome of temozolomide therapy in glioblastoma patients". Neuro-Oncology. ج. 12 ع. 1: 28–36. يناير 2010. DOI:10.1093/neuonc/nop003. PMC:2940563. PMID:20150365.
- ^ أ ب "Downregulation of HMGA-targeting microRNAs has a critical role in human pituitary tumorigenesis". Oncogene. ج. 31 ع. 34: 3857–65. أغسطس 2012. DOI:10.1038/onc.2011.557. PMID:22139073.
- ^ "Nuclear phosphoproteins HMGA and their relationship with chromatin structure and cancer". FEBS Letters. ج. 574 ع. 1–3: 1–8. سبتمبر 2004. DOI:10.1016/j.febslet.2004.08.013. PMID:15358530.
- ^ "The HMG-I oncogene causes highly penetrant, aggressive lymphoid malignancy in transgenic mice and is overexpressed in human leukemia". Cancer Research. ج. 64 ع. 10: 3371–5. مايو 2004. DOI:10.1158/0008-5472.CAN-04-0044. PMID:15150086.
- ^ "Negative regulation of BRCA1 gene expression by HMGA1 proteins accounts for the reduced BRCA1 protein levels in sporadic breast carcinoma". Molecular and Cellular Biology. ج. 23 ع. 7: 2225–38. أبريل 2003. DOI:10.1128/MCB.23.7.2225-2238.2003. PMC:150734. PMID:12640109.
- ^ "High mobility group A2 protein and its derivatives bind a specific region of the promoter of DNA repair gene ERCC1 and modulate its activity". Nucleic Acids Research. ج. 31 ع. 23: 6841–51. ديسمبر 2003. DOI:10.1093/nar/gkg884. PMC:290254. PMID:14627817.
- ^ أ ب "Deficient expression of DNA repair enzymes in early progression to sporadic colon cancer". Genome Integrity. ج. 3 ع. 1: 3. أبريل 2012. DOI:10.1186/2041-9414-3-3. PMC:3351028. PMID:22494821.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "miRNAs and cancer: an epigenetics view". Molecular Aspects of Medicine. ج. 34 ع. 4: 863–74. 2013. DOI:10.1016/j.mam.2012.06.005. PMC:5791883. PMID:22771542.
- ^ "Histone deacetylases mediate the silencing of miR-15a, miR-16, and miR-29b in chronic lymphocytic leukemia". Blood. ج. 119 ع. 5: 1162–72. فبراير 2012. DOI:10.1182/blood-2011-05-351510. PMC:3277352. PMID:22096249.
- ^ Human DNA Repair Genes, 15 April 2014, MD Anderson Cancer Center, University of Texas نسخة محفوظة 2017-08-15 على موقع واي باك مشين.
- ^ "MicroRNA-182-5p targets a network of genes involved in DNA repair". RNA. ج. 19 ع. 2: 230–42. فبراير 2013. DOI:10.1261/rna.034926.112. PMC:3543090. PMID:23249749.
- ^ "Epigenetic screen of human DNA repair genes identifies aberrant promoter methylation of NEIL1 in head and neck squamous cell carcinoma". Oncogene. ج. 31 ع. 49: 5108–16. ديسمبر 2012. DOI:10.1038/onc.2011.660. PMID:22286769.
- ^ "Modulation of DNA end joining by nuclear proteins". The Journal of Biological Chemistry. ج. 280 ع. 36: 31442–9. سبتمبر 2005. DOI:10.1074/jbc.M503776200. PMID:16012167.
- ^ "Overexpression and hypomethylation of flap endonuclease 1 gene in breast and other cancers". Molecular Cancer Research. ج. 6 ع. 11: 1710–7. نوفمبر 2008. DOI:10.1158/1541-7786.MCR-08-0269 (غير نشط 9 ديسمبر 2019). PMC:2948671. PMID:19010819.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2019 (link) - ^ "Flap endonuclease 1 is overexpressed in prostate cancer and is associated with a high Gleason score". BJU International. ج. 98 ع. 2: 445–51. أغسطس 2006. DOI:10.1111/j.1464-410X.2006.06224.x. PMID:16879693.
- ^ "Identification of gastric cancer-related genes using a cDNA microarray containing novel expressed sequence tags expressed in gastric cancer cells". Clinical Cancer Research. ج. 11 ع. 2 Pt 1: 473–82. يناير 2005. PMID:15701830.
- ^ "Flap endonuclease 1 is a promising candidate biomarker in gastric cancer and is involved in cell proliferation and apoptosis". International Journal of Molecular Medicine. ج. 33 ع. 5: 1268–74. مايو 2014. DOI:10.3892/ijmm.2014.1682. PMID:24590400.
- ^ "Genome-wide analysis of gene expression in neuroblastomas detected by mass screening". Cancer Letters. ج. 225 ع. 1: 111–20. يوليو 2005. DOI:10.1016/j.canlet.2004.10.035. PMID:15922863.
- ^ "Exploration of global gene expression patterns in pancreatic adenocarcinoma using cDNA microarrays". The American Journal of Pathology. ج. 162 ع. 4: 1151–62. أبريل 2003. DOI:10.1016/S0002-9440(10)63911-9. PMC:1851213. PMID:12651607.
- ^ "Increased expression and no mutation of the Flap endonuclease (FEN1) gene in human lung cancer". Oncogene. ج. 22 ع. 46: 7243–6. أكتوبر 2003. DOI:10.1038/sj.onc.1206977. PMID:14562054.
- ^ "Hypomethylation of ETS transcription factor binding sites and upregulation of PARP1 expression in endometrial cancer". BioMed Research International. ج. 2013: 946268. 2013. DOI:10.1155/2013/946268. PMC:3666359. PMID:23762867.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Poly (ADP-ribose) polymerase 1 transcriptional regulation: a novel crosstalk between histone modification H3K9ac and ETS1 motif hypomethylation in BRCA1-mutated ovarian cancer". Oncotarget. ج. 5 ع. 1: 291–7. يناير 2014. DOI:10.18632/oncotarget.1549. PMC:3960209. PMID:24448423.
- ^ "Promoter hypomethylation, especially around the E26 transformation-specific motif, and increased expression of poly (ADP-ribose) polymerase 1 in BRCA-mutated serous ovarian cancer". BMC Cancer. ج. 13: 90. فبراير 2013. DOI:10.1186/1471-2407-13-90. PMC:3599366. PMID:23442605.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2". Proceedings of the National Academy of Sciences of the United States of America. ج. 94 ع. 7: 3122–7. أبريل 1997. Bibcode:1997PNAS...94.3122N. DOI:10.1073/pnas.94.7.3122. JSTOR:41786. PMC:20332. PMID:9096356.
- ^ "Differing patterns of genetic instability in mice deficient in the mismatch repair genes Pms2, Mlh1, Msh2, Msh3 and Msh6". Carcinogenesis. ج. 27 ع. 12: 2402–8. ديسمبر 2006. DOI:10.1093/carcin/bgl079. PMC:2612936. PMID:16728433.
- ^ "Disruption of Brca2 increases the spontaneous mutation rate in vivo: synergism with ionizing radiation". EMBO Reports. ج. 3 ع. 3: 255–60. مارس 2002. DOI:10.1093/embo-reports/kvf037. PMC:1084010. PMID:11850397.
- ^ "O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions". Gut. ج. 54 ع. 6: 797–802. يونيو 2005. DOI:10.1136/gut.2004.059535. PMC:1774551. PMID:15888787.
- ^ "MGMT promoter methylation and field defect in sporadic colorectal cancer". Journal of the National Cancer Institute. ج. 97 ع. 18: 1330–8. سبتمبر 2005. DOI:10.1093/jnci/dji275. PMID:16174854.
- ^ "Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence". Langenbeck's Archives of Surgery. ج. 396 ع. 7: 1017–26. أكتوبر 2011. DOI:10.1007/s00423-011-0812-9. PMID:21706233.
- ^ "Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers". Gut. ج. 59 ع. 11: 1516–26. نوفمبر 2010. DOI:10.1136/gut.2009.194787. PMID:20947886.
- ^ "Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa". Oral Oncology. ج. 47 ع. 2: 104–7. فبراير 2011. DOI:10.1016/j.oraloncology.2010.11.006. PMID:21147548.
- ^ "Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma". Otolaryngology–Head and Neck Surgery. ج. 141 ع. 4: 484–90. أكتوبر 2009. DOI:10.1016/j.otohns.2009.07.007. PMID:19786217.
- ^ "Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene". American Journal of Otolaryngology. ج. 32 ع. 6: 528–36. 2011. DOI:10.1016/j.amjoto.2010.11.005. PMID:21353335.
- ^ "Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions". Human Pathology. ج. 40 ع. 11: 1534–42. نوفمبر 2009. DOI:10.1016/j.humpath.2009.01.029. PMID:19695681.
- ^ "Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley". Asian Pacific Journal of Cancer Prevention. ج. 13 ع. 8: 4177–81. 2012. DOI:10.7314/APJCP.2012.13.8.4177. PMID:23098428.
- ^ "Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma". International Journal of Clinical and Experimental Pathology. ج. 5 ع. 5: 382–96. 2012. PMC:3396065. PMID:22808291.
- ^ "Genomic sequencing in cancer". Cancer Letters. ج. 340 ع. 2: 161–70. نوفمبر 2013. DOI:10.1016/j.canlet.2012.11.004. PMC:3622788. PMID:23178448.
- ^ "Analysis of genetic inheritance in a family quartet by whole-genome sequencing". Science. ج. 328 ع. 5978: 636–9. أبريل 2010. Bibcode:2010Sci...328..636R. DOI:10.1126/science.1186802. PMC:3037280. PMID:20220176.
- ^ "Estimating the human mutation rate using autozygosity in a founder population". Nature Genetics. ج. 44 ع. 11: 1277–81. نوفمبر 2012. DOI:10.1038/ng.2418. PMC:3483378. PMID:23001126.
- ^ "Rates and fitness consequences of new mutations in humans". Genetics. ج. 190 ع. 2: 295–304. فبراير 2012. DOI:10.1534/genetics.111.134668. PMC:3276617. PMID:22345605.
- ^ "Aging as accelerated accumulation of somatic variants: whole-genome sequencing of centenarian and middle-aged monozygotic twin pairs" (PDF). Twin Research and Human Genetics. ج. 16 ع. 6: 1026–32. ديسمبر 2013. DOI:10.1017/thg.2013.73. PMID:24182360. مؤرشف من الأصل (PDF) في 2019-09-06.
- ^ "ATM-dependent chromatin changes silence transcription in cis to DNA double-strand breaks". Cell. ج. 141 ع. 6: 970–81. يونيو 2010. DOI:10.1016/j.cell.2010.04.038. PMC:2920610. PMID:20550933.
- ^ "Targeted DNA methylation by homology-directed repair in mammalian cells. Transcription reshapes methylation on the repaired gene". Nucleic Acids Research. ج. 42 ع. 2: 804–21. يناير 2014. DOI:10.1093/nar/gkt920. PMC:3902918. PMID:24137009.
- ^ "A DNA methylation fingerprint of 1628 human samples". Genome Research. ج. 22 ع. 2: 407–19. فبراير 2012. DOI:10.1101/gr.119867.110. PMC:3266047. PMID:21613409.
- ^ "Genetic toxicities of human teratogens". Mutation Research. ج. 396 ع. 1–2: 9–43. ديسمبر 1997. DOI:10.1016/S0027-5107(97)00173-5. PMID:9434858.
- ^ "Association of valproate-induced teratogenesis with histone deacetylase inhibition in vivo". FASEB Journal. ج. 19 ع. 9: 1166–8. يوليو 2005. DOI:10.1096/fj.04-3425fje. PMID:15901671.
- ^ "Does thalidomide cause second generation birth defects?". Drug Safety. ج. 19 ع. 5: 339–41. نوفمبر 1998. DOI:10.2165/00002018-199819050-00001. PMID:9825947.
- ^ "Paternal exposures: impact on reproductive and developmental outcome. An overview". Pharmacology Biochemistry and Behavior. ج. 55 ع. 4: 691–700. ديسمبر 1996. DOI:10.1016/S0091-3057(96)00286-9. PMID:8981601.
- ^ WebCite query result نسخة محفوظة 16 مايو 2020 على موقع واي باك مشين.
- ^ "Influence of morphine exposure during adolescence on the sexual maturation of male rats and the development of their offspring". The Journal of Pharmacology and Experimental Therapeutics. ج. 256 ع. 3: 1086–93. مارس 1991. PMID:2005573.
- ^ "Adverse effects of the model environmental estrogen diethylstilbestrol are transmitted to subsequent generations". Endocrinology. ج. 147 ع. 6 Suppl: S11-7. يونيو 2006. DOI:10.1210/en.2005-1164. PMID:16690809.
- ^ Orouji E, Utikal J (2018). "Tackling malignant melanoma epigenetically: histone lysine methylation". Clinical Epigenetics. ج. 10 ع. 1: 145. DOI:10.1186/s13148-018-0583-z. PMC:6249913. PMID:30466474.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب "Epigenetic changes in prostate cancer: implication for diagnosis and treatment". Journal of the National Cancer Institute. ج. 97 ع. 2: 103–15. يناير 2005. DOI:10.1093/jnci/dji010. PMID:15657340.
- ^ "Changes in prostate gene expression in men undergoing an intensive nutrition and lifestyle intervention". Proceedings of the National Academy of Sciences of the United States of America. ج. 105 ع. 24: 8369–74. يونيو 2008. Bibcode:2008PNAS..105.8369O. DOI:10.1073/pnas.0803080105. PMC:2430265. PMID:18559852.
- ^ "Mixed lineage leukemia: versatile player in epigenetics and human disease". The FEBS Journal. ج. 277 ع. 8: 1789. أبريل 2010. DOI:10.1111/j.1742-4658.2010.07605.x. PMID:20236314.
- ^ "Soft Tissue Sarcoma". يناير 1980. مؤرشف من الأصل في 2017-05-28.
- ^ "Epigenetic and epigenomic mechanisms shape sarcoma and other mesenchymal tumor pathogenesis". Epigenomics. ج. 3 ع. 6: 715–32. ديسمبر 2011. DOI:10.2217/epi.11.93. PMID:22126291.
- ^ "EZH2 is a mediator of EWS/FLI1 driven tumor growth and metastasis blocking endothelial and neuro-ectodermal differentiation". Proceedings of the National Academy of Sciences of the United States of America. ج. 106 ع. 13: 5324–9. مارس 2009. Bibcode:2009PNAS..106.5324R. DOI:10.1073/pnas.0810759106. PMC:2656557. PMID:19289832.
- ^ "Lysine-specific demethylase 1 (LSD1/KDM1A/AOF2/BHC110) is expressed and is an epigenetic drug target in chondrosarcoma, Ewing's sarcoma, osteosarcoma, and rhabdomyosarcoma". Human Pathology. ج. 43 ع. 8: 1300–7. أغسطس 2012. DOI:10.1016/j.humpath.2011.10.010. PMID:22245111.
- ^ "Potential role of HDAC inhibitors in cancer therapy: insights into oral squamous cell carcinoma". Oral Oncology. ج. 46 ع. 5: 323–9. مايو 2010. DOI:10.1016/j.oraloncology.2010.01.009. PMID:20207580.
- ^ "Prostate cancer chemopreventive activity of phenethyl isothiocyanate through epigenetic regulation (review)". International Journal of Oncology. ج. 37 ع. 3: 533–9. سبتمبر 2010. DOI:10.3892/ijo_00000702. PMID:20664922.
- ^ "Targeting Cancer with Epi-Drugs: A Precision Medicine Perspective". Current Pharmaceutical Biotechnology. ج. 17 ع. 10: 856–65. 27 مايو 2016. DOI:10.2174/1381612822666160527154757. PMID:27229488.
- ^ "Cancer treatment of the future: inhibitors of histone methyltransferases". The International Journal of Biochemistry & Cell Biology. ج. 41 ع. 1: 4–11. يناير 2009. DOI:10.1016/j.biocel.2008.07.024. PMID:18773966.
- ^ "A pilot pharmacokinetic study of oral azacitidine". Leukemia. ج. 22 ع. 9: 1680–4. سبتمبر 2008. DOI:10.1038/leu.2008.145. PMID:18548103.
- ^ "Demethylating agents in myeloid malignancies". Current Opinion in Oncology. ج. 20 ع. 6: 705–10. نوفمبر 2008. DOI:10.1097/CCO.0b013e328313699c. PMC:3873866. PMID:18841054.
- ^ "Activity of decitabine, a hypomethylating agent, in chronic myelomonocytic leukemia". Cancer. ج. 109 ع. 4: 713–7. فبراير 2007. DOI:10.1002/cncr.22457. PMID:17219444.
- ^ "Feasibility of allo-SCT after hypomethylating therapy with decitabine for myelodysplastic syndrome". Bone Marrow Transplantation. ج. 43 ع. 11: 839–43. يونيو 2009. DOI:10.1038/bmt.2008.400. PMID:19151791.
- ^ "Hypomethylating drugs convert HA-1-negative solid tumors into targets for stem cell-based immunotherapy". Blood. ج. 113 ع. 12: 2715–22. مارس 2009. DOI:10.1182/blood-2008-05-158956. PMID:19096014.
- ^ http://www.accessdata.fda.gov/drugsatfda_docs/nda/2015/205353Orig1s000MedR.pdf نسخة محفوظة 2017-02-11 على موقع واي باك مشين.
- ^ "Toward the development of potent and selective bisubstrate inhibitors of protein arginine methyltransferases". Bioorganic & Medicinal Chemistry Letters. ج. 20 ع. 7: 2103–5. أبريل 2010. DOI:10.1016/j.bmcl.2010.02.069. PMID:20219369.
- ^ "Chemopreventive Property of a Soybean Peptide (Lunasin) That Binds to Deacetylated Histones and Inhibits Acetylation". Cancer Research. ج. 61. 15 أكتوبر 2001. مؤرشف من الأصل في 2018-11-20.
