بنزو(a)بيرين: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
بوت:الإبلاغ عن رابط معطوب أو مؤرشف V3.3 |
ط بوت:الإبلاغ عن رابط معطوب أو مؤرشف V4.9* |
||
| سطر 73: | سطر 73: | ||
== السلامة == |
== السلامة == |
||
يعد مركب بنزو[a]بيرين من [[مسرطن|المسرطنات]]، وهو مصنف ضمن المجموعة الأولى حسب [[الوكالة الدولية لبحوث السرطان]]؛ وأجريت العديد من الدراسات التي ربطت بين المركب ومرض [[السرطان]] بشكل عام؛<ref>{{مرجع كتاب|url = https://books.google.com/?id=Fw_G7Sk382IC&pg=PA102&lpg=PA102&dq=Benzo(a)pyrene-7,8-dihydrodiol-9,10-epoxide+cas#v=onepage&q=Benzo(a)pyrene-7%2C8-dihydrodiol-9%2C10-epoxide%20cas&f=false|first = W.|last = Kleiböhmer|publisher = Elsevier|year = 2001|chapter = Polycyclic Aromatic Hydrocarbon (PAH) Metabolites|pages = 99–122|title = Environmental Analysis (Volume 3 of Handbook of Analytical Separations)|isbn = 978-0-08-050576-3}}</ref> و[[سرطان الرئة]] بشكل خاص.<ref>Denissenko MF, Pao A, Tang M, Pfeifer GP. Preferential formation of benzo[''a'']pyrene adducts at lung cancer mutational hotspots in P53. Science. 1996 October 18;274(5286):430-2.</ref> |
يعد مركب بنزو[a]بيرين من [[مسرطن|المسرطنات]]، وهو مصنف ضمن المجموعة الأولى حسب [[الوكالة الدولية لبحوث السرطان]]؛ وأجريت العديد من الدراسات التي ربطت بين المركب ومرض [[السرطان]] بشكل عام؛<ref>{{مرجع كتاب|url = https://books.google.com/?id=Fw_G7Sk382IC&pg=PA102&lpg=PA102&dq=Benzo(a)pyrene-7,8-dihydrodiol-9,10-epoxide+cas#v=onepage&q=Benzo(a)pyrene-7%2C8-dihydrodiol-9%2C10-epoxide%20cas&f=false|first = W.|last = Kleiböhmer|publisher = Elsevier|year = 2001|chapter = Polycyclic Aromatic Hydrocarbon (PAH) Metabolites|pages = 99–122|title = Environmental Analysis (Volume 3 of Handbook of Analytical Separations)|isbn = 978-0-08-050576-3| مسار الأرشيف = https://web.archive.org/web/20200313201905/https://books.google.com/books?id=Fw_G7Sk382IC&pg=PA102&lpg=PA102&dq=Benzo(a)pyrene-7,8-dihydrodiol-9,10-epoxide+cas&hl=en | تاريخ الأرشيف = 13 مارس 2020 }}</ref> و[[سرطان الرئة]] بشكل خاص.<ref>Denissenko MF, Pao A, Tang M, Pfeifer GP. Preferential formation of benzo[''a'']pyrene adducts at lung cancer mutational hotspots in P53. Science. 1996 October 18;274(5286):430-2.</ref> |
||
تعود خطورة هذا المركب بسبب ناتج [[استقلاب]] المركب الحاوي على مجموعتي هيدروكسيل ([[ديول]]) وعلى مجموعة [[إيبوكسيد]]، والتي تستطيع أن تتداخل مع الـ DNA بسبب تآثر [[إقحام (كيمياء حيوية)|الإقحام]] مع القواعد النتروجينية، وخاصة [[غوانين]]. |
تعود خطورة هذا المركب بسبب ناتج [[استقلاب]] المركب الحاوي على مجموعتي هيدروكسيل ([[ديول]]) وعلى مجموعة [[إيبوكسيد]]، والتي تستطيع أن تتداخل مع الـ DNA بسبب تآثر [[إقحام (كيمياء حيوية)|الإقحام]] مع القواعد النتروجينية، وخاصة [[غوانين]]. |
||
نسخة 22:22، 6 أبريل 2020
| بنزو[a]بيرين | |
|---|---|
| الاسم النظامي (IUPAC) | |
Benzo[a]pyrene |
|
| المعرفات | |
| الاختصارات | BaP |
| رقم CAS | 50-32-8 |
| بوب كيم (PubChem) | 2336 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C20H12 |
| الكتلة المولية | 252.32 غ/مول |
| المظهر | بلورات صفراء |
| الكثافة | 1.35 غ/سم3 |
| نقطة الانصهار | 177 °س |
| نقطة الغليان | 495 °س |
| الذوبانية في الماء | غير منحل في الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
بنزو[a]بيرين هو هيدروكربون عطري متعدد الحلقات له الصيغة الكيميائية C20H12، ويكون على شكل بلورات صفراء اللون ذات رائحة عطرية.
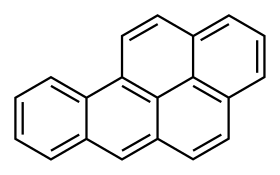
يتألف المركب بنيوياً من خمس حلقات بنزين مندمجة، وهو أحد مركبين متصاوغين من مركبات بنزوبيرين، والمتشكلة من دمج حلقة بنزين إضافية إلى بنية البيرين.
الوفرة الطبيعية والتحضير
يوجد بنزو[a]بيرين بشكل طبيعي في قطران الفحم؛ وهو ينشأ من الاحتراق غير الكامل للمواد العضوية مثل بقايا الخشب؛[3] يمكن للمركب أيضاً أن يصادف في غاز عادم السيارات وغاز المداخن وفي دخان السجائر؛ كما عثر على آثار منه في حبوب البن المحمّصة وفي اللحوم المشوية.
هناك ارتباط بين نسبة الكربون في الكون وبين الهيدروكربونات العطرية متعددة الحلقات، حيث أن أكثر من 20% من الكربون في الكون مترافق ومرتبط في مركبات PAHs، ومنها بنزو[a]بيرين.[4]
يمكن التحضير مخبرياً بواسطة تفاعل أسيلة فريدل-كرافتس لمركب البيرين مع أنهيدريد السكسينيك، حيث يعالج حمض بيرينويل البروبيونيك الناتج بفلز الزنك لاختزاله ثم بإجراء عملية تبلور بوجود رباعي كلوريد القصدير، للحصول على مركب وسطي من كيتو رباعي هيدروبنزوبيرين والذي يختزل مرة أخرى باستخدام الزنك ثم بجرى تفاعل بلمهة بوجود الكبريت أو السيلينيوم.[5]
يمكن إجراء عملية التحضير بطريقة أحدث تتكون من ثلاث مراحل وتبدأ من مركب 2-نفثيل حمض البوريك، والذي يجرى عليه أولاً تفاعل سوزوكي مع 2-بروموبنزين-3،1-ثنائي كربالدهيد. في الخطوة الثانية يتم معالجة مجموعة الألدهيد بواسطة تفاعل فيتيغ باستخدام ميثوكسي ميثيلين ثلاثي فينيل الفوسفين. وفي الخطوة الأخيرة يتم تفاعل تحلق باستخدام حمض سلفونيك الميثان.[6]
الخواص
يوجد المركب على شكل بلورات إبرية صفراء في الحالة العادية من الضغط ودرجة الحرارة؛ وهو ضعيف الانحلال في الماء، لكنه ينحل في المذيبات العضوية اللاقطبية. يبدي مركب بنزو[a]بيرين خواصاً فلورية.
السلامة
يعد مركب بنزو[a]بيرين من المسرطنات، وهو مصنف ضمن المجموعة الأولى حسب الوكالة الدولية لبحوث السرطان؛ وأجريت العديد من الدراسات التي ربطت بين المركب ومرض السرطان بشكل عام؛[7] وسرطان الرئة بشكل خاص.[8]
تعود خطورة هذا المركب بسبب ناتج استقلاب المركب الحاوي على مجموعتي هيدروكسيل (ديول) وعلى مجموعة إيبوكسيد، والتي تستطيع أن تتداخل مع الـ DNA بسبب تآثر الإقحام مع القواعد النتروجينية، وخاصة غوانين.

المراجع
- ^ أ ب ت benzo[a]pyrene (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Assessment of Benzo-alpha-pyrene Emissions in the Great Lakes Region, pp 23-24
http://www.epa.gov/ttnchie1/conference/ei20/session10/asoehl_pres.pdf - ^ Hoover، Rachel (21 فبراير 2014). "Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That". ناسا. مؤرشف من الأصل في 2017-03-21. اطلع عليه بتاريخ 2014-02-22.
- ^ A. Winterstein, H. Vetter, K. Schön: : Zur Synthese des krebs-erregenden 3.4-Benzpyrens. In: Chem. Ber. 68, 1935, S. 1079–1085, doi:10.1002/cber.19350680617.
- ^ R. G. Harvey, K. Lim, Q. Dai: A Convenient New Synthesis of Benzo[a]pyrene. In: J. Org. Chem. 69, 2004, S. 1372–1373.
- ^ Kleiböhmer، W. (2001). "Polycyclic Aromatic Hydrocarbon (PAH) Metabolites". Environmental Analysis (Volume 3 of Handbook of Analytical Separations). Elsevier. ص. 99–122. ISBN:978-0-08-050576-3. مؤرشف من الأصل في 2020-03-13.
- ^ Denissenko MF, Pao A, Tang M, Pfeifer GP. Preferential formation of benzo[a]pyrene adducts at lung cancer mutational hotspots in P53. Science. 1996 October 18;274(5286):430-2.
| في كومنز صور وملفات عن: بنزو(a)بيرين |


![طريقة اصطناع عملية لمركب بنزو[a]بيرين.](http://upload.wikimedia.org/wikipedia/commons/thumb/3/39/Benzo%28a%29pyrene_synthesis_01.svg/553px-Benzo%28a%29pyrene_synthesis_01.svg.png)