درجة حرية (فيزياء)
درجة الحرية (بالإنجليزية: Degree of freedom) في الفيزياء والكيمياء هي صفة فيزيائية تستخدم في وصف حالة نظام فيزيائي.[1][2] ومجموعة الصفات التي تصف بأجملها نظام فيزياي تسمى فضاء طوري. من الخواص الفيزيائية للغازات التي تعتمد على درجات حرية جزيئاته نجد: حرارته النوعية ومعامل الانضغاط. ومعرفة درجات الحرية لغاز مهمة حيث منها يمكننا معرفة الطاقة الكامنة في جزيئات الغاز - وهي طاقة لا نستطيع عادة الاستفادة منها - وطاقاته الأخرى التي يمكن الاستفادة منها؛ فمثلا تهمنا درجات حرية جزيئات بخار الماء إذ لبخار الماء في حياتنا المعاصرة دورا كبيرا في توليد الطاقة الكهربائية.

جزيئات غاز مكونة من ذرتين مثل الأكسجين، عندما نقوم بدراسة حركتها العشواية في الغاز نجد أن جزيء الأكسجين يمكن أن يتحرك في اتجاه المحور السيني كما يمكنه الحركة في الاتجاه الصادي ويمكنه أن يتحرك في الاتجاه العيني (باعتبار إحداثيات الموضع: س، ص، ع). ونحن نصف حركة جزيئات الأكسجين في الغاز عندئذ بأن لها «3 درجات حرية»، ذلك بشأن «الحركة الانتقالية» للجزيئات. فإذا كان جزيء الأكسجين يدور حول نفسه فتلك تكون أيضا درجة من درجات الحرية لجزيء الأكسجين وهو يمارس الدوران عن طريق امتصاص طاقة من الخارج. وبتمعن دراسة حركة جزيء الأكسجين الدورانية، نجد أن له 2 درجة حرية دورانية حول محورين عموديين على الرابطة بين ذرتي الأكسجين المكونتان الجزيئ. بذلك نستطيع القول بأن جزيئ الأكسجين في الغاز له 5 درجات حرية، منها 3 انتقالية و 2 دورانية .(دوران جزيئ الأكسجين وهو ثنائي الذرات لا يمكنه الدوران حول محوره الثالث وهو الرابط بين الذرتين [أنظر الشكل أسفله].
تعريف[عدل]
في الميكانيكا يمكن لجسم الحركة في ثلاثة محاور للمكان x , y , z . بذلك يحتوي زخم الحركة على ثلاثة مركبات للحركة (أجزاء) وهي تسمى «درجات حرية». فإذا تكوّن نظام (مثل غاز) من عدد N من الجزيئات المستقلة يكون للنظام 3N من درجات الحرية.
وفي الميكانيكا الإحصائية تشكل درجة حرية قيمة غير متجهه تصف الحالة الصغرية microstate للنظام فهي مثلا تحدد الحرارة النوعية لغاز. وتختلف درجات حرية الغازات باختلاف تركيبها ومكوناتها، فمثلا الغازات المثالية هي التي تكون منفردة الذرات، مثل غاز الهيليوم والنيون وغاز الأرجون (عنصر) فيكون لكل ذرة منها 3 درجات لحرية الحركة، وهي حرية حركة انتقالية في الاتجاهات x , y , z . تمثل إحداثيات جميع الحالات الصغرية للنظام بنقطة في الفضاء الطوري phase space. وما رأينا أعلاه في حالة جزيء الأكسجين أو النيتروجين أو الهيدروجين حيث يتكون الجزيء منها من ذرتين مرتبطتين بعضهما البعض. ورأينا أن الجزيء الثنائي الذرات له 5 درجات حرية: منها 3 درجات لحرية الحركة الانتقالية، ودرجتي حرية للحركة الدورانية للجزيء حول محور عمودي على الرابطة بين الذرتين.
ويمكن اعتبار أي خاصية مستقلة لا تعتمد على متغير آخر في النظام بأنها «درجة حرية».
مثال: غاز ثنائي الذرات[عدل]
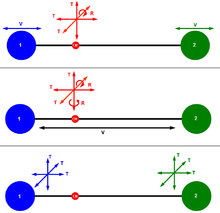
يتكون الفراغ أو الفضاء من ثلاثة محاور، ونفترض تحرك جسيمات كرية فيه. فهي تستطيع التحرك موازية للمحور الأفقي أو المحور الرأسي أو المحور العمودي على الصفحة، ويكون لها 3 درجات حرية. أما غاز تتكون جزيئاته من ذرتين فيكون لها 6 درجات حرية، ونحسبها كالآتي: 3 درجات حرية انتقالية + 2 درجة حرية دورانية + 1 درجة حرية اهتزازية. (الحركة الاهتزازية تكون عبر الرابطة بين الذرتين حيث تتمدد الرابطة وتنكمش).
يمكن لمركز ثقل الجزيء الثنائي الذرات (مثل الهيدروجين) الحركة الانتقالية موازيا للمحور الأفقي أو المحور الرأسي أو المحور العمودي على الصفحة، فيكون له 3 درجات حرية انتقالية. بالإضافة لذلك توجد للجزيئ طريقة واحدة للاهتزاز (عبر الرابطة) و 2 درجة حرية دورانية حيث يتم دوران الجزيء حول محورين عمودين على الرابطة بين ذرتيه. ولا يحتسب الدوران حول الرابطة H-H فهي تهمل. ينتج عن ذلك أن الجزيء الثنائي الذرات له:
- 3N = 6 = 3+1+2
من درجات الحرية.
وبالنسبة لجزيئ مكون من N > 2 من الذرات فيمكننا أخذ الثلاثة إمكانيات للدوران في الاعتبار (3 درجات حرية دورانية)، وينتج:
- (N. 3 = 3 + 3 + (3 N - 6
وهذا يعني أن جزيءا مكونا من عدد N من الذرات له 3N - 6 حركات اهتزازية عندما تكون N أكبر من 2.
وعلى عكس نظرية الكلاسيكية التي تأخذ اهتزاز الجزيء في الاعتبار أيضا عند درجة حرارة الغرفة، فقد اتضح أن الحركة الاهتزازية للجزيئات يمكن اهمالها لصغر مشاركتها في السعة الحرارية للمادة. ويرجع ذلك إلى أن درجات الحرية المتعلقة بالاهتزاز تكون «خامدة» لأن درجة حرارة الغرفة لا تكفي لإعطاء الحركة الاهتزازية (الطاقة kT) الازمة للاهتزاز.
يعطي الجدول أسفله درجات الحرية مع عدم احتساب درجات الحرية المتعلقة بالأهتزاز نظرا لصغر ما تضيفة إلى الطاقة الكلية للنظام وبالتالي إلى ما تضيفه إلى الحرارة النوعية للمادة. ولكن لا يمكن إهمالها عند درجات الحرارة العالية جدا.
| ذرة منفردة | جزيئات مستقيمة | جزيئات غير مستقيمة | |
|---|---|---|---|
| الإزاحة (x, y and z) | 3 | 3 | 3 |
| الدوران (x, y and z) | 0 | 2 | 3 |
| الاهتزاز | 0 | 3N - 5 | 3N - 6 |
| المجموع | 3 | 3N | 3N |
المراجع[عدل]
- ^ "معلومات عن درجة حرية (فيزياء) على موقع britannica.com". britannica.com. مؤرشف من الأصل في 2019-05-09.
- ^ "معلومات عن درجة حرية (فيزياء) على موقع mathworld.wolfram.com". mathworld.wolfram.com. مؤرشف من الأصل في 2018-09-07.
