فوسفات الحديد والليثيوم
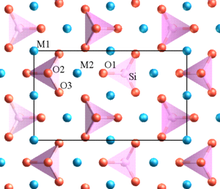
فوسفات الحديد والليثيوم (يرمز له اختصاراً LFP ) هو مركب غير عضوي له الصيغة الكيميائية LiFePO4 . وهو مادة صلبة رمادية أو حمراء-رمادية أو بنية أو سوداء وغير قابلة للذوبان في الماء. جذبت تلك المادة الانتباه كأحد مكونات بطاريات فوسفات الحديد والليثيوم ، [1] وهي نوع من بطاريات Li-ion . تستهدف كيمياء البطاريات هذه إلى استخدامها في بطاريات الطاقة ، ولتشغيل السيارات الكهربائية ، وفي منشآت الطاقة الشمسية [2] (مثل تخزين الكهرباء) . ومؤخراً تخزين الكهرباء في نطاق الشبكة الكهربائية على نطاق واسع.[3]
تستخدم معظم بطاريات الليثيوم (Li-ion) المستخدمة في منتجات الإلكترونيات الاستهلاكية مهابط (كاثودات) مصنوعة من مركبات الليثيوم الأخرى ، مثل أكسيد الليثيوم والكوبالت ( LiCoO2 ) ، وأكسيد الليثيوم والمنغنيز ( LiMn2O4 ) وأكسيد النيكل والليثيوم ( LiNiO2 ). تصنع الأنودات عمومًا من الجرافيت .
يوجد فوسفات الحديد والليثيوم بشكل طبيعي في معدن التريفيليت، ولكن هذه المادة ليس لها نقاء كافٍ لاستخدامها في البطاريات.
الصيغة الكيميائية العامة LiMPO4[عدل]
طبقا للصيغة الكيميائية العامة للمركب LiMPO4 ،فإن مركبات LiFePO4 تشكل عائلة من المواد ذات هيكل بلوري واحد مثل الزبرجد الزيتوني . لا تشمل M (بمعني معدن Metall) فقط الحديد Fe ولكن أيضًا يمكن استعاضتها بذرة الكوبلت Co أو المنغنيز Mn ، أو التيلوريوم Ti.[4] كأول مركب بالصيغة الكيميائية LiMPO4 التجاري.
كان C/LiFePO4 ، المجموعة الكاملة من LiMPO4 يسمى بشكل غير رسمي "فوسفات الحديد والليثيوم" أو " LiFePO4 ". ومع ذلك ، يمكن استخدام أكثر من طور من النوع الأوليفين كمادة لمهبط (كاثود) البطارية. مركبات الزبرجد الزيتوني مثل AyMPO4 ، و Li1−xMFePO4 ، و LiFePO4−zM لها نفس الهياكل البلورية مثل LiMPO4 ، ويمكن أن يحل محله في الكاثود. يمكن الإشارة إلى الجميع باسم مواد "LFP"، اختصارا لـ LiFeP.
يشكل المنغنيز والفوسفات والحديد والليثيوم أيضًا بنية زيتونية تسمى أوليفين . هذا الهيكل هو مساهم مفيد في الكاثود لبطاريات الليثيوم القابلة لإعادة الشحن (أي المراكم ) ؛ فهي بطارية فوسفات الحديد والليثيوم التي تستعمل في الهاتف المحمول وكذلك في بطاريات السيارات الكهربائية الحديثة.[5] ويرجع ذلك إلى هيكل الزبرجد الزيتوني الناتج عن دمج الليثيوم مع المنغنيز والحديد والفوسفات (كما هو موضح أعلاه في الشكل البلوري). تعتبر الهياكل الأوليفين (الزيتونية) لبطاريات الليثيوم القابلة لإعادة الشحن مهمة ، لأنها ميسورة التكلفة ومستقرة ويمكن استخدامها بأمان لتخزين الطاقة.[6]
التاريخ والإنتاج[عدل]
حدد العالمان الكيميائيان Arumugam Manthiram و John B. Goodenough أولاً فئة البوليانيون لمواد الكاثود لبطاريات الليثيوم أيون .[7][8][9] LiFePO4</br> وتم تحديد LiFePO4 كمواد الكاثود التي تنتمي إلى فئة "متعدد الأنيون" polyanion لاستخدامها في البطاريات في عام 1996 بواسطة الباحث "بادهي "وزملائه.[10][11] وقاموا باستخراج الليثيوم من </br> LiFePO4 وإدخاله في المركب FePO4</br> مرة أخرى فكان ذلك مؤكدا لنجاح عملية التركيب FePO4 . أكد ت تجارب حيود النيوترونات على البلورات أن التركيبة العامة " LFP " كانت قادرة على ضمان أمان تيار الإدخال / والإخراج الكبير لبطاريات الليثيوم.[12]
يمكن إنتاج المادة عن طريق تسخين مجموعة متنوعة من أملاح الحديد والليثيوم بالفوسفات أو حمض الفوسفوريك . تم وصف العديد من الطرق ذات الصلة بما في ذلك تلك التي تستخدم التخليق الحراري المائي .[13]
الخصائص الفيزيائية والكيميائية[عدل]
في المركب LiFePO4 ، الليثيوم له شحنة +1 ، وشحنة الحديد + 2 وهما يوازنان الشحنة السالبة −3 للفوسفات. وعند إزالة الليثيوم Li ، تتحول المادة إلى المركب الحديدي FePO4 .[14]
تشكل ذرة الحديد و 6 ذرات أكسجين كرة تنسيق ثماني السطوح في البلورة ، وتوصف FeO6 بأن فيها أيون حديد Fe في المركز البلوري. وأما مجموعات الفوسفات PO4 ، فهي في شكل رباعي السطوح (مستطيل ثلاثي الأبعاد ؛ صندوقي الشكل ). يتكون الإطار ثلاثي الأبعاد من FeO6 ثماني وجوه تقاسم الزوايا المشغولة بذرات الأكسجين O. تتواجد أيونات الليثيوم داخل قنوات الثمتنية الأبعاد octahedral بطريقة متعرجة (زجزاجية) . في علم البلورات ، يُعتقد أن هذا الهيكل ينتمي إلى المجموعة الفضائية P mnb للنظام البلوري لتقويم النظام البلوري . ثوابت الشبكة هي: الضلع الطولي للخلية البلورية أ = 6.008 Å ، والضلع العرضي ب = 10.334 Å و الارتفاع c = 4.693 Å. حجم وحدة الخلية يبلغ 291.4 Å3 (المقاييس البلورية بالأنجستروم).
على عكس مادتين تقليديتين من مادة الكاثود (المهبط) ، LiMnO4 و LiCoO2 ، تنتقل أيونات الليثيوم من LiMPO4 في الشبكة البلورية في اتجاه واحد في الشبكة البلورية . أثناء الشحن /والتفريغ ، يتم استخراج أيونات الليثيوم بالتزامن مع أكسدة الحديد وتحرير إلكترون ، طبقا للمعادلة :
الإلكترونات تصبح حرة وتشكل تيارا كهربائيا.
عند استخراج الليثيوم من LiFePO4 ينتج FePO4 بهيكل مماثل. ويشغل FePO4 هيكل بلوري من تصنيف "مجموعة فضاء" P mnb بحجم وحدة خلية يبلغ حجمها 272.4 Å 3 ،أي أصغر قليلاً من سلائفها ذات الليثيوم. يقلل استخراج أيونات الليثيوم من الشبكة ، كما هو الحال مع أكاسيد الليثيوم LiMPO4 فإن الزاوية المشتركة FeO6 لثماني السطوح مفصولة بذرات الأكسجين من الـ PO43- (سالبة الشحنة -3) في رباعي السطوح ولا يمكن أن تشكل FeO6 المستمر في الشبكة البلورية ، وهذا يُحد من التوصيل الكهربي.
تشكل مجموعة سداسية معبأة تقريبًا من مراكز الأكاسيد حجمًا صغيرا نسبيًا لأيونات الليثيوم Li+ للحركة بداخلها. لهذا السبب ، فإن الموصلية الأيونية لـ Li+ منخفضة نسبيًا في درجة حرارة الغرفة. تفاصيل إدخال الليثيوم lithiation في FePO4 وإنتاج LiFePO4 تم فحصه بواسطة LiFePO4 ، توجد مرحلتان من المواد الصخرية فعالة .[15][16]
التطبيقات[عدل]
خلايا مواد الـ LFP لها جهد تشغيل يبلغ 3.3 فولت ، و كثافة الشحن 170 مللي أمبير/جرام ،وهي كثافة طاقة عالية ، وذات دورة حياة طويلة ، وثبات في درجات الحرارة العالية.
تتمثل المزايا التجارية الرئيسية للمواد LFP في أنها لا تطرح سوى القليل من مخاوف السلامة مثل ارتفاع درجة الحرارة والانفجار ، فضلاً عن دورات الحياة الطويلة وكثافة الطاقة العالية ولديها نطاق درجة حرارة تشغيل أوسع. تستخدم محطات توليد الطاقة والسيارات الكهربائية بطاريات LFP.[17][18]
أعلنت شركة BAE أن السيارة HybriDrive Orion 7 الهجين تستخدم حوالي 180 خلايا بطارية من نوع KW LFP. وطورت شركة AES أنظمة بطاريات بقدرة تريليونات واط قادرة على تقديم خدمات فرعية لشبكة الطاقة ، بما في ذلك السعة الاحتياطية وتعديل التردد. وفي الصين تنشط BAK و Tianjin Lishen في ذلك المجال .
مقارنة[عدل]
على الرغم من أن بطاريات LFP لديها سعة أقل بنسبة 25 ٪ من بطاريات الليثيوم الأخرى نظرًا لجهدها التشغيلي (3.2 فولت مقابل 3.7 فولت في كيمياء الكاثود القائمة على المشاركة) ، إلا أنها تحتوي على 70 ٪ أكثر من بطاريات النيكل والهيدروجين .
الاختلافات الرئيسية بين بطاريات LFP وأنواع بطاريات أيونات الليثيوم الأخرى هي أن بطاريات LFP لا تحتوي على كوبالت ولها منحنى تفريغ مسطح.
بطاريات LFP لها عيوب قليلة تنشأ من خصائص العزل الكهربائي لـ LFP ، بالإضافة إلى الحد الأقصى لجهد الشحن / التفريغ المنخفض. و كثافة الطاقة أقل بكثير من بطارية LiCoO2 (على الرغم من أنها أعلى من بطارية هيدريد النيكل والمعدن ).
تكون كيمياء البطاريات القائمة على أكسيد الكوبالت - ليثيوم أكثر عرضة للانفجار الحراري إذا تم الشحن الزائد ، و الكوبالت باهظ الثمن وغير متاح جغرافيًا على نطاق واسع. لهذا حلت كيمياءأخرى مثل النيكل والمنغنيز والكوبالت (NMC) محل الخلايا الكيميائية LiCo في معظم التطبيقات. كانت النسبة الأصلية لـ Ni و Mn وCo هي 3: 3: 3 ، بينما اليوم يتم تصنيع الخلايا بنسب 8: 1: 1 أو 6: 2: 2 ، حيث تم تقليل محتوى الكوبلت Co بشكل كبير.
نجد أن بطاريات فوسفات الليثيوم والحديد LiFePO 4 قابلة للمقارنة مع بطارية الرصاص وغالبًا ما يتم الترويج لها كبديل لبطاريات الرصاص. يتمثل الاختلاف الأكثر بروزًا بين فوسفات حديد الليثيوم وبطارية الرصاص في حقيقة أن سعة بطارية الليثيوم مستقلة عن معدل التفريغ. مع معدلات تفريغ عالية جدًا ، على سبيل المثال عند 0.8 درجة مئوية فإن سعة بطارية الرصاص الحمضية تبلغ 60٪ فقط من السعة المقدرة. لذلك في التطبيقات الدورية حيث يكون معدل التفريغ غالبًا أكبر من 0.1 درجة مئوية ، غالبًا ما يكون لبطارية الليثيوم ذات التصنيف الأقل سعة فعلية أعلى من بطارية الرصاص الحمضية المماثلة. هذا يعني أنه في نفس تصنيف السعة ، سيكلف الليثيوم أكثر ، ولكن يمكن استخدام بطارية ليثيوم ذات سعة أقل لنفس التطبيق بسعر أقل. تزيد تكلفة الملكية عند النظر في دورة الحياة من قيمة بطارية الليثيوم مقارنة ببطارية الرصاص الحمضية.[19]
الملكية الفكرية[عدل]
براءات الاختراع الجذرية لمركبات LFP مملوكة من قبل أربع منظمات. جامعة تكساس - أوستن لاكتشاف المادة. Hydro-Québec وجامعة مونتريال والمركز الوطني الفرنسي للبحث العلمي (CNRS) لطلاء الكربون الذي يعزز الموصلية ويجعل LFP مناسبًا للتطورات الصناعية.[20] هذه البراءات هي أساس تقنيات الإنتاج الضخم الناضجة. أكبر طاقة إنتاجية تصل إلى 250 طنًا شهريًا. السمة الرئيسية هي Li1−xMFePO4 من A123 وهو nano-LFP ، الذي يعدل خصائصه الفيزيائية ويضيف معادن نبيلة في الأنود ، بالإضافة إلى استخدام الجرافيت الخاص ككاثود.
الميزة الرئيسية لـ LiMPO4 من Phostech هو زيادة السعة والتوصيل عن طريق طلاء كربون مناسب. الميزة الخاصة لـ LiFePO4 • zM من Aleees سعة عالية ومقاومة منخفضة تم الحصول عليها عن طريق التحكم المستقر في الفريت ونمو البلورات. يتم تحقيق هذا التحكم المحسن من خلال تطبيق قوى تحريك ميكانيكية قوية على السلائف في حالات التشبع العالي ، مما يؤدي إلى تبلور أكاسيد الفلزات و LFP.
قدمت دعاوى براءات الاختراع في الولايات المتحدة في عامي 2005 و 2006 ، زعمت جامعة تكساس في أوستن | جامعة تكساس-أوستن و Hydro-Québec أن LiFePO4 لأن الكاثود ينتهك براءات الاختراع الخاصة بهم ،US 5910382 وUS 6514640 . تضمنت مطالبات براءة الاختراع بنية بلورية فريدة وصيغة كيميائية لمادة كاثود البطارية.
في 7 أبريل 2006 رفعت شركة A123 دعوى تطلب إعلانًا بعدم انتهاك براءات اختراع UT وبطلانها. قدمت A123 بشكل منفصل اثنين من إجراءات إعادة الفحص من طرف واحد أمام مكتب براءات الاختراع والعلامات التجارية بالولايات المتحدة (USPTO) ، حيث سعوا إلى إبطال براءات الاختراع بناءً على حالة التقنية الصناعية السابقة.
في دعوى قضائية موازية رفعت UT دعوى قضائية ضد شركة Valence Technology، Inc. - شركة تقوم بتسويق منتجات LFP التي تدعي حدوث انتهاك.
أصدر مكتب الولايات المتحدة الأمريكية للبراءات (USPTO) شهادة إعادة فحص لبراءة الاختراع رقم 382 في 15 أبريل 2008 ، و 640 براءة اختراع في 12 مايو 2009 ، والتي تم بموجبها تعديل مطالبات براءات الاختراع هذه. سمح ذلك بدعوى انتهاك براءات الاختراع الحالية التي رفعتها Hydro-Quebec ضد Valence و A123 بالمضي قدمًا. بعد جلسة استماع في Markman ، في 27 أبريل 2011 ، قضت محكمة المقاطعة الغربية في تكساس بأن مطالبات براءات الاختراع المعاد فحصها كان لها نطاق أضيق مما تم منحه في الأصل.
في 9 ديسمبر 2008 ، ألغى مكتب براءات الاختراع الأوروبي براءة اختراع الدكتور جودنو برقم 0904607. قلل هذا القرار بشكل أساسي من مخاطر براءات الاختراع لاستخدام LFP في تطبيقات السيارات الأوروبية. يُعتقد أن القرار يستند إلى عدم وجود حداثة.[21]
أول تسوية كبيرة كانت الدعوى القضائية بين NTT وجامعة تكساس أوستن (UT). في أكتوبر 2008 ، [22] أعلنت شركة NTT أنها ستحسم القضية في المحكمة المدنية العليا باليابان مقابل 30 مليون دولار. كجزء من الاتفاقية ، وافقت UT على أن NTT لم تسرق المعلومات وأن NTT ستشارك براءات اختراع LFP مع UT. براءة اختراع NTT هي أيضًا للزبرجد الزيتوني LFP ، مع الصيغة الكيميائية العامة لـ AyMPO4 (A للمعدن القلوي و M لمزيج من Co و Fe) ، تستخدمه الآن شركة BYD . على الرغم من أن المواد كيميائيًا هي نفسها تقريبًا ، من وجهة نظر براءات الاختراع ، فإن AyMPO4 من NTT يختلف عن المواد التي يغطيها UT. AyMPO4 لديه قدرة أعلى من LiMPO4 . كان جوهر القضية هو أن مهندس NTT Okada Shigeto ، الذي عمل في مختبرات UT لتطوير المواد ، متهم بسرقة الملكية الفكرية لـ UT.
اعتبارًا من عام 2020 تدّعي منظمة تدعى LifePO + C أنها تمتلك عنوان IP الرئيسي وتقدم التراخيص. وهي عبارة عن كونسورتيوم بين Johnson Matthey و CNRS وجامعة مونتريال و Hydro Quebec.
البحوث[عدل]
كثافة الطاقة[عدل]
يحتوي LFP على عيبين: الموصلية المنخفضة (الجهد الزائد) وثابت انتشار الليثيوم المنخفض ، وكلاهما يحد من معدل الشحن / التفريغ. إضافة جزيئات موصلة في FePO4 يرفع الموصلية الإلكترونية لها. على سبيل المثال ، إضافة جسيمات موصلة ذات قدرة انتشار جيدة مثل الجرافيت والكربون [23] إلى LiMPO4 هذه مساحيق تحسن التوصيل بين الجزيئات بشكل كبير ، وتزيد من كفاءة LiMPO4 كبطارية، وترفع قدرتها العكسية حتى 95٪ من القيم النظرية. ومع ذلك فإن إضافة المضافات الموصّلة تزيد أيضًا من "الكتلة الخاملة" الموجودة في الخلية والتي لا تساهم في تخزين الطاقة. يُظهر الشكل LiMPO4 أداء تدوير جيد حتى في وجود تيار الشحن /والتفريغ الذي قد يصل إلى 5 درجات مئوية.[24]
استقرار[عدل]
يمكن لطلاء LFP بأكاسيد غير عضوية أن يجعل هيكل LFP أكثر استقرارًا ويزيد من الموصلية. LiCoO2 التقليدي مع طلاء أكسيد يبدي تدوير احسن. يمنع هذا الطلاء أيضًا إذابة Co ويبطئ تحلل سعة LiCoO2 . وبالمثل ، طلاء LiMPO4 بطبقة غير عضوية مثل ZnO [25] و ZrO2 ، [26] يتمتع بعمر تدوير أفضل ، وقدرة أكبر وخصائص أفضل في حالة التفريغ السريع. تؤدي إضافة كربون كموصل إلى زيادة الكفاءة. أفادت مجموعة ميتسوي زوسن وأليس أن إضافة جزيئات معدنية موصلة مثل النحاس والفضة زادت أيضا من الكفاءة.[27] LiMPO4 مع 1٪ بالوزن من الإضافات المعدنية لديه قدرة عكسية تصل إلى 140 مللي أمبير/غرام ، وكفاءة أفضل في حالة تيار تفريغ عالي.
استبدال المعادن[عدل]
استبدال المعادن الأخرى بالحديد أو الليثيوم في المركب LiMPO4 يمكن أيضا رفع الكفاءة. يؤدي استبدال الزنك بالحديد إلى زيادة تبلور LiMPO4 لأن الزنك والحديد لهما أنصاف أقطار أيونية متشابهة.[28] يؤكد قياس الفولتميتر الدوري أن LiFe1−xMxPO4 بعد استبدال المعدن تكون له قابلية أعلى لإدخال واستخراج أيونات الليثيوم. فأثناء استخراج الليثيوم يتأكسد الحديد Fe(II) إلى Fe(III) ويتقلص حجم الشبكة. الحجم المتقلص يغير مسارات عودة الليثيوم.
عمليات التوليف[عدل]
على غرار أكاسيد الليثيوم يمكن تصنيع LiMPO4 من خلال مجموعة متنوعة من الطرق ، بما في ذلك: تخليق المرحلة الصلبة ، وتجفيف المستحلب ، وعملية سول-جل Sol–gel process، والترسيب المشترك للمحلول ، وترسب طور البخار ، والتوليف الكهروكيميائي ، وتشعيع الحزمة الإلكترونية ، وعملية الميكروويف[مبهم] ، التوليف الحراري المائي ، و الانحلال الحراري بالموجات فوق الصوتية والانحلال الحراري بالرش .
في عملية التجفيف بالمستحلب ، يتم أولاً خلط المستحلب بالكيروسين. بعد ذلك ، تضاف محاليل أملاح الليثيوم وأملاح الحديد إلى هذا الخليط. تنتج هذه العملية جزيئات نانوكربون.[29] ينتج التوليف المائي LiMPO4 مع تبلور جيد. يتم الحصول على الكربون الموصل عن طريق إضافة البولي إيثيلين جلايكول إلى المحلول متبوعًا بالمعالجة الحرارية.[30] ينتج ترسب الطور البخاري غشاء رقيقا على LiMPO4 .[31] في الانحلال الحراري بالرش اللهب يتم خلط FePO 4 مع كربونات الليثيوم ووالجلوكوز وشحنه بالكهرباء . ثم يتم حقن الخليط داخل اللهب وترشيحه لتجميع المنتج LiFePO4 .[32]
تأثيرات درجة الحرارة[عدل]
يمكن تقسيم تأثيرات درجة الحرارة على بطاريات فوسفات الحديد والليثيوم إلى تأثيرات درجات الحرارة المرتفعة ودرجة الحرارة المنخفضة.
بشكل عام ، تكون بطاريات من نوع LFP أقل عرضة للتفاعلات الحرارية الشديدة مثل تلك التي تحدث في بطاريات الليثيوم الكوبالت ؛ تُظهر بطاريات LFP أداءً أفضل عند درجات حرارة مرتفعة. أظهرت الأبحاث أنه في درجة حرارة الغرفة (23 درجة مئوية) ، فإن فقدان السعة الأولي يقارب 40-50 مللي أمبير/ثانية. ومع ذلك فعند 40 درجة مئوية و 60 درجة مئوية ، تكون خسائر السعة تقريب 25 و 15 ملي أمبير/جرام على التوالي ، ولكن تم توزيع انخفاض السعة هذه على 20 دورة بدلاً من انخفاض كبير مثل تلك في حالة فقدان سعة في درجة حرارة الغرفة.[33]
ومع ذلك ، هذا صحيح فقط للإطار الزمني القصير للتدوير. أظهرت دراسة لاحقة لمدة عام أنه على الرغم من أن بطاريات LFP لها ضعف الدورة الكاملة المكافئة ، إلا أن معدل تغير السعة زاد مع زيادة درجة حرارة خلايا LFP ، ولكن درجة الحرارة المتزايدة لا تؤثر على خلايا NCA أو يكون لها تأثير ضئيل على شيخوخة خلايا NMC.[34] يرجع هذا الانخفاض في السعة في المقام الأول إلى تفاعل تكوين السطح البيني بين الكهرل والقطب الصلب (SEI) الذي يتم تسريعه بزيادة درجة الحرارة.
تتأثر بطاريات LFP بشكل خاص بانخفاض درجة الحرارة مما قد يعيق تطبيقها في مناطق خطوط العرض العليا. قدرات التفريغ الأولية لعينات LFP / C عند درجات حرارة 23 و 0 و -10 و -20 درجة مئوية هي: 141.8 و 92.7 و 57.9 و 46.7 بكفاءة كولومبية 91.2٪ ،و 74.5٪ ،و 63.6٪ و 61.3٪. يتم حساب هذا الانخفاض عن طريق الانتشار البطيء لأيونات الليثيوم داخل الأقطاب الكهربائية وتشكيل السطح البيني بين الكهرل والمادة الصلبة SEI التي تأتي مع درجات حرارة منخفضة مما يؤدي لاحقًا إلى زيادة مقاومة نقل الشحنة على واجهات الإلكتروليت (الكهرل) والقطب الكهربي.[35] سبب آخر محتمل لتكوين السعة المنخفضة هو طلاء الليثيوم. كما ذكر أعلاه ، تقلل درجة الحرارة المنخفضة من معدل انتشار أيونات الليثيوم داخل الأقطاب الكهربائية ، مما يسمح لمعدل طلاء الليثيوم بالتنافس مع معدل الإقحام. تؤدي الحالة الأكثر برودة إلى معدلات نمو أعلى وتحول النقطة الأولية إلى حالة شحن أقل مما يعني أن عملية الطلاء تبدأ في وقت مبكر. [36] يستخدم طلاء الليثيوم الليثيوم الذي يتنافس بعد ذلك مع إقحام الليثيوم في الجرافيت ، مما يقلل من قدرة البطاريات. تترسب أيونات الليثيوم المجمعة على سطح الأقطاب الكهربائية على شكل "ألواح" أو حتى في أشكال تشعبات قد تخترق الفواصل ، مما يؤدي إلى قصر دائرة البطارية تمامًا.[37]
الاستخدام[عدل]
فوسفات الحديد والليثيوم هو مادة تخزين الليثيوم (مادة الكاثود) في القطب الموجب لبطاريات فوسفات الحديد والليثيوم. عند شحن البطارية يتكون فوسفات الحديد (III) ، والذي يتم تحويله مرة أخرى إلى فوسفات حديد (II) الليثيوم عند التفريغ:
- التحميل الكامل:
.
- التفريغ الكامل:
الجهد الكهربائي لمراكم فوسفات الحديد والليثيوم هو 3.3 فولت ، وهو أقل قليلاً من الجهد الخاص بمراكم أيونات الليثيوم الأخرى، مثل على سبيل المثال، أكسيد الكوبالت الليثيوم ، والذي يعني كثافة طاقة أقل بشكل عام. تشمل فوائد فوسفات الحديد والليثيوم: عمر أطول بكثير. [17] نظرًا للثبات العالي لـ LiFePO4 ، تعتبر البطاريات بهذه المادة آمنة بشكل خاص. لذلك تُستخدم المراكم المقابلة أيضًا في المركبات الكهربائية - على سبيل المثال - المستخدمة في الدراجات الكهربائية. يستخدم فوسفات الحديد والليثيوم أيضًا في بعض السيارات الكهربائية - على سبيل المثال - في السيارة الكهربائية BYD e6 الصينية وفي بعض موديلات تسلا .
انظر أيضًا[عدل]
- بطارية فوسفات الحديد والليثيوم
- أنظمة A123
- تقنية التكافؤ
مراجع[عدل]
- ^ Park, O. K.; Cho, Y.; Lee, S.; Yoo, H.-C.; Song, H.-K.; Cho, J., "Who Will Drive Electric Vehicles, Olivine or Spinel?", Energy Environ. Sci. 2011, volume 4, pages 1621-1633. دُوِي:10.1039/c0ee00559b
- ^ Ozawa، Ryan (7 يوليو 2015). "New Energy Storage Startup to Take Hawaii Homes Off-Grid". Hawaii Blog. مؤرشف من الأصل في 2023-01-24. اطلع عليه بتاريخ 2015-07-09.
- ^ "Google Looks to Batteries as Replacement for Diesel Generators". 16 ديسمبر 2020. مؤرشف من الأصل في 2023-01-24.
- ^ Fedotov, Stanislav S.; Luchinin, Nikita D.; Aksyonov, Dmitry A.; Morozov, Anatoly V.; Ryazantsev, Sergey V.; Gaboardi, Mattia; Plaisier, Jasper R.; Stevenson, Keith J.; Abakumov, Artem M. (20 Mar 2020). "Titanium-based potassium-ion battery positive electrode with extraordinarily high redox potential". Nature Communications (بالإنجليزية). 11 (1): 1484. Bibcode:2020NatCo..11.1484F. DOI:10.1038/s41467-020-15244-6. ISSN:2041-1723. PMID:32198379.
LiTiPO4F
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help) - ^ Kim، Jongsoon (2012). "Thermal Stability of Fe-Mn Binary Olivine Cathodes for Li Rechargeable Batteries". The Royal Society of Chemistry. ج. 22 ع. 24: 11964. DOI:10.1039/C2JM30733B. مؤرشف من الأصل في 2023-01-24. اطلع عليه بتاريخ 2012-10-19.
- ^ Wang, J.; Sun, X., "Olivine Lifepo4: The Remaining Challenges for Future Energy Storage", Energy Environ. Sci. 2015, volume 8, pages 1110-1138. دُوِي:10.1039/C4EE04016C
- ^ Masquelier، Christian؛ Croguennec، Laurence (2013). "Polyanionic (Phosphates, Silicates, Sulfates) Frameworks as Electrode Materials for Rechargeable Li (or Na) Batteries". Chemical Reviews. ج. 113 ع. 8: 6552–6591. DOI:10.1021/cr3001862. PMID:23742145.
- ^ Manthiram، A.؛ Goodenough، J. B. (1989). "Lithium insertion into Fe2(SO4)3 frameworks". Journal of Power Sources. ج. 26 ع. 3–4: 403–408. Bibcode:1989JPS....26..403M. DOI:10.1016/0378-7753(89)80153-3.
- ^ Manthiram، A.؛ Goodenough، J. B. (1987). "Lithium insertion into Fe2(MO4)3 frameworks: Comparison of M = W with M = Mo". Journal of Solid State Chemistry. ج. 71 ع. 2: 349–360. Bibcode:1987JSSCh..71..349M. DOI:10.1016/0022-4596(87)90242-8.
- ^ "LiFePO4: A Novel Cathode Material for Rechargeable Batteries", A.K. Padhi, K.S. Nanjundaswamy, J.B. Goodenough, Electrochemical Society Meeting Abstracts, 96-1, May, 1996, pp 73
- ^ “Phospho-olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries” A. K. Padhi, K. S. Nanjundaswamy, and J. B. Goodenough, J. Electrochem. Soc., Volume 144, Issue 4, pp. 1188-1194 (April 1997)
- ^ Nature Materials, 2008, 7, 707-711.
- ^ Jugović، Dragana؛ Uskoković، Dragan (15 مايو 2009). "A review of recent developments in the synthesis procedures of lithium iron phosphate powders". Journal of Power Sources. ج. 190 ع. 2: 538–544. Bibcode:2009JPS...190..538J. DOI:10.1016/j.jpowsour.2009.01.074. ISSN:0378-7753. مؤرشف من الأصل في 2023-01-24. اطلع عليه بتاريخ 2017-11-21.
- ^ Love, Corey T.؛ Korovina, Anna؛ Patridge, Christopher J.؛ Swider-Lyons؛ Karen E.؛ Twigg, Mark E.؛ Ramaker, David E. (2013). "Review of LiFePO4 phase transition mechanisms and new observations from X-ray absorption spectroscopy". Journal of the Electrochemical Society. ج. 160 ع. 5: A3153–A3161. DOI:10.1149/2.023305jes.
- ^ Love, Corey T.؛ Korovina, Anna؛ Patridge, Christopher J.؛ Swider-Lyons؛ Karen E.؛ Twigg, Mark E.؛ Ramaker, David E. (2013). "Review of LiFePO4 phase transition mechanisms and new observations from X-ray absorption spectroscopy". Journal of the Electrochemical Society. ج. 160 ع. 5: A3153–A3161. DOI:10.1149/2.023305jes.Love, Corey T.; Korovina, Anna; Patridge, Christopher J.; Swider-Lyons; Karen E.; Twigg, Mark E.; Ramaker, David E. (2013). "Review of LiFePO
4 phase transition mechanisms and new observations from X-ray absorption spectroscopy". Journal of the Electrochemical Society. 160 (5): A3153–A3161. doi:10.1149/2.023305jes. - ^ Malik, R.; Abdellahi, A.; Ceder, G., "A Critical Review of the Li Insertion Mechanisms in LiFePO4 Electrodes", J. Electrochem. Soc. 2013, volume 160, pages A3179-A3197. دُوِي:10.1149/2.029305jes
- ^ Rechargeable Li-ion batteries based on Olivine-structured (LiFePO4) cathode materials - Kumar et al., Nov 15, 2015, retrieved April 1, 2020 نسخة محفوظة 2020-08-03 على موقع واي باك مشين.
- ^ Warren، Chris (12 مارس 2016). "What You Need To Know About LiFePO4 Batteries". مؤرشف من الأصل في 2023-01-24.
- ^ "Lead Acid Vs LiFePO4 Batteries". Power Sonic - Trusted Battery Solutions. 25 فبراير 2020. مؤرشف من الأصل في 2023-02-01.
- ^ Basel، Clariant Ltd. "Especialidades químicas da Clariant". Clariant Ltd. مؤرشف من الأصل في 2023-02-07.
- ^ "EPO Revokes Univ. Of Texas European Patent on Lithium Metal Phosphates; Boon for Valence". مؤرشف من الأصل في 2023-01-24.
- ^ "NTT Settles Lawsuit over Li-ion Battery Patents". مؤرشف من الأصل في 2023-01-24.
- ^ Deb، Aniruddha؛ Bergmann، Uwe؛ Cairns، Elton J.؛ Cramer، Stephen P. (يونيو 2004). "Structural Investigations of LiFePO 4 Electrodes by Fe X-ray Absorption Spectroscopy". The Journal of Physical Chemistry B. ج. 108 ع. 22: 7046–7051. DOI:10.1021/jp036361t.
- ^ Haas، O.؛ Deb، A.؛ Cairns، E. J.؛ Wokaun، A. (2005). "Synchrotron X-Ray Absorption Study of LiFePO[sub 4] Electrodes". Journal of the Electrochemical Society. ج. 152 ع. 1: A191. DOI:10.1149/1.1833316.
- ^ Kwon، Sang Jun؛ Kim، Cheol Woo؛ Jeong، Woon Tae؛ Lee، Kyung Sub (أكتوبر 2004). "Synthesis and electrochemical properties of olivine LiFePO4 as a cathode material prepared by mechanical alloying". Journal of Power Sources. ج. 137 ع. 1: 93–99. Bibcode:2004JPS...137...93K. DOI:10.1016/j.jpowsour.2004.05.048.
- ^ Dominko، R.؛ Bele، M.؛ Gaberscek، M.؛ Remskar، M.؛ Hanzel، D.؛ Goupil، J.M.؛ Pejovnik، S.؛ Jamnik، J. (فبراير 2006). "Porous olivine composites synthesized by sol–gel technique". Journal of Power Sources. ج. 153 ع. 2: 274–280. Bibcode:2006JPS...153..274D. DOI:10.1016/j.jpowsour.2005.05.033.
- ^ León، B.؛ Vicente، C. Pérez؛ Tirado، J. L.؛ Biensan، Ph.؛ Tessier، C. (2008). "Optimized Chemical Stability and Electrochemical Performance of LiFePO[sub 4] Composite Materials Obtained by ZnO Coating". Journal of the Electrochemical Society. ج. 155 ع. 3: A211–A216. DOI:10.1149/1.2828039.
- ^ Liu، H.؛ Wang، G.X.؛ Wexler، D.؛ Wang، J.Z.؛ Liu، H.K. (يناير 2008). "Electrochemical performance of LiFePO4 cathode material coated with ZrO2 nanolayer". Electrochemistry Communications. ج. 10 ع. 1: 165–169. DOI:10.1016/j.elecom.2007.11.016.
- ^ Croce، F.؛ D' Epifanio، A.؛ Hassoun، J.؛ Deptula، A.؛ Olczac، T.؛ Scrosati، B. (2002). "A Novel Concept for the Synthesis of an Improved LiFePO[sub 4] Lithium Battery Cathode". Electrochemical and Solid-State Letters. ج. 5 ع. 3: A47–A50. DOI:10.1149/1.1449302.
- ^ Ni، J.F.؛ Zhou، H.H.؛ Chen، J.T.؛ Zhang، X.X. (أغسطس 2005). "LiFePO4 doped with ions prepared by co-precipitation method". Materials Letters. ج. 59 ع. 18: 2361–2365. DOI:10.1016/j.matlet.2005.02.080.
- ^ Cho، Tae-Hyung؛ Chung، Hoon-Taek (يونيو 2004). "Synthesis of olivine-type LiFePO4 by emulsion-drying method". Journal of Power Sources. ج. 133 ع. 2: 272–276. Bibcode:2004JPS...133..272C. DOI:10.1016/j.jpowsour.2004.02.015.
- ^ Hamid، N.A.؛ Wennig، S.؛ Hardt، S.؛ Heinzel، A.؛ Schulz، C.؛ Wiggers، H. (أكتوبر 2012). "High-capacity cathodes for lithium-ion batteries from nanostructured LiFePO4 synthesized by highly-flexible and scalable flame spray pyrolysis". Journal of Power Sources. ج. 216: 76–83. Bibcode:2012JPS...216...76H. DOI:10.1016/j.jpowsour.2012.05.047.
- ^ Andersson، Anna S؛ Thomas، John O؛ Kalska، Beata؛ Häggström، Lennart (2000). "Thermal Stability of LiFePO4 -Based Cathodes". Electrochemical and Solid-State Letters. ج. 3: 66–68. DOI:10.1149/1.1390960. مؤرشف من الأصل في 2023-02-02. اطلع عليه بتاريخ 2021-11-18.
- ^ Preger، Yulia؛ Barkholtz، Heather M.؛ Fresquez، Armado؛ Campbell، Danel L.؛ Juba، Benjamin W. (2020). "Degradation of Commercial Lithium-Ion Cells as a Function of Chemistry and Cycling Conditions". Journal of the Electrochemical Society. ج. 167 ع. 12: 120532. Bibcode:2020JElS..167l0532P. DOI:10.1149/1945-7111/abae37. مؤرشف من الأصل في 2023-05-18. اطلع عليه بتاريخ 2021-11-18.
- ^ Rui، X.H.؛ Jin، Y.؛ Feng، X.Y.؛ Zhang، L.C.؛ Chen، C.H. (فبراير 2011). "A comparative study on the low-temperature performance of LiFePO4/C and Li3V2(PO4)3/C cathodes for lithium-ion batteries". Journal of Power Sources. ج. 196 ع. 4: 2109–2114. DOI:10.1016/j.jpowsour.2010.10.063. ISSN:0378-7753. مؤرشف من الأصل في 2023-05-26. اطلع عليه بتاريخ 2021-11-18.
- ^ Petzl، Mathias؛ Danzer، Michael A. (مايو 2014). "Nondestructive detection, characterization, and quantification of lithium plating in commercial lithium-ion batteries". Journal of Power Sources. ج. 254: 80–87. Bibcode:2014JPS...254...80P. DOI:10.1016/j.jpowsour.2013.12.060. ISSN:0378-7753. مؤرشف من الأصل في 2023-01-24. اطلع عليه بتاريخ 2021-11-18.
- ^ Liu، Huaqiang؛ Wei، Zhongbao؛ He، Weidong؛ Zhao، Jiyun (أكتوبر 2017). "Thermal issues about Li-ion batteries and recent progress in battery thermal management systems: A review". Energy Conversion and Management. ج. 150: 304–330. DOI:10.1016/j.enconman.2017.08.016. ISSN:0196-8904. مؤرشف من الأصل في 2023-04-04. اطلع عليه بتاريخ 2021-11-18.



