مخلوط هيدروجين وأكسجين
مخلوط الهيدروجين والأكسجين أو أوكسيهيدروجين (بالإنجليزية: Oxyhydrogen) هو مخلوط انفجاري من الهيدروجين والأكسجين بنسبة مئوية 2 :1 ، وهي نفس النسبة التي يتكون منها الماء.[1] يستخدم هذا المخلوط في القوس الهيدروجيني لإنتاج شعلات اللحام وتحضير المواد الشديدة المقاومة للحرارة، وكان أول مخلوط يستخدم للحام. عمليا، تستخدم نسبة من الهيدروجين والأكسجين 1:4 أو 1:5 لتفادي حدوث شعلة مؤكسدة.[2]
خواصه[عدل]
ينفجر مخلوط الهيدروجين والأكسجين بالنسبة 1:2 عندما تصل درجة حرارته 570 درجة مئوية من ذاته عند الضغط الجوي العادي.[3] وأقل طاقة تلزم لاشعال المخلوط ولتكن شرارة صغيرة تبلغ 20 ميكروجول.[3] ويمكن حرق المخلوط إذا كانت نسبة الهيدروجين بين 4% و 95 % من حجم المخلوط عند درجة حرارة الغرفة.[3]
يتحول المخلوط إلى بخار الماء بالاشتعال وتنتج عن التفاعل حرارة (تفاعل ناشر للحرارة) ، تعمل على استمرار الاشتعال. وينتج عن تفاعل 1 مول من الهيدروجين 8و241 كيلو جول من الطاقة. ولا يعتمد مقدار الطاقة الناتجة على طريقة الاشتعال ولكن درجة حرارة الشعلة قد تختلف.[1]
تنتج أعلى درجة حرارة من التفاعل (نحو 2800 درجة مئوية) عند اشتعال مخلوط نقي بنسبة اتحاد العناصر ، وهي نحو 700 درجة مئوية أعلى من احتراق الهيدروجين في الهواء (بسبب وجود النتروجين في الهواء). .[4][5][6]
وعندما يخلط المخلوط بنسبة غير النسبة 1:2 أو عندما يخلط غاز خامل مثل النيتروجين فإن درجة حرارة المخلوط تكون أقل بسبب انتشار الحرارة الناتجة في كمية أكبر من المواد. .[1]
تحضيره[عدل]
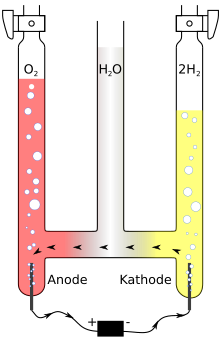
ينتج مخلوط الهيدروجين والأكسجين بالتحليل الكهربائي للماء، وفيه ينفصل غاز الأكسجين عن غاز الهيدروجين. كما يمكن تفكك الماء بالحرارة إلا أن ذلك يحتاج غلأى درجة حرارةعالية تصل إلى 2500 درجة مئوية.[7]
وينشأ انفصال الهيدروجين عن الأكسجين في الماء بواسطة تيار كهربائي. يغمس القطبان الكهربيان في الماء ويضاف إليه قليل من حمض يساعد على التوصيل ويفضل حمض الكبريتيك أو محلول قلوي. كما يمكن استخدام ملح الطعام ك كهرل ولكن بحسب شدة التيار ونوع القطبان يمكن أن ينفصل الكلور بدلا من الأكسجين.
التفاعل الانفجاري[عدل]
يشتعل مخلوط الهيدروجين والأكسجين بالنسبة 1:2 في انفجار شديد لأنه تفاعل ناشر للحرارة exothermic ، وتصل سرعة الانفجار 2820 متر/ثانية. وهو عملية احتراق.
معادلة التفاعل:
مجرد احداث شرارة في هذا المخلوط ينتج عنها تفاعلات تسلسلية تنتشر سريعا في كل حجم المخلوط المتاح، تتفاعل فيه الهيدروجين والأكسجين وجزيئات هيدروكسيل OH-.
وينتج عن تفاعل الهيدروجين والأكسجين الماء.
يكون إنتاج 1 مول من الماء مصحوبا بحرارة صادرة قدرها 571,6 كيلوجول/مول (ΔrH0 = −571,6 kJ/mol).[8]
ويتغير الإنثالبي H لواحد مول من الماء الناتج بمقدار −286 كيلوجول/مول.
كما يؤدي التفاعل إلى تفاعل جانبي ينتج فوق أكسيد الهيدروجين:
ويحدث تفاعل الهيدروجين والأكسجين أيضا في خلية الوقود. وطبقا لتصميم تلك الخلايا تُستغل الطاقة الحرة من التفاعل (وهي فرق الإنثالبي للمواد الداخلة في التفاعل والماء الناتج) ، وهي هنا بصفة أدق طاقة جيبس الحرة ΔG لإنتاج التيار الكهربي ويضيع جزء منها كحرارة. ويسري التفاعل في الخلية الوقود بطيئا ومُتحكم فيه.
المراجع[عدل]
- ^ أ ب ت 1911 Encyclopedia. "Oxyhydrogen Flame." (Available here Accessed 2008-01-19.)نسخة محفوظة 23 يناير 2013 على موقع واي باك مشين.
- ^ Viall، Ethan (1921). Gas Torch and Thermite Welding. McGraw-Hill. ص. 4.
- ^ أ ب ت O'Connor، Ken. "Hydrogen". NASA Glenn Research Center Glenn Safety Manual.
{{استشهاد بكتاب}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة)، الوسيط|مسار أرشيف=بحاجة لـ|مسار=(مساعدة)، الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة)، وروابط خارجية في|chapterurl= - ^ Calvert، James B. (21 أبريل 2008). "Hydrogen". جامعة دنفر. مؤرشف من الأصل في 2018-01-04. اطلع عليه بتاريخ 2009-04-23.
An air-hydrogen torch flame reaches 2045 °C, while an oxyhydrogen flame reaches 2660 °C.
- ^ "Adiabatic Flame Temperature". The Engineering Toolbox. مؤرشف من الأصل في 2017-10-06. اطلع عليه بتاريخ 2009-04-23. "Oxygen as Oxidizer: 3473 K, Air as Oxidizer: 2483 K"
- ^ "Temperature of a Blue Flame". مؤرشف من الأصل في 2017-12-01. اطلع عليه بتاريخ 2008-04-05. "Hydrogen in air: 2,400 K, Hydrogen in Oxygen: 3,080 K"
- ^ Grundzüge der Anorganischen Chemie I: Hauptgruppenelemente (SS 2003); www.weidenbruch.chemie.uni-oldenburg.de/wac1S.pdf.
- ^ [1] [وصلة مكسورة] [وصلة مكسورة] نسخة محفوظة 6 فبراير 2020 على موقع واي باك مشين.
انظر أيضا[عدل]
- انثالبي قياسي للتكوين
- سخانة
- نظرية بنسون
- إنتروبيا
- تبلور
- قياس الحرارة Calorimetry
- مسعر
- عملية ثابتة الحرارة Isenthalpic process
- قواعد بيانات ترموديناميكية للمواد النقية Thermodynamic databases for pure substances
- انثالبي التسامي







