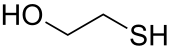
ميركابتويثانول-2
هذه مقالة غير مراجعة. (ديسمبر 2021) |
| 2-Mercaptoethanol | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
2-Sulfanylethan-1-ol[1] |
|
| أسماء أخرى | |
2-Mercaptoethan-1-ol |
|
| المعرفات | |
| رقم CAS | 60-24-2 |
| بوب كيم (PubChem) | 1567 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C2H6OS |
| كتلة مولية | 78.13 غ.مول−1 |
| الرائحة | Disagreeable, distinctive |
| الكثافة | 1.114 g/cm3 |
| نقطة الانصهار | −100 °س، 173 °ك، -148 °ف |
| نقطة الغليان | 157 °س، 430 °ك، 314 °ف |
| log P | -0.23 |
| ضغط البخار | 0.76 hPa (at 20 °C) 4.67 hPa (at 40 °C) |
| حموضة (pKa) | 9.643 |
| القاعدية (pKb) | 4.354 |
| معامل الانكسار (nD) | 1.4996 |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | DANGER |
| بيانات الخطر وفق GHS | H301, H310, H315, H317, H318, H330, H410 |
| بيانات وقائية وفق GHS | P260, P273, P280, P284, P301+310, P302+350 |
| حدود الاشتعال | 18% |
| LD50 | 244 mg/Kg (oral, rat)[2] 150 mg/kg (skin, rabbit)[2] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
2-Mercaptoethanol (أيضًا β-mercaptoethanol أو BME أو 2BME أو 2-ME أو β-met ) هو مركب كيميائي له الصيغة HOCH 2 CH 2 SH. يتم استخدام ME أو βME ، كما هو شائع ، لتقليل روابط ثاني كبريتيد ويمكن أن يعمل كمضاد أكسدة بيولوجي عن طريق تنظيف جذور الهيدروكسيل (من بين أمور أخرى). يستخدم على نطاق واسع لأن مجموعة الهيدروكسيل تمنح القابلية للذوبان في الماء وتقلل من التطاير. نظرًا لتناقص ضغط البخار ، فإن رائحته ، على الرغم من كونها كريهة ، تكون أقل قابلية للاعتراض من الثيول المرتبط بها.
إنتاج[عدل]
2- يتم تصنيع الميركابتويثانول صناعياً عن طريق تفاعل أكسيد الإيثيلين مع كبريتيد الهيدروجين، ثايوديغليكول والزيولايت المختلفة تحفيز رد الفعل.[3]
تفاعلات[عدل]
يتفاعل 2-Mercaptoethanol مع الألدهيدات والكيتونات لإعطاء الأوكساثيولانات المقابلة.[4] هذا يجعل 2-مركابتوإيثانول مفيدًا كمجموعة حماية ، مما يعطي مشتقًا يكون ثباته بين ثبات الديوكسولين وdithiolane .[5]
التطبيقات[عدل]
تقليل البروتينات[عدل]
يمكن تغيير طبيعة بعض البروتينات عن طريق 2-مركابتوإيثانول، والذي يشق روابط ثاني كبريتيد التي قد تتشكل بين مجموعات ثيول من بقايا السيستين، في حالة زيادة 2-مركابتوإيثانول يتم تحويل التوازن التالي إلى اليمين:
عن طريق كسر روابط SS ، يمكن أن يتم تعطيل كل من البنية الثلاثية والبنية الرباعية لبعض البروتينات. [6] بسبب قدرتها على تعطيل بنية البروتينات، انه كان يستخدم في تحليل البروتينات، على سبيل المثال، لضمان أن الحل البروتين يحتوي على جزيئات البروتين أحادى، بدلا من ثاني كبريتيد مرتبطة dimers أو أعلى ترتيب الأوليغومرات . ومع ذلك ، نظرًا لأن أشكال 2-مركابتوإيثانول تتضافر مع السيستين الحرة وهي أكثر سمية إلى حد ما ، فإن ثنائي ثيوثريتول (DTT) يستخدم بشكل عام أكثر خاصة في SDS-PAGE . DTT هو أيضًا عامل اختزال أقوى له إمكانية الأكسدة والاختزال (عند درجة الحموضة 7) من −0.33 V ، مقارنة بـ −0.26 V لـ 2-مركابتوإيثانول.[7]
غالبًا ما يستخدم 2-Mercaptoethanol بالتبادل مع dithiothreitol (DTT) أو ثلاثي عديم الرائحة (2-carboxyethyl) phosphine (TCEP) في التطبيقات البيولوجية.
على الرغم من أن 2-مركابتوإيثانول له تقلبات أعلى من DTT ، إلا أنه أكثر استقرارًا: نصف عمر 2-مركابتوإيثانول أكثر من 100 ساعة عند درجة الحموضة 6.5 و 4 ساعات عند درجة الحموضة 8.5 ؛ يبلغ عمر النصف لـ DTT 40 ساعة عند درجة الحموضة 6.5 و 1.5 ساعة عند درجة الحموضة 8.5 [8][9]
منع أكسدة البروتين[عدل]
غالبًا ما يتم تضمين 2-Mercaptoethanol وعوامل الاختزال ذات الصلة (على سبيل المثال ، DTT) في التفاعلات الأنزيمية لمنع أكسدة بقايا السلفهيدريل الحرة ، وبالتالي الحفاظ على نشاط البروتين. غالبًا ما يستخدم في فحوصات الإنزيم كمكون عازل قياسي.[10]
تغيير طبيعة الريبونوكليز[عدل]
يستخدم 2-Mercaptoethanol في بعض إجراءات عزل RNA للتخلص من ribonuclease المنطلق أثناء تحلل الخلايا. العديد من روابط ثاني كبريتيد تجعل الريبونوكلياز أنزيمات مستقرة جدًا ، لذلك يتم استخدام 2-مركابتويثانول لتقليل روابط ثاني كبريتيد هذه وتغيير طبيعة البروتينات بشكل لا رجعة فيه. هذا يمنعهم من هضم الحمض النووي الريبي أثناء إجراء الاستخراج.[11]
أمان[عدل]
يعتبر 2- الميركابتويثانول ساماً، حيث يسبب تهيج ممرات الأنف والجهاز التنفسي عند الاستنشاق، وتهيج الجلد، والتقيؤ وآلام المعدة من خلال الابتلاع، وربما الموت في حالة التعرض الشديد.[12]
مراجع[عدل]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: الجمعية الملكية للكيمياء. 2014. ص. 697. DOI:10.1039/9781849733069-FP001. ISBN:978-0-85404-182-4.
The prefixes 'mercapto' (–SH), and 'hydroseleno' or selenyl (–SeH), etc. are no longer recommended.
- ^ أ ب 2-Mercaptoethanol نسخة محفوظة 11 ديسمبر 2021 على موقع واي باك مشين.
- ^ Roy، Kathrin-Maria (2005)، "Thiols and Organic sulphides"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.a26_767
- ^ "1,3-Dithiolanes, 1,3-Dithianes". Organic Chemistry Portal. مؤرشف من الأصل في 2008-05-17. اطلع عليه بتاريخ 2008-05-27.
- ^ Sartori، Giovanni؛ Ballini، Roberto؛ Bigi، Franca؛ Bosica، Giovanna؛ Maggi، Raimondo؛ Righi، Paolo (2004). "Protection (and Deprotection) of Functional Groups in Organic Synthesis by Heterogeneous Catalysis". Chem. Rev. ج. 104 ع. 1: 199–250. DOI:10.1021/cr0200769. PMID:14719975.
- ^ "2-Mercaptoethanol". Chemicalland21.com. مؤرشف من الأصل في 2006-10-05. اطلع عليه بتاريخ 2006-10-08.
- ^ Aitken CE؛ Marshall RA, Puglisi JD (2008). "An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments". Biophys J. ج. 94 ع. 5: 1826–35. Bibcode:2008BpJ....94.1826A. DOI:10.1529/biophysj.107.117689. PMID:17921203.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Yeh, J. I. (2009) "Additives and microcalorimetric approaches for optimization of crystallization" in Protein Crystallization, 2nd Edition (Ed: T. Bergfors), International University Line, La Jolla, CA. (ردمك 978-0-9720774-4-6)
- ^ Stevens R.؛ Stevens L.؛ Price N.C. (1983). "The Stabilities of Various Thiol Compounds used in Protein Purifications". Biochemical Education. ج. 11 ع. 2: 70. DOI:10.1016/0307-4412(83)90048-1.
- ^ Verduyn، C؛ Van Kleef، R؛ Frank، J؛ Schreuder، H؛ Van Dijken، J. P.؛ Scheffers، W. A. (1985). "Properties of the NAD(P)H-dependent xylose reductase from the xylose-fermenting yeast Pichia stipitis". The Biochemical Journal. ج. 226 ع. 3: 669–77. DOI:10.1042/bj2260669. PMID:3921014.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Nelson, David R.؛ Lehninger, Albert L؛ Cox, Michael (2005). Lehninger principles of biochemistry. New York: W.H. Freeman. ص. 148. ISBN:0-7167-4339-6. مؤرشف من الأصل في 2020-09-15.
- ^ "Material Safety Data Sheet". JT Baker. مؤرشف من الأصل في 2021-12-11. اطلع عليه بتاريخ 2011-07-31.
| ميركابتويثانول-2 في المشاريع الشقيقة: | |
| |