إسقاط فيشر
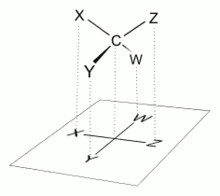
إسقاط فيشر فرضية وضعها هيرمان إميل فيشر سنة 1891 م،[1] وهو تمثيل ثنائي الأبعاد لمركب عضوي ثلاثي الأبعاد عن طريق الإسقاط. افتُرضت إسقاطات فيشر في البداية لتصوير الكربوهيدرات، واستخدمها الكيميائيون خاصة في الكيمياء العضوية والحيوية. أما استخدامها في غير الكربوهيدرات، فكان مُحبطًا حيث كانت رسوماته غامضة، وتتشابه مع غيرهما من الرسوم.[2]
المؤتمرات

كانت الروابط الكيميائية تُمثّل بخطوط أفقية ورأسية. وكانت سلاسل الكربون تُرسم رأسيًا ويتوسطها ذرات الكربون في المنتصف. وتبدأ غالبًا بذرة كربون C1 في أعلاها.[3] في السكر الألدهيدي، تبدأ مجموعة الألدهيد C1؛ وفي السكر الكيتوني يشغل الكربون في مجموعة الكيتون أقل عدد كربوني ممكن (عادة C2).[4]

استُخدم إسقاط فيشر للتمييز بين نماذج ل- و د-. في إسقاط فيشر، يتصل كربون سكريات-د بهيدروجين على اليسار وهيدروكسيل على اليمين. بينما يرتبط الكربون في سكريات-ل بهيدروجين على اليمين وهيدروكسيل على اليسار.[5] وفي إسقاط فيشر، كل الروابط الأفقية تظهر في جهة الرائي، بينما الروابط الرأسية تظهر بعيدة عن الرائي. لذا، لا يمكن تدوير إسقاط فيشر 90° أو 270° على مستوى الورقة، لأن اتجاه الروابط مع بعضها قد يتغير، فيتحوّل الجزئ إلى مصاوغه المرآتي. بينما، أي استدارة بزاوية 180° لا تغير من تمثيل الجزئ. وعند مبادلة زوجين من المجموعات المرافقة لذرة الكربون المركزية، فستظل تمثل نفس الجزيء كما كان يمثله إسقاط فيشر الأصلي.
ووفقًا لقواعد الاتحاد الدولي للكيمياء البحتة والتطبيقية، تُفضّل كل ذرات الكربون أن تتعادل، خاصة ذرات الهيدروجين للمجموعة الأخيرة للكربوهيدرات.[2] وفي هذا الخصوص، تختلف الصيغ الهيكلية لإسقاط فيشر.
الاستخدام
يكثر استخدام إسقاط فيشر في الكيمياء الحيوية والعضوية لتمثيل السكيات الأحادية، كما يمكن استخدامه للأحماض الأمينية أو غيرها من الجزيئات العضوية. ونظرًا لكون إسقاطات فيشر تصوّر البنية الفراغية (ثلاثية الأبعاد) للجزيء، بالتالي فهي مفيدة جدًا للتمييز بين الجزيئات غير المتناظرة.
أنظمة أخرى
ترتبط إسقاطات هوارث بالإشارات الكيميائية المستخدمة لتمثيل السكريات في صيغة حلقية. والمجموعات الواقعة على يمين إسقاط فيشر تُعادل تلك الواقعة أسفل المُسطح الحلقي في إسقاطات هوارث.[6] ولا يجب الخلط بين إسقاطات فيشر وتراكيب لويس التي لا تحتوي على أي معلومات حول البنية الجزيئية ثلاثية الأبعاد. أما إسقاط نيومان فيُستخدم لتمثيل البنية الفراغية للألكانات.
انظر أيضًا
المراجع
- ^ John McMurry (2008). Organic Chemistry (ط. 7th). Brooks/Cole - Thomson Learning, Inc. ص. 975. ISBN:0-13-286261-1.
- ^ أ ب Graphical representation of stereochemical configuration (IUPAC Recommendations 2006), p.1933-1934 نسخة محفوظة 14 أغسطس 2017 على موقع واي باك مشين.
- ^ Understanding Fischer Projection and Angular Line Representation Conversion Luis F. Moreno Journal of Chemical Education 2012 89 (1), 175-176 دُوِي:10.1021/ed101011c
- ^ "Rules of Carbohydrate Nomenclature". The Journal of Organic Chemistry. American Chemical Society. ج. 28 ع. 2: 281–291. فبراير 1963. DOI:10.1021/jo01037a001. مؤرشف من الأصل في 2019-12-10.
- ^ "Sugars & Polysaccharides". Rensselaer Polytechnic Institute (RPI). مؤرشف من الأصل في 2017-07-05. اطلع عليه بتاريخ 2011-07-10.
- ^ Matthews, C. E.; K. E. Van Holde; K. G. Ahern (1999) Biochemistry. 3rd edition. Benjamin Cummings. ISBN 0-8053-3066-6
| في كومنز صور وملفات عن: إسقاط فيشر |
