تترالين: الفرق بين النسختين
هيدروكربونات ثنائية الحلقة |
(لا فرق)
|
نسخة 09:27، 19 مارس 2017
| تترالين | |
|---|---|
| الاسم النظامي (IUPAC) | |
1,2,3,4-tetrahydronaphthalene |
|
| أسماء أخرى | |
Tetralin |
|
| المعرفات | |
| رقم CAS | 119-64-2 |
| بوب كيم (PubChem) | 8404 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C10H12 |
| الكتلة المولية | 132.21 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.97 غ/سم3 |
| نقطة الانصهار | −35.8 °س |
| نقطة الغليان | 208 °س |
| الذوبانية في الماء | غير منحل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
تترالين هو مركب كيميائي من الهيدروكربونات ثنائية الحلقة له الصيغة الكيميائية C10H12، ويكون على شكل سائل عديم اللون.
يتألغ المركب بنيوياً من اندماج حلقتين سداسيتين، إحداها عطرية والأخرة غير عطرية، بشكل يشبه النفثالين، ولذلك يسمى المركب أيضاً رباعي هيدرو النفثالين.
التحضير
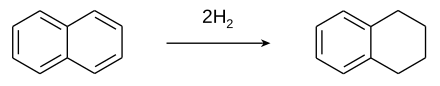
يحضر التترالين من تفاعل الهدرجة الجزئية للنفثالين بوجود حفاز من البلاتين:[3]
تعتمد نواتج التفاعل على الشروط التقنية للعملية؛ إذ وجد أن مردود تفاعل هدرجة النفثالين عند ضغوط تتراوح بين 60–70 جو يعتمد على نشاط وفعالية الحفازات، ويبلغ الحد الأعظمي عند استخدام مزيج حفازات من أكسيد الألومنيوم Al2O3 وأكسيد الكالسيوم CoO وثلاثي أكسيد الموليبدنوم MoO3 أو مزيج من حفازات من ثنائي كبيريتيد التنغستن WS2 وكبريتيد النيكل NiS وأكسيد الألومنيوم Al2O3 عند درجات حرارة تتروح بين 300 و 370 °س.[4]
يمكن اصطناع المركب مخبرياً وفق تفاعل تحلق بيرغمان، أو من خلال تفاعل اصطناع ينسب إلى الكيميائي جورج دارزين Georges Darzens سنة 1926 حيث يمكن تحضير مشتقات من التترالين بواسطة تفاعل استبدال عطري محب للإلكترونات داخل الجزيء لمركب 1-أريل-4-البنتين باستخدام حمض الكبريتيك المركز.[5]

الخواص
يوجد التترالين في الشروط القياسية على شكل سائل عديم اللون، له رائحة تشبه النفثالين. للمركب قرينة انكسار مرتفعة نسبياً مقدارها 1.5414، وهو عملياً عديم الانحلال في الماء، لكنه ينحل في المذيبات العضوية.
يتأكسد التترالين ليشكل البيروكسيد الموافق، لذلك ينبغي الحذر عند تقطير عينات متقادمة منه، إذ يمكن أن يترافق ذلك بمزائج انفجارية.
الاستخدامات
يستخدم التترالين كمذيب عضوي في العمليات الكيميائية مثل صناعة المطاط الصناعي (الكاوتشوك)،[3] وفي التطبيقات المخبرية.
كما يستخدك في تحضير مركبات عضوية قريبة مثل 1-نفثول.
المراجع
- ^ أ ب ت 1,2,3,4-Tetrahydronaphthalene (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ أ ب Brockhaus ABC Chemie, F.A. Brockhaus Verlag Leipzig 1971, S. 1390.
- ^ Krichko، A. A.؛ Skvortsov، D. V.؛ Titova، T. A.؛ Filippov، B. S.؛ Dogadkina، N. E. (1969). "Production of tetralin by the hydrogenation of naphthalene-containing fractions". Chemistry and Technology of Fuels and Oils. ج. 5: 18. DOI:10.1007/BF00727949.
- ^ Michael B. Smith (2011). Organic Synthesis (ط. third). Academic Press. ص. 1209–1210. ISBN:9780124158849.