دينامين: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
Mn-imhotep (نقاش | مساهمات) أُنشئَت بترجمة الصفحة "Dynamin" |
Mn-imhotep (نقاش | مساهمات) أُنشئَت بترجمة الصفحة "Dynamin" |
||
| سطر 6: | سطر 6: | ||
[[ملف:Dynamin_assembles_into_spirals.jpg|بديل=|يمين|تصغير| تجميع الدينامين في بوليمرات حلزونية كما يصورها الفحص المجهري الإلكتروني السلبي. <ref>{{استشهاد بدورية محكمة|title=Dynamin self-assembles into rings suggesting a mechanism for coated vesicle budding|journal=Nature|volume=374|issue=6518|pages=190–192|date=March 1995|PMID=7877694|DOI=10.1038/374190a0|bibcode=1995Natur.374..190H}}</ref>]] |
[[ملف:Dynamin_assembles_into_spirals.jpg|بديل=|يمين|تصغير| تجميع الدينامين في بوليمرات حلزونية كما يصورها الفحص المجهري الإلكتروني السلبي. <ref>{{استشهاد بدورية محكمة|title=Dynamin self-assembles into rings suggesting a mechanism for coated vesicle budding|journal=Nature|volume=374|issue=6518|pages=190–192|date=March 1995|PMID=7877694|DOI=10.1038/374190a0|bibcode=1995Natur.374..190H}}</ref>]] |
||
الدينامين نفسه عبارة عن [[إنزيم]] 96 [[وحدة كتل ذرية|كيلو دالتون]] ، وقد تم عزله لأول مرة عندما كان الباحثون يحاولون عزل محركات جديدة تعتمد على [[أنيبيب دقيق|الأنابيب الدقيقة]] من دماغ البقر. تمت دراسة الدينامين على نطاق واسع في سياق تبرعم حويصلة مغلفة [[كلاثرين|بالكلاذرين]] من [[غشاء خلوي|غشاء الخلية]] . <ref name="Urrutia">{{استشهاد بدورية محكمة|title=The dynamins: redundant or distinct functions for an expanding family of related GTPases?|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=94|issue=2|pages=377–384|date=January 1997|PMID=9012790|PMCID=34135|DOI=10.1073/pnas.94.2.377|bibcode=1997PNAS...94..377U}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFUrrutiaHenleyCookMcNiven1997">Urrutia R, Henley JR, Cook T, McNiven MA (January 1997). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC34135 "The dynamins: redundant or distinct functions for an expanding family of related GTPases?"]. ''Proceedings of the National Academy of Sciences of the United States of America''. '''94''' (2): 377–384. [[بيب كود|Bibcode]]:[https://ui.adsabs.harvard.edu/abs/1997PNAS...94..377U 1997PNAS...94..377U]. [[معرف الغرض الرقمي|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1073/pnas.94.2.377|10.1073/pnas.94.2.377]]</span>. [[ببمد سنترال|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC34135 34135]</span>. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/9012790 9012790].</cite></ref> <ref name="McMahon">{{استشهاد بدورية محكمة|title=The dynamin superfamily: universal membrane tubulation and fission molecules?|journal=Nature Reviews. Molecular Cell Biology|volume=5|issue=2|pages=133–147|date=February 2004|PMID=15040446|DOI=10.1038/nrm1313}}</ref> بدءًا من [[نهاية أمينية|الطرف N]] ، يتكون الدينامين من مجال جي تي باز GTPase متصل بمجال ساق حلزوني عبر منطقة عنق مرنة تحتوي على عنصر إشارة الحزمة ومجال جي تي باز إفيكتور . في الطرف المقابل من مجال القصبة توجد حلقة مرتبطة بمجال متماثل بليكسترين المرتبط بالغشاء. ثم يعود حبلا البروتين مرة أخرى نحو مجال جي تي باز وينتهي بمجال برولين ريتش الذي يرتبط بمجالات Src Homology للعديد من البروتينات. |
الدينامين نفسه عبارة عن [[إنزيم]] 96 [[وحدة كتل ذرية|كيلو دالتون]] ، وقد تم عزله لأول مرة عندما كان الباحثون يحاولون عزل محركات جديدة تعتمد على [[أنيبيب دقيق|الأنابيب الدقيقة]] من دماغ البقر. تمت دراسة الدينامين على نطاق واسع في سياق تبرعم حويصلة مغلفة [[كلاثرين|بالكلاذرين]] من [[غشاء خلوي|غشاء الخلية]] . <ref name="Urrutia">{{استشهاد بدورية محكمة|title=The dynamins: redundant or distinct functions for an expanding family of related GTPases?|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=94|issue=2|pages=377–384|date=January 1997|PMID=9012790|PMCID=34135|DOI=10.1073/pnas.94.2.377|bibcode=1997PNAS...94..377U}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFUrrutiaHenleyCookMcNiven1997">Urrutia R, Henley JR, Cook T, McNiven MA (January 1997). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC34135 "The dynamins: redundant or distinct functions for an expanding family of related GTPases?"]. ''Proceedings of the National Academy of Sciences of the United States of America''. '''94''' (2): 377–384. [[بيب كود|Bibcode]]:[https://ui.adsabs.harvard.edu/abs/1997PNAS...94..377U 1997PNAS...94..377U]. [[معرف الغرض الرقمي|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1073/pnas.94.2.377|10.1073/pnas.94.2.377]]</span>. [[ببمد سنترال|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC34135 34135]</span>. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/9012790 9012790].</cite></ref> <ref name="McMahon">{{استشهاد بدورية محكمة|title=The dynamin superfamily: universal membrane tubulation and fission molecules?|journal=Nature Reviews. Molecular Cell Biology|volume=5|issue=2|pages=133–147|date=February 2004|PMID=15040446|DOI=10.1038/nrm1313}}</ref> بدءًا من [[نهاية أمينية|الطرف N]] ، يتكون الدينامين من مجال جي تي باز GTPase متصل بمجال ساق حلزوني عبر منطقة عنق مرنة تحتوي على عنصر إشارة الحزمة ومجال جي تي باز إفيكتور . في الطرف المقابل من مجال القصبة توجد حلقة مرتبطة بمجال متماثل بليكسترين المرتبط بالغشاء. ثم يعود حبلا البروتين مرة أخرى نحو مجال جي تي باز وينتهي بمجال برولين ريتش الذي يرتبط بمجالات Src Homology للعديد من البروتينات. |
||
== الوظيفة == |
|||
أثناء الالتقام الخلوي بوساطة الكلاثرين ، يغزو غشاء الخلية لتشكيل حويصلة في مهدها. يرتبط الدينامين ويتجمع حول عنق الحويصلة الداخلية ، مكونًا بوليمر حلزوني مرتب بحيث تتضاءل نطاقات جي تي باز بطريقة غير متماثلة عبر الدرجات الحلزونية. <ref>{{استشهاد بدورية محكمة|title=A dynamin mutant defines a superconstricted prefission state|journal=Cell Reports|volume=8|issue=3|pages=734–742|date=August 2014|PMID=25088425|PMCID=4142656|DOI=10.1016/j.celrep.2014.06.054}}</ref> <ref name=":0" /> يقيد البوليمر الغشاء الأساسي عند [[بروتين الGTPase|ربط GTP والتحلل المائي]] من خلال التغييرات التوافقية المنبثقة من منطقة الرقبة المرنة التي تغير التناظر الحلزوني الكلي. <ref name=":0">{{استشهاد بدورية محكمة|displayauthors=6|title=Cryo-EM of the dynamin polymer assembled on lipid membrane|journal=Nature|volume=560|issue=7717|pages=258–262|date=August 2018|PMID=30069048|PMCID=6121775|DOI=10.1038/s41586-018-0378-6|bibcode=2018Natur.560..258K}}</ref> يؤدي الانقباض حول عنق الحويصلة إلى تكوين حالة غشاء انشطار نصفي تؤدي في النهاية إلى انشقاق الغشاء. <ref name="Hinshaw">Hinshaw, J. [http://www2.niddk.nih.gov/NIDDKLabs/IntramuralFaculty/HinshawJenny.htm "Research statement, Jenny E. Hinshaw, Ph.D."] National Institute of Diabetes & Digestive & Kidney Diseases, Laboratory of Cell Biochemistry and Biology. Accessed 19 March 2013.</ref> <ref name="McMahon">{{استشهاد بدورية محكمة|title=The dynamin superfamily: universal membrane tubulation and fission molecules?|journal=Nature Reviews. Molecular Cell Biology|volume=5|issue=2|pages=133–147|date=February 2004|PMID=15040446|DOI=10.1038/nrm1313}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFPraefckeMcMahon2004">Praefcke GJ, McMahon HT (February 2004). "The dynamin superfamily: universal membrane tubulation and fission molecules?". ''Nature Reviews. Molecular Cell Biology''. '''5''' (2): 133–147. [[معرف الغرض الرقمي|doi]]:[[doi:10.1038/nrm1313|10.1038/nrm1313]]. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/15040446 15040446]. [[سيمانتك سكولر|S2CID]] [https://api.semanticscholar.org/CorpusID:6305282 6305282].</cite></ref> <ref>{{استشهاد بدورية محكمة|displayauthors=6|title=A hemi-fission intermediate links two mechanistically distinct stages of membrane fission|journal=Nature|volume=524|issue=7563|pages=109–113|date=August 2015|PMID=26123023|PMCID=4529379|DOI=10.1038/nature14509|bibcode=2015Natur.524..109M}}</ref> قد يكون التقلص جزئيًا نتيجة نشاط التواء للدينامين ، مما يجعل الدينامين هو [[محركات جزيئية|المحرك الجزيئي]] الوحيد المعروف بنشاط التواء. <ref name="Roux">{{استشهاد بدورية محكمة|title=GTP-dependent twisting of dynamin implicates constriction and tension in membrane fission|journal=Nature|volume=441|issue=7092|pages=528–531|date=May 2006|PMID=16648839|DOI=10.1038/nature04718|bibcode=2006Natur.441..528R}}</ref> |
|||
[[تصنيف:عمليات خلوية]] |
[[تصنيف:عمليات خلوية]] |
||
[[تصنيف:صفحات بترجمات غير مراجعة]] |
[[تصنيف:صفحات بترجمات غير مراجعة]] |
||
نسخة 05:43، 19 أغسطس 2023
| Dynamin family | |
|---|---|

| |
| Structure of the nucleotide-free myosin II motor domain from Dictyostelium discoideum fused to the GTPase domain of dynamin I from Rattus norvegicus | |
| معرف | |
| رمز | Dynamin_N |
| قاعدة بيانات عوائل البروتينات | PF00350 |
| قاعدة بيانات عوائل البروتينات clan | CL0023 |
| إنتربرو | IPR001401 |
| بروسايت | PDOC00362 |
| Dynamin central region | |
|---|---|

| |
| Structure of the nucleotide-free myosin II motor domain from Dictyostelium discoideum fused to the GTPase domain of dynamin I from Rattus norvegicus | |
| معرف | |
| رمز | Dynamin_M |
| قاعدة بيانات عوائل البروتينات | PF01031 |
| إنتربرو | IPR000375 |
دينامين Dynamin هو GTPase المسؤول عن الالتقام في الخلية حقيقية النواة. الدينامين هو جزء من " عائلة الدينامين الفائقة " ، والتي تشمل الدينامينات الكلاسيكية ، والبروتينات الشبيهة بالدينامين ، وبروتينات Mx ، و OPA1 ، والميتوفوسين ، وGBPs . يشارك أعضاء عائلة الدينامين بشكل أساسي في قطع الحويصلات المتكونة حديثًا من غشاء حجرة خلوية واحدة واستهدافهم واندماجهم مع حجرة أخرى ، سواء على سطح الخلية (خاصة استيعاب الكهوف ) وكذلك في جولجي جهاز . [1] [2] [3] يلعب أفراد عائلة الدينامين أيضًا دورًا في العديد من العمليات بما في ذلك تقسيم العضيات ، [4] والتحرك الخلوي ومقاومة مسببات الأمراض الميكروبية.
البنية
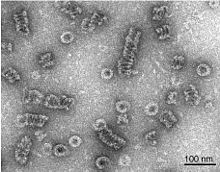
الدينامين نفسه عبارة عن إنزيم 96 كيلو دالتون ، وقد تم عزله لأول مرة عندما كان الباحثون يحاولون عزل محركات جديدة تعتمد على الأنابيب الدقيقة من دماغ البقر. تمت دراسة الدينامين على نطاق واسع في سياق تبرعم حويصلة مغلفة بالكلاذرين من غشاء الخلية . [3] [6] بدءًا من الطرف N ، يتكون الدينامين من مجال جي تي باز GTPase متصل بمجال ساق حلزوني عبر منطقة عنق مرنة تحتوي على عنصر إشارة الحزمة ومجال جي تي باز إفيكتور . في الطرف المقابل من مجال القصبة توجد حلقة مرتبطة بمجال متماثل بليكسترين المرتبط بالغشاء. ثم يعود حبلا البروتين مرة أخرى نحو مجال جي تي باز وينتهي بمجال برولين ريتش الذي يرتبط بمجالات Src Homology للعديد من البروتينات.
الوظيفة
أثناء الالتقام الخلوي بوساطة الكلاثرين ، يغزو غشاء الخلية لتشكيل حويصلة في مهدها. يرتبط الدينامين ويتجمع حول عنق الحويصلة الداخلية ، مكونًا بوليمر حلزوني مرتب بحيث تتضاءل نطاقات جي تي باز بطريقة غير متماثلة عبر الدرجات الحلزونية. [7] [8] يقيد البوليمر الغشاء الأساسي عند ربط GTP والتحلل المائي من خلال التغييرات التوافقية المنبثقة من منطقة الرقبة المرنة التي تغير التناظر الحلزوني الكلي. [8] يؤدي الانقباض حول عنق الحويصلة إلى تكوين حالة غشاء انشطار نصفي تؤدي في النهاية إلى انشقاق الغشاء. [2] [6] [9] قد يكون التقلص جزئيًا نتيجة نشاط التواء للدينامين ، مما يجعل الدينامين هو المحرك الجزيئي الوحيد المعروف بنشاط التواء. [10]
- ^ Henley، John R.؛ Cao، Hong؛ McNiven، Mark A. (16 ديسمبر 1999). "Participation of dynamin in the biogenesis of cytoplasmic vesicles". The FASEB Journal. ج. 13 ع. 9002: S243-7. DOI:10.1096/fasebj.13.9002.S243. PMID:10619136.
- ^ أ ب Hinshaw, J. "Research statement, Jenny E. Hinshaw, Ph.D." National Institute of Diabetes & Digestive & Kidney Diseases, Laboratory of Cell Biochemistry and Biology. Accessed 19 March 2013.
- ^ أ ب "The dynamins: redundant or distinct functions for an expanding family of related GTPases?". Proceedings of the National Academy of Sciences of the United States of America. ج. 94 ع. 2: 377–384. يناير 1997. Bibcode:1997PNAS...94..377U. DOI:10.1073/pnas.94.2.377. PMID:9012790.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) وسم<ref>غير صالح؛ الاسم "Urrutia" معرف أكثر من مرة بمحتويات مختلفة. - ^ "Dynamin-related proteins and Pex11 proteins in peroxisome division and proliferation". The FEBS Journal. ج. 272 ع. 20: 5169–5181. أكتوبر 2005. DOI:10.1111/j.1742-4658.2005.04939.x. PMID:16218949.
- ^ "Dynamin self-assembles into rings suggesting a mechanism for coated vesicle budding". Nature. ج. 374 ع. 6518: 190–192. مارس 1995. Bibcode:1995Natur.374..190H. DOI:10.1038/374190a0. PMID:7877694.
- ^ أ ب "The dynamin superfamily: universal membrane tubulation and fission molecules?". Nature Reviews. Molecular Cell Biology. ج. 5 ع. 2: 133–147. فبراير 2004. DOI:10.1038/nrm1313. PMID:15040446. وسم
<ref>غير صالح؛ الاسم "McMahon" معرف أكثر من مرة بمحتويات مختلفة. - ^ "A dynamin mutant defines a superconstricted prefission state". Cell Reports. ج. 8 ع. 3: 734–742. أغسطس 2014. DOI:10.1016/j.celrep.2014.06.054. PMID:25088425.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب "Cryo-EM of the dynamin polymer assembled on lipid membrane". Nature. ج. 560 ع. 7717: 258–262. أغسطس 2018. Bibcode:2018Natur.560..258K. DOI:10.1038/s41586-018-0378-6. PMID:30069048.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) والوسيط غير المعروف|displayauthors=تم تجاهله يقترح استخدام|إظهار المؤلفين=(مساعدة) - ^ "A hemi-fission intermediate links two mechanistically distinct stages of membrane fission". Nature. ج. 524 ع. 7563: 109–113. أغسطس 2015. Bibcode:2015Natur.524..109M. DOI:10.1038/nature14509. PMID:26123023.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) والوسيط غير المعروف|displayauthors=تم تجاهله يقترح استخدام|إظهار المؤلفين=(مساعدة) - ^ "GTP-dependent twisting of dynamin implicates constriction and tension in membrane fission". Nature. ج. 441 ع. 7092: 528–531. مايو 2006. Bibcode:2006Natur.441..528R. DOI:10.1038/nature04718. PMID:16648839.
