زرنيخات
| زرنيخات | |
|---|---|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل |
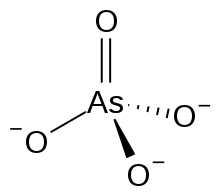
الزرنيخات (Arsenate) هي أيونات حاوية على الزرنيخ لها الصيغة AsO43−، وهي أملاح حمض الزرنيخيك. يكون للزرنيخ حالة أكسدة مقدارها +5 في المركبات الحاوية على هذا الأيون.
الخواص
[عدل]- تشبه الزرنيخات الفوسفات في كثير من الخصائص، وذلك لكون الزرنيخ والفوسفور ينتميان لنفس المجموعة في الجدول الدوري. فعلى سبيل المثال توجد هنالك سلسلة من الزرنيخات الممكنة وهي الأساسية (MH2AsO4)، والثانوية (M2HAsO4) والثالثية (M3AsO4)؛ ترمز M هنا للفلز.
- للزرنيخات بنية رباعية الوجوه تكون فيها المسافة As-O زرنيخ-أكسجين 174 بيكومتر. [1]
- تعد الزرنيخات من المواد مؤكسدات متوسطة المقدرة، حيث أن كمون الاختزال لها يبلغ +0.56 فولت، حيث تتحول إلى الزرنيخيت الموافق.
الوفرة الطبيعية
[عدل]تدخل الزرنيخات في بنية العديد من المعادن، والتي يمكن أن تكون مترافقة مع الماء (هيدرات) أو خالية منها. على العكس من معادن الفوسفات الأولية، فإن معادن الزرنيخات عبارة عن معادن ثانوية، أي أنها تنشأ من عمليات التجوية. [2]
الزرنيخات والبكتريا
[عدل]أظهر فريق بحث أن بعض أنواع البكتريا، والتي تعيش في الينابيع الساخنة القلوية في بحيرة مونو Mono Lake في كاليفورنيا، تقوم باستهلاك الزرنيخيت (3-AsO3) بدلا من الماء في عملية التركيب الضوئي وتحوله إلى الزرنيخات (3-AsO4) كبديل عن غاز ثنائي أكسيد الكربون.[3] وجد العلماء في المختبر أن البكتريا تقوم باستخدام الزرنيخيت كمانح للإلكترونات Electron donor اللازمة لحدوث عملية التركيب الضوئي من خلال تفاعل أكسدة-اختزال.
أمثلة
[عدل]- مركبات
- زرنيخات الكالسيوم Ca3(AsO4)2
- زرنيخات البوتاسيوم KH2AsO4
- معادن
أمثلة على المعادن الحاوية على الزرنيخات في بنيتها:
طالع أيضاً
[عدل]المراجع
[عدل]- ^ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 845.
- ^ موسوعة المعادن (بالألمانية) نسخة محفوظة 15 يوليو 2017 على موقع واي باك مشين.
- ^ Arsenic-loving bacteria rewrite photosynthesis rules, Chemistry World, 15 August 2008 نسخة محفوظة 17 يونيو 2016 على موقع واي باك مشين.
