كارفيلزوميب
هذه مقالة غير مراجعة. (مايو 2020) |
| كارفيلزوميب | |
|---|---|
| الاسم النظامي | |
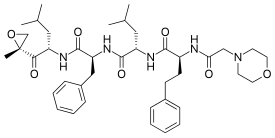
| (2S)-4-Methyl-N-[(2S)-1-[[(2S)-4-methyl-1-[(2R)-2-methyloxiran-2-yl]-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]-4-phenylbutanoyl]amino]pentanamide | |
| اعتبارات علاجية | |
| اسم تجاري | Kyprolis |
| مرادفات | PX-171-007 |
| الوضع القانوني | وكالة الأدوية الأوروبية:وصلة، إدارة الغذاء والدواء:وصلة |
| فئة السلامة أثناء الحمل | C (أستراليا) D (الولايات المتحدة) |
| طرق إعطاء الدواء | Intravenous |
| بيانات دوائية | |
| ربط بروتيني | 97%[1] |
| استقلاب (أيض) الدواء | Extensive; CYP plays a minor role |
| معرّفات | |
| CAS | 868540-17-4 |
| ك ع ت | L01L01XX45 XX45 |
| بوب كيم | CID 11556711 |
| IUPHAR | 7420 |
| ECHA InfoCard ID | 100.219.957 |
| درغ بنك | 08889 |
| كيم سبايدر | 9731489 |
| المكون الفريد | 72X6E3J5AR |
| كيوتو | D08880 |
| ChEBI | CHEBI:65347 |
| ChEMBL | CHEMBL451887 |
| ترادف | PX-171-007 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C40H57N5O7 |
| الكتلة الجزيئية | 719.91 g/mol |
| تعديل مصدري - تعديل | |
Carfilzomib
(تم تسويقه تحت الاسم التجاري Kyprolis ، الذي طورته Onyx Pharmaceuticals) هو دواء مضاد للسرطان يعمل كمثبط انتقائي انتقائي. كيميائيا، هوإيبوكسيكيتون رباعي الببتيد ونظير من الإيبوكسيومين.
وافقت إدارة الغذاء والدواء الأمريكية (FDA) في 20 يوليو 2012 على استخدامها في المرضى الذين يعانون من الورم النقوي المتعدد الذين تلقوا علاجين سابقين على الأقل، بما في ذلك العلاج باستخدام بورتيزوميب والعلاج المناعي (مثل ليناليدوميد) وقد أظهروا تطور المرض في أو في غضون 60 يوما من الانتهاء من العلاج الأخير. استندت الموافقة المبدئية على معدل الاستجابة. أظهرت البيانات التي أظهرت فائدة البقاء على قيد الحياة (OS) لاحقًا في تجربة ENDEAVOR وتمت الموافقة عليها منقِبل إدارة الأغذية والعقاقير.
الاختصار CFZ شائع للإشارة إلى carfilzomib ، ولكن اختصار أسماء الأدوية ليس أفضل ممارسة في الطب.
التاريخ[عدل]
Carfilzomib مشتق من epoxomicin, المنتجات الطبيعية التي كانت تظهر من قبل المختبر من كريغ فرق في جامعة ييل أن تمنع proteasome و.[2] طواقم المختبر وبعد ذلك اخترع أكثر تحديدا مشتق من epoxomicin اسمه YU101,[3] الذي كان له Proteolix, Inc. العلماء في Proteolix اخترع جديدة متميزة المركب الذي كان إمكانات استخدام المخدرات في البشر، المعروفة باسم carfilzomib. Proteolix المتقدمة carfilzomib متعددة المرحلة 1 و 2 التجارب السريرية ، بما في ذلك المحوري المرحلة 2 سريرية تهدف إلى التماس الموافقة السريعة.[4] التجارب السريرية على carfilzomib تزال تحت الجزع الأدوية التي حصلت Proteolix في عام 2009.
في يناير 2011 ، منحت إدارة الغذاء والدواء الأمريكية حالة كارفيلزوميب للتتبع السريع، مما سمح لشركة Onyx ببدء تقديم متداول لتطبيقها الجديد من الأدوية لكرفيلزوميب. في ديسمبر 2011 ، منحت إدارة الأغذية والأدوية FDA تعيين مراجعة Onyx المعيارية، لتقديمها الجديد لتطبيق الدواء استنادًا إلى دراسة 003-A1 ، تجربة مفتوحة المرحلة 2 ب ذراع واحدة. قيمت التجربة 266 مريضاً عولجوا بشدة مع الورم النقوي المتعدد الانتكاس والحراري الذين تلقوا علاجين سابقين على الأقل، بما في ذلك بورتيزوميب وإما ثاليدومايد أو ليناليدوميد. يكلف حوالي 10000 دولار لكل دورة لمدة 28 يومًا
الآلية[عدل]
Carfilzomib يرتبط تساهميًا بشكل لا رجعة فيه ويثبط النشاط الشبيه ب chymotrypsin من البروتوسوم 20S ، وهو إنزيم يحلل البروتينات الخلوية غير المرغوب فيها. يعرض Carfilzomib الحد الأدنى من التفاعلات مع الأهداف غير البروتوزومية، وبالتالي تحسين ملامح السلامة على بورتيزوميب. يؤدي تثبيط التحلل البروتيني بوساطة البروتياز إلى تكوين بروتينات متعددة البويضات، والتي قد تسبب توقف دورة الخلية واستماتة الخلايا وتثبيط نمو الورم
التجارب السريرية والآثار الجانبية[عدل]
منجز[عدل]
أظهرت تجربة المرحلة الثانية ذات الذراع الواحدة (003-A1) من كارفيلزوميب في المرضى الذين يعانون من كارفيلزوميب واحد الانتكاس والحراري معدل فائدة سريرية بنسبة 36 ٪ في 266 مريضًا تم تقييمها وكان معدل الاستجابة الإجمالي 22.9 ٪ ومدة الوسط استجابة 7.8 أشهر. اعتمدت الموافقة على carfilzomib على نتائج تجربة 003-A1
في تجربة المرحلة الثانية (004) ، كان لدى carfilzomib معدل استجابة إجمالي بنسبة 53 ٪ بين المرضى الذين يعانون من الورم النقوي المتعدد الانتكاس و / أو الحرون الذين لم يتلقوا من قبل بورتيزوميب. تضمنت هذه الدراسة أيضا مجموعة علاجية بورتيزوميب. تم الإبلاغ عن النتائج بشكل منفصل. وجدت هذه الدراسة أيضًا أن علاج carfilzomib لفترات طويلة كان مقبولًا، حيث استمر حوالي 22 ٪ من المرضى في العلاج بعد عام واحد. كانت تجربة 004 عبارة عن دراسة أصغر تم تصميمها في الأصل للتحقيق في تأثير علاج كارفيلزوميب فيما يتعلق بعلاج بورتيزوميب في المرضى الأقل معالجة (1-3 أنظمة سابقة).
تجربة المرحلة Il (005) ، التي قيمت السلامة والحركية الدوائية والديناميكيات الدوائية وفعالية carfilzomib ، في المرضى الذين يعانون من الورم النقوي المتعدد ودرجات متفاوتة من النقص الكلوي، حيث كان ما يقرب من 50 ٪ من المرضى صامدين لكل من بورتيزوميب وليناليدوميد، أظهروا أن الحرائك الدوائية والسلامة لم تتأثر بدرجة القصور الكلوي الأساسي. كان Carfilzomib مقبولاً وأثبت فعاليته.
في تجربة طور Il أخرى (006) للمرضى الذين يعانون من الورم النقوي المتعدد الانتكاس و / أو الحران، أظهر carfilzomib بالاشتراك مع lenalidomide و dexamethasone معدل استجابة إجمالي قدره 69٪
تجربة المرحلة الثانية (007) لأورام المايلوما المتعددة والأورام الصلبة أظهرت نتائج واعدة
في تجارب المرحلة الثانية من carfilzomib ، كانت الأحداث السلبية الأكثر شيوعًا للعلاج من الدرجة 3 أو أعلى هي قلة الصفيحات الدموية السمية، وفقر الدم، وقلة اللمفاويات، وقلة العدلات، والالتهاب الرئوي، والتعب ونقص صوديوم الدم.
في دراسة الخط الأمامي للمرحلة الأولى / الثانية، كان مزيج carfilzomib و lenalidomide وجرعة منخفضة من dexamethasone نشطًا للغاية ومقبولًا بشكل جيد، مما أدى إلى تقويض استخدام الجرعات الكاملة لفترة طويلة في مرضى المايلوما المتعددة المشخصين حديثًا، مع حاجة محدودة للجرعة تعديل. كانت الاستجابات سريعة ومُحسّنة بمرور الوقت، ووصلت إلى استجابة جزئية جيدة جدًا بنسبة 100٪.
علاوة على ذلك، فإن اضطرابات الجهاز الهضمي، بما في ذلك الإسهال والغثيان هي مجموعة من الآثار الجانبية غير الدموية التي يتم الإبلاغ عنها بشكل شائع مع مثبطات البروتياز. بالإضافة إلى ذلك، قد تكون سمية القلب والأوعية الدموية نتيجة لعلاج Carfilzomib بسبب الآثار على البروتوزومات في عضلة القلب .وبالتالي، فإن تقييم المريض وتقييم المخاطر قبل بدء العلاج باستخدام carfilzomib أمر بالغ الأهمية.
تجربة ASPIRE[عدل]
المرحلة الثالثة تأكيدية التجارب السريرية، والمعروفة باسم تطمح المحاكمة، مقارنة carfilzomib ، يناليدوميد وديكساميثازون مقابل يناليدوميد وديكساميثازون في المرضى الذين يعانون من انتكس المايلوما المتعددة الجارية.[5] النتائج قدمت في الجمعية الأمريكية لأمراض الدم اجتماع في كانون الأول / ديسمبر 2014. وأشاروا إلى أن كثيرا من المرضى استجابوا ثلاثة الدوائي من ردت على اثنين الدوائي.[6][7] النتائج المؤقتة تطمح المحاكمة وقد نشرت في مجلة نيو انغلاند للطب.[8]
مراجع[عدل]
- ^ "Kyprolis (carfilzomib) for Injection, for Intravenous Use. U.S. Full Prescribing Information" (PDF). Onyx Pharmaceuticals, Inc. مؤرشف من الأصل (PDF) في 2017-08-28.
- ^ "Epoxomicin, a potent and selective proteasome inhibitor, exhibits in vivo antiinflammatory activity". Proceedings of the National Academy of Sciences of the United States of America. ج. 96 ع. 18: 10403–8. أغسطس 1999. Bibcode:1999PNAS...9610403M. DOI:10.1073/pnas.96.18.10403. PMC:17900. PMID:10468620.
- ^ "Lack of proteasome active site allostery as revealed by subunit-specific inhibitors". Molecular Cell. ج. 7 ع. 2: 411–20. فبراير 2001. DOI:10.1016/S1097-2765(01)00188-5. PMID:11239469.
- ^ "Carfilzomib: From Discovery To Drug". Chemical & Engineering News. 27 أغسطس 2012. مؤرشف من الأصل في 2018-09-20. اطلع عليه بتاريخ 2013-07-30.
- ^ "Phase 3 Study Comparing Carfilzomib, Lenalidomide, and Dexamethasone (CRd) Versus Lenalidomide and Dexamethasone (Rd) in Subjects With Relapsed Multiple Myeloma". ClinicalTrials.gov. 4 أغسطس 2011. مؤرشف من الأصل في 2018-09-20. اطلع عليه بتاريخ 2011-09-01.
- ^ Berkrot, Bill (6 ديسمبر 2014). "Addition of Amgen drug boosts benefits in relapsed myeloma: study". Reuters. مؤرشف من الأصل في 2015-09-24. اطلع عليه بتاريخ 2014-12-06.
- ^ "Dr. Stewart Discusses the Efficacy of Carfilzomib in the ASPIRE Trial". onclive. 6 ديسمبر 2014. مؤرشف من الأصل في 2018-09-20.
- ^ "Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma". The New England Journal of Medicine. ج. 372 ع. 2: 142–52. يناير 2015. DOI:10.1056/NEJMoa1411321. PMID:25482145.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة)
| كارفيلزوميب في المشاريع الشقيقة: | |
| |