نيوثراميسين
| نيوثراميسين | |
|---|---|
| صنف دوائي | |
 نيوثراميسين أ و ب | |
| الاستعمال | مضاد للسرطان ومضاد للأوالي |
| تصنيف كيميائي | مجموعة البيرولو (1،4) بنزوديازيبين |
| في ويكي بيانات | |
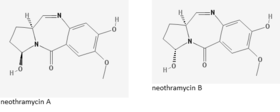
يعتبر النيوثراميسين (الاسم العلمي: Neothramycin) أ و ب من المضادات الحيوية المصاوغة الفراغية ذات النشاط المضاد للسرطان. تكون المصاوغات الفراغية قابلة للتبديل في محلول مائي والمضاد الحيوي نيوثراميسين.[1] وهي تنتمي إلى مجموعة البيرولو (1،4) بنزوديازيبين أو الأنثراميسين والتي تشمل المضادات الحيوية الأخرى مثل أنثراميسين وتومايميسين وسيبيروميسين. عُزِل النيوثراميسين في الأصل من المتسلسلة رقم MC916-C4 وهي سلالة منتجة لسيكلوهكسيميد (بواسطة يوميزاوا وغيره).[1] أظهرت الاختبارات اللاحقة قدراته كدواء مضاد للسرطان وعقار مضاد للأوالي وحتى الاستخدامات الممكنة في فحوصات الحمض النووي التي تعتمد على الوميض الفلوري.[2][3] في عام 1991 حُقِّق في مشتقات الأنثراميسين -والتي تشبه إلى حد كبير النيوثراميسين- لقدرتها على ربط الحمض النووي الريبوزي منقوص الأكسجين عند ازدواجه. اختُبِرَت هذه المركبات باستخدام مقايسة تعتمد على الوميض الفلوري. أظهرت هذه المركبات قدرة على ربط دنا مزدوج بدقة عالية. هذه الخصوصية لعامل الربط المتشابك للحمض النووي مطلوبة بشدة لأن معظمها عبارة عن مركبات كهربائية وترتبط بشكل عشوائي. أظهرت البيانات التي جُمِّعت أيضًا أنه يمكن استخدام البيرولو (1،4) بنزوديازيبينات لقياس تباين الاستقطاب الفلوري على النطاق الزمني 0.1-100 نانوثانية.[2]
النشاط[عدل]
يُظهر النيوثراميسين نشاطًا ضعيفًا مضادًا للميكروبات مقارنةً بالبيرولو (1،4) البنزوديازيبينات الأخرى. كما أنه يُظهر سمية أقل في الفئران. أظهر النيوثراميسين نشاطًا ضد ساركوما يوشيدا في الفئران وسرطان الدم P388 وساركوما 180 وسرطانة الاستسقاء لإيرليخ وساركومة سرطانية لوولكر-256 ونشاط خفيف ضد سرطان الدم L-1210 في الفئران.[4] تعتبر هذه الأنشطة ضد السرطان نموذجية للأنشطة التي لوحظت في مركبات البيرولو الأخرى (1،4) مركبات البنزوديازيبين. اختُبِر نيوثراميسين أيضًا -جنبًا إلى جنب مع مركبات أخرى- ضد الملاريا والنشاط المضاد للأوالي. أظهر نشاطًا معتدلًا تجاه الملاريا بقيمة IC 50 تبلغ حوالي 1 ميكروغرام / مل. أظهر نيوثراميسين أيضًا سمية خلوية عالية تجاه خلايا MRC-5 مع IC 50 من 390 نانوغرام / مل. أظهر بوتيلنيوثراميسين أ -المشتق من النيوثراميسين- نشاطًا أقل لمضادات الأوالي بمقدار 6-7 أضعاف مقارنة بالنيوثراميسين.[5]
الآلية[عدل]
من المعروف على نطاق واسع أن طريقة عمل النيوثراميسين تكون من خلال تثبيط الحمض النووي الريبي المعتمد على الحمض النووي الريبي منزوع الأكسجين وبوليميراز الحمض النووي الريبي منزوع الأكسجين.[6] حُدِّد نشاط المضاد الحيوي للنيوثراميسين على أنه يرتبط مباشرة بالحمض النووي منزوه الأكسجين عن طريق قياسات امتصاص الأشعة فوق البنفسجية مع تركيزات مختلفة من الحمض النووي منزوع الأكسجين والنيوثراميسين.[7] بدأت الدراسات الأولى للنيوثراميسين في افتراض أن الحمض النووي هو المستقبل الكيميائي بسبب تثبيط الحمض النووي الريبوزي المنقوص الأكسجين وبوليميراز الحمض النووي الريبي الذي لوحِظ عند إضافة النيوتراميسين.[1] حُدِّد نشاط المضاد الحيوي -منذ تلك الدراسات الأولى- على أنه ناتج عن ارتباطه المباشر بالحمض النووي الريبوزي منقوص الأكسجين. وبشكل أكثر تحديدًا، فإن النيوتراميسين يربط NH 2 من الجوانين في التلم الصغير. تبين أن هذا الارتباط يحدث فقط عندما يكون الحمض النووي منقوص الأكسجين مزدوج.[2] لوحظ هذا النوع من الارتباط في البيرولو (1،4) بنزوديازيبينات الأخرى أيضًا. ومع ذلك فإن ارتباط النيوتراميسين بالحمض النووي يكون أبطأ بكثير من المركبات الأخرى في المجموعة. هذا الارتباط للنيوثراميسين بالحمض النووي لا يغير بدرجة كبيرة درجة حرارة انصهار الحمض النووي.
الاختبار السريري[عدل]
مر نيوثراميسين بالمرحلة الأولى للاختبار بين يونيو 1979 ويونيو 1981. حُدِّدَ الحد الأقصى للجرعة المسموح بها 60 مجم / م 2 لكل حقنة واحدة. عانى ما يقرب من نصف المرضى من الغثيان والقيء، وتُعد هذه الأعراض هي هي أشد درجات السمية التي لوحظت. كما لوحظت بعض التأثيرات السمية للكبد والكلية ولكنها كانت قابلة للإصلاح. حددت المرحلة الأولى من التجربة السريرية أن 30-40 ملغ / م 2 ستكون الجرعة المثلى للمرحلة الثانية.[3]
المراجع[عدل]
- ^ أ ب ت Mechanism of action of neothramycin I. The effect on macromolecular synthesis نسخة محفوظة 2017-09-07 على موقع واي باك مشين.
- ^ أ ب ت Farmer، JD Jr؛ Gustafson، GR؛ Conti، A؛ Zimmt، MB؛ Suggs، JW (1991). "DNA binding properties of a new class of linked anthramycin analogs". Nucleic Acids Res. ج. 19 ع. 4: 899–903. DOI:10.1093/nar/19.4.899. PMID:1708126.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب Phase I study of a new antitumor antibiotic, neothramycin نسخة محفوظة 23 نوفمبر 2021 على موقع واي باك مشين.
- ^ Antitumor effect of new antibiotic, neothramycin نسخة محفوظة 2017-09-08 على موقع واي باك مشين.
- ^ Otoguro، Kazuhiko؛ Iwatsuki، Masato؛ Ishiyama، Aki؛ Namatame، Miyuki؛ Nishihara-Tukashima، Aki؛ Shibahara، Seiji؛ Kondo، Shinichi؛ Yamada، Haruki؛ Ōmura، Satoshi (2010). "Promising lead compounds for novel antiprotozoans". The Journal of Antibiotics. ج. 63 ع. 7: 381–384. DOI:10.1038/ja.2010.50. PMID:20661239.Otoguro, Kazuhiko; Iwatsuki, Masato; Ishiyama, Aki; Namatame, Miyuki; Nishihara-Tukashima, Aki; Shibahara, Seiji; Kondo, Shinichi; Yamada, Haruki; Ōmura, Satoshi (2010). "Promising lead compounds for novel antiprotozoans". The Journal of Antibiotics. 63 (7): 381–384. doi:10.1038/ja.2010.50. PMID 20661239. S2CID 7508758.
- ^ Otoguro، Kazuhiko؛ Iwatsuki، Masato؛ Ishiyama، Aki؛ Namatame، Miyuki؛ Nishihara-Tukashima، Aki؛ Shibahara، Seiji؛ Kondo، Shinichi؛ Yamada، Haruki؛ Ōmura، Satoshi (2010). "Promising lead compounds for novel antiprotozoans". The Journal of Antibiotics. ج. 63 ع. 7: 381–384. DOI:10.1038/ja.2010.50. PMID:20661239. مؤرشف من الأصل في 2021-11-23.
- ^ Mechanism of action of neothramycin II. Interaction with DNA نسخة محفوظة 2017-09-07 على موقع واي باك مشين.
