عدد كم رئيسي
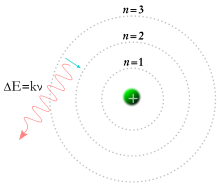
عدد الكم الرئيسي في الفيزياء الذرية والتي غالبا ما تكتب n هي رقم الكم لمدار إلكتروني رئيسي. وهو يمثل بصفة عامة طاقة المدار ومدى بعده عن النواة. وكل منها له طاقة كمومية محددة تسمى مستوى طاقة.[1]
عرفت مستويات الطاقة في الذرة من توزيع خطوط طيفها . فقد درست أطياف العناصر أواخر القرن التاسع عشر وأوائل القرن العشرين وعرف العلماء منها أن لكل عنصر طيفه الخاص الذي يدل عليه وحده. وأطلق العلماء على مجموعات خطوط الطيف تسميات استخدموا لها حروف مثل K و L و M وغيرها للتمييز بينها . ثم جاء القرن العشرين وبدأ العلماء يفهمون البنية الذرية وما يحكمها من سلوك كمومي في اكتساب الطاقة وإصدارها . ووجد العلماء تفسير لما كانوا يسمونه من قبل مجموعة K أو مجموعة L ، على النحو التالي:
- المدارات الذرية التي لها n = 1 يطلق عليها الغلاف K.
- المدارات الذرية التي لها n = 2 يطلق عليها الغلاف L.
- المدارات الذرية التي لها n = 3 يطلق عليها الغلاف M.
- المدارات الذرية التي لها n = 4 يطلق عليها الغلاف N.
- المدارات الذرية التي لها n = 5 يطلق عليها الغلاف o.
- المدارات الذرية التي لها n = 6 يطلق عليها الغلاف p.
- المدارات الذرية التي لها n = 7 يطلق عليها الغلاف Q.
يحدد الرقم طاقته الإلكترون في مجال نواة الذرة وتعطى طاقته حسب العلاقة:
بالتالي يأخذ العدد الكمي الرئيسي اعدادا صحيحة موجبة دائما أي : ... n=1,2,3,4,5
أمثلة لبعض الحالات
[عدل]- إذا كانت n=1 يشغل الإلكترون الغلاف 1 في الذرة، أي dكون قريبا من النواة ومرتبط بها بقوة -6و13 إلكترون فولت ،
- عندما تكون n=2 يشغل الإلكترون الغلاف 2 ، وتبلغ طاقته -6و13/4 أي نحو -8و3 إلكترون فولت (نلاحظ أن طاقة ارتباط الإلكترون بالنواة قد ضعفت، إذ تغيرت من -6و13 إلى -8و3 إلكترون فولت)،
- عندما تكون n=3 يشغل الإلكترون الغلاف 3 ، وتبلغ طاقته -6و13/9 ، أي تبلغ نحو -5و1 إلكترون فولت (يزداد ضعف الترابط مع النواة ) ... وهكذا
- عندما تصبح طاقة الترابط صفرا، ينفصل الإلكترون عن الذرة ويصبح حرا.
انتقال الإلكترون من غلاف تحتي إلى غلاف أعلى في الذرة يحتاج أن نمده بطاقة من الخارج تقاوم طاقة ارتباطه . حتى إذا أعطيناة طاقة من الخارج بمقدار +6و13 إلكترون فولت أو أكبر منها يصبح الإلكترون حرا . إذا أعطيناه مثلا من الخارج طاقة قدرها 0و14 إلكترون فولت، فهو يستهلك منها 6و13 إلكترون فولت للتغلب على قوة ارتباطه بالنواة، ونجده يتحرك حرا بطاقة 4و0 إلكترون فولت . لهذا تُميز طاقة الارتباط بإشارة سالبة .
انظر أيضًا
[عدل]مراجع
[عدل]- ^ ريموند (12 أغسطس 2014). الكيمياء العامة: المفاهيم الأساسية. العبيكان للنشر. ISBN:9786035035279. مؤرشف من الأصل في 2020-01-25.

