إنزيم: الفرق بين النسختين
| [نسخة منشورة] | [مراجعة غير مفحوصة] |
لا ملخص تعديل وسمان: تحرير من المحمول تعديل ويب محمول |
لا ملخص تعديل |
||
| سطر 1: | سطر 1: | ||
[[File:Glucosidase enzyme.png|thumb|400px|]] |
|||
[[ملف:Triosephosphate isomerase.jpg|تصغير|مخطط لأنزيم تريوزفوسفات إيزميراز]] |
|||
[[File:Glucosidase enzyme.png|thumb|400px|إنزيم الغلوكوزيداز الذي يحوّل جزيئة سكر المالتوز إلى جزيئتي سكر غلوكوز. في الشكل يمثل اللون الأحمر الموقع الفعّال، بينما اللون الأسود ركيزة المالتوز بينما NAD العامل التميم باللون الأصفر.]] |
|||
'''الإنزيم''' أو '''إنظيم''' وهو عبارة عن محفز بيولوجي ذو بنية جزيئية كبيرة، اكتشفت أولا في عملية تخمر الجلوكوز إلى كحول بواسطة الخميرة. |
|||
الإنزيمات محفِّزاتٌ بيولوجية جزيئية، تسرِّعُ التفاعلات الكيميائية. تُسمى الجزيئات التي تمارس الأنزيمات تأثيرها عليها بالركائز، حيث يحوّل الإنزيم الركيزة إلى جزيئات تُعرف باسم النواتج. تحتاج معظم عمليات الاستقلاب (الأيض) إلى إنزيمات من أجل أن تحدث بسرعة كافية للحفاظ على الحياة.<ref name = "Stryer_2002">{{cite book |vauthors=Stryer L, Berg JM, Tymoczko JL | title = Biochemistry | publisher = W.H. Freeman | location = San Francisco | year = 2002 | edition = 5th | isbn = 0-7167-4955-6 | url = http://www.ncbi.nlm.nih.gov/books/NBK21154/}}{{Open access}}</ref>{{rp|8.1}} تحدد الإنزيمات في الخلية أي مسار استقلابي سيحدث في تلك الخلية. تُعرف دراسة الإنزيمات بالإنزيمولوجي و هناك حقل جديد فيه لتحليل "الإنزيمات الكاذبة" ينمو باستمرار، حيث يدرس هذا الحقل الإنزيمات التي فقدت قدرتها التحفيزية البيولوجية خلال التطور و هذا غالباً يؤثر على تسلسلات الأحماض الأمينية و يعطيها خصائص تحفيزية كاذبة غير عادية.<ref>Murphy JM, Farhan H and Eyers PA (2017) Bio-Zombie: the rise of pseudoenzymes in biology.Biochem Soc Trans. 45:537-544</ref><ref name="pmid24107129">{{cite journal |vauthors=Murphy JM, et al. | title = A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties | journal = Biochemical Journal | volume = 457 | issue = 2 | pages = 323–334 | year = 2014 | pmid = 24107129 | doi = 10.1042/BJ20131174| url = }}</ref> |
|||
'''الإنزيم''' عبارة عن [[بروتين]] أو '''معقد بروتيني معدني''' يعمل ضمن الجسم الحي في نطاق درجة حرارة الجسم الفيزيولوجية كوسيط يعمل على تسريع [[التفاعلات الكيميائية الحيوية]] والتحكم [[بنية فراغية|بالبنية الفراغية]] للناتج، آلية عمله تشابه باقي [[وسيط (كيمياء)|الوسطاء]] عن طريق خفض [[طاقة تنشيط|طاقة التنشيط]] مما يسمح بانجاز تفاعلات تجري عادة ضمن درجات حرارة مرتفعة جدا وتحتاج إلى زمن أطول بكثير، وفق الشروط الحيوية بدرجة حرارة لا تتعدى درجة حرارة الجسم الحي وبطاقة أقل بكثير مما يوفر على الجسم استهلاك طاقته في تفاعلات حيوية مهمة، ليعود بعد انجاز التفاعل إلى وضعه الأصلي مما يمكنه من المشاركة بتفاعل جديد وهذا ما يسمح لكميات قليلة من الأنزيم بالمشاركة لفترة زمنية طويلة في التفاعل. |
|||
تُعرف الإنزيمات بقدرتها على تحفيز أكثر من 5000 نوع من التفاعلات الكيميائيةالحيوية.<ref>{{cite journal | vauthors = Schomburg I, Chang A, Placzek S, S?hngen C, Rother M, Lang M, Munaretto C, Ulas S, Stelzer M, Grote A, Scheer M, Schomburg D | title = BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA | journal = Nucleic Acids Research | volume = 41 | issue = Database issue | pages = D764–72 | date = January 2013 | pmid = 23203881 | pmc = 3531171 | doi = 10.1093/nar/gks1049 }}</ref> معظم الإنزيمات بروتينات، و لكن بعضها جزيئات محفزة لرنا تدعى ريبوزومات. تأتي نوعية الإنزيمات من بينتها ثلاثية الأبعاد المميزة. |
|||
==التاريخ وأصل التسمية== |
|||
تزيد الإنزيمات كما كل الحفّازات سرعة التفاعل من خلال تخفيض طاقة التنشيط. تصل قدرة بعض الإنزيمات حتى جعل تحوّل الركيزة إلى المنتج أسرع بملايين المرات من التحول دون وجود الإنزيم. أحد الأمثلة هو إنزيم أورتيدين 5'-فوسفات ديكربوكسيلاز الذي يسمح بتفاعل من الممكن خلال ثوانٍ، بينما سيتطلب هذا التفاعل دون الإنزيم ملايين السنين.<ref name="radzicka">{{cite journal | vauthors = Radzicka A, Wolfenden R | title = A proficient enzyme | journal = Science | volume = 267 | issue = 5194 | pages = 90–931 | date = January 1995 | pmid = 7809611 | doi=10.1126/science.7809611| bibcode = 1995Sci...267...90R }}</ref><ref name="pmid17889251">{{cite journal | vauthors = Callahan BP, Miller BG | title = OMP decarboxylase—An enigma persists | journal = Bioorganic Chemistry | volume = 35 | issue = 6 | pages = 465–9 | date = December 2007 | pmid = 17889251 | doi = 10.1016/j.bioorg.2007.07.004 }}</ref> كيميائياً، لا تُستهلك الإنزيمات في التفاعلات الكيميائية و لا تقوم بتغيير التوازن في التفاعلات الكيميائية، كما كل الحفّازات الكيميائية. تتميز الإنزيمات عن بقية الحفّازات الكيميائية بنوعيتها الشديدة. يمكن أن يتأثر النشاط الإنزيمي بجزيئات معينة كالمثبطات التي تقلل من النشاط الإنزيمي، أو المنشطات التي تنشط عمل الإنزيم. الكثير من الأدوية العلاجية و السموم هي مثبطات إنزيمية. ينخفض النشاط الإنزيمي بشكل ملحوظ كذلك خارج درجة الحرارة و الحموضة المثاليتين. |
|||
في عام 1877, كان عالم الفسيولوجيا الألماني [[ويلهيلم كوهن]] (1837–1900) أول من استخدم مصطلح ''[[wiktionary:enzyme|إنزيم]]'', والذي أتى من [[لغة إغريقية|الإغريقية]] ἔνζυμον,بمعنى "مخمّر", لوصف هذه العملية.<ref>Kühne coined the word "enzyme" in: {{Cite journal| vauthors = Kühne W | year = 1877 | url = https://books.google.com/?id=jzdMAAAAYAAJ&pg=PA190 | language = German | title = Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente | trans-title = On the behavior of various organized and so-called unformed ferments | journal = Verhandlungen des naturhistorisch-medicinischen Vereins zu Heidelberg | series = new series | volume = 1 | issue = 3 | pages = 190–193 }} The relevant passage occurs on page 190: ''"Um Missverständnissen vorzubeugen und lästige Umschreibungen zu vermeiden schlägt Vortragender vor, die ungeformten oder nicht organisirten Fermente, deren Wirkung ohne Anwesenheit von Organismen und ausserhalb derselben erfolgen kann, als ''Enzyme'' zu bezeichnen."'' (Translation: In order to obviate misunderstandings and avoid cumbersome periphrases, [the author, a university lecturer] suggests designating as "enzymes" the unformed or not organized ferments, whose action can occur without the presence of organisms and outside of the same.)</ref> |
|||
تُستخدم بعض الإنزيمات تجارياً، لتصنيع المضادات الحيوية مثلاً، حتى أن بعض المنتجات المنزلية تستخدم الإنزيمات لتسريع تفاعلات كيميائية معينة كبعض الإنزيمات الموجودة في مساحيق الغسيل الحيوية التي تحطم البروتينات أو النشاء أو الدهون الموجودة الي تسبب بقع الملابس. |
|||
== البنية ثلاثية الأبعاد == |
|||
[[Image:Eduardbuchner.jpg|alt=Photograph of Eduard Buchner.|thumb|180px|left|إدوارد بوتشنر]] |
|||
بحلول أواخر القرن السابع عشر و بدايات القرن الثامن عشر، كان قد تم التعرّف على هضم المعدة للَّحم بواسطة مفرزاتها، |
|||
<ref name="Reaumur1752">{{cite journal | vauthors = de Réaumur RA | authorlink = René Antoine Ferchault de Réaumur | year = 1752 | title = Observations sur la digestion des oiseaux|journal = Histoire de l'academie royale des sciences | volume = 1752 | pages = 266, 461 }}</ref> و تحويل النشاء إلى سكاكر عبر المستخلصات النباتية و اللعاب، إلا أن الآليات التي يتم من خلالها هذا كانت مجهولة..<ref>{{cite book | url = http://etext.lib.virginia.edu/toc/modeng/public/Wil4Sci.html | last = Williams | first = Henry Smith | title = A History of Science: in Five Volumes''. ''Volume IV: Modern Development of the Chemical and Biological Sciences | publisher = Harper and Brothers | year = 1904 | name-list-format = vanc }}</ref> |
|||
كان الكيميائي الفرنسي أنسيلم باين أول من اكتشف إنزيماً و هو إنزيم دي أسيتاز عام 1833<ref>{{cite journal | vauthors = Payen A, Persoz JF | year = 1833 | title = Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels | language = French | trans-title = Memoir on diastase, the principal products of its reactions, and their applications to the industrial arts | journal = Annales de chimie et de physique | series = 2nd | volume = 53 | url = https://books.google.com/?id=Q9I3AAAAMAAJ&pg=PA73 | pages = 73–92}}</ref> بعد عدّة عقود و أثناء دراسة تخمّر السكر و تحوله إلى كحول بواسطة الخميرة، خلص لويس باستر أن قوةً حيوية هي من تسبب هذا التخمّر و هي موجودة في خلايا الخميرة، أطلق على هذه القوة اسم "Ferments" "التخمّر"، و اِعْتُقِدَ أن التخمّر وظيفة موجودة فقط في الكائنات الحيّة. كتب باستر أن "التخمّر الكحولي فعل مرتبط بحياة و تنظيم خلايا الخميرة، و ليس مرتبطاً بموت أو تعفّن هذه الخلايا." |
|||
[[ملف:800px-Enzymeactivesite ar.png|تصغير|يسار|350بك| صورة توضح مواقع الارتباط في الأنزيمات.]] |
|||
تتحدد وظيفة الإنزيمات كما هي حالة البروتينات [[بنية البروتين ثلاثية الأبعاد|ببنيتها ثلاثية الأبعاد]]، ويمكن أن نصنف الأنزيمات حسب عدد [[ببتيد|السلاسل الببتيدية]] المشاركة في تركيبها: |
|||
<ref>{{cite journal | vauthors = Manchester KL | title = Louis Pasteur (1822–1895)–chance and the prepared mind | journal = Trends in Biotechnology | volume = 13 | issue = 12 | pages = 511–5 | date = December 1995 | pmid = 8595136 | doi = 10.1016/S0167-7799(00)89014-9 }}</ref> |
|||
* بروتينات أحادية الجزيء: تتالف من سلسلة ببتيدية واحدة ملتفة مؤلفة من مئات الحموض الأمينية. |
|||
عام 1877، استخدم الفيزيولوجي الألماني Wilhelm Kühne (1830-1900( المصطلح "إنزيم" للمرة الأولى، مشتَقَّةً من الكلمة اليونانية (???????)، و التي تعني "مُخمَّر" أو "في الخميرة"، و قد استخدم هذا المصطلح النشاط كيميائي تقوم به الكائنات الحية.<ref>{{cite book | editor1-first = John L. | editor1-last = Heilbron | title = The Oxford Companion to the History of Modern Science | first1 = Frederic Lawrence | last1 = Holmes | chapter = Enzymes | page = 270 | chapterurl = https://books.google.com/books?id=abqjP-_KfzkC&pg=PA270&lpg=PA270&dq=history+of+enzymes+ferment+living+organisms&source=bl&hl=en | publisher = Oxford University Press | location = Oxford | year = 2003 | name-list-format = vanc }}</ref> |
|||
* بروتينات متعددة الجزيء: تتألف من عدة سلاسل ببتيدية، مختلفة أو متماثلة، تتصرف معا كانها بنية واحدة. |
|||
قدّم إدوارد بوخنر أول ورقة له عن دراسة مستخلصات الخمائر عام 1897. وجد بوخنر في سلسلة من التجارب التي أُجريت في جامعة برلين أن السكر تخمّر بواسطة مستخلصات الخمائر حتى عندما لم يحتوِ المزيج على خلايا خمائر حيّة <ref name="urlEduard Buchner - Biographical">{{cite web | url = http://nobelprize.org/nobel_prizes/chemistry/laureates/1907/buchner-bio.html | title = Eduard Buchner | work = Nobel Laureate Biography | publisher = Nobelprize.org | accessdate = 23 February 2015 }}</ref> و أطلق اسم "زيماز" على الإنزيم الذي خمّر السكروز.<ref name="urlEduard Buchner - Nobel Lecture: Cell-Free Fermentation">{{cite web | url = http://nobelprize.org/nobel_prizes/chemistry/laureates/1907/buchner-lecture.html | title = Eduard Buchner – Nobel Lecture: Cell-Free Fermentation | year = 1907 | work = Nobelprize.org | accessdate = 23 February 2015 }}</ref> تلقى بوخنر جائزة نوبل في الكيمياء عام 1907 عن "اكتشافه التخمّر دون الخلايا". سُمِّيت الإنزيمات بعد بوخنر تبعاً للتفاعل الذي تقوم بإجراءه، حيث اِصطُلح على إدماج اللاحقة "ase" "از"مع اسم الركيزة (مثلاً اللاكتاز هو الإنزيم الذي يقسم اللاكتوز) أو مع اسم التفاعل (مثلاً دنا بوليميراز يقوم بتشكيل بوليميرات الحمض النووي منقوص الأوكسجين).<ref>The naming of enzymes by adding the suffix "-ase" to the substrate on which the enzyme acts, has been traced to French scientist [[Emile Duclaux]] (1840–1904), who intended to honor the discoverers of [[diastase]] – the first enzyme to be isolated – by introducing this practice in his book {{cite book | author = Duclaux E | title = Traité de microbiologie: Diastases, toxines et venins | language = French | trans-title = Microbiology Treatise: diastases , toxins and venoms | year = 1899 | publisher = Masson and Co | location = Paris, France | url = https://books.google.com/books?id=Kp9EAAAAQAAJ&printsec=frontcover }} See Chapter 1, especially page 9.</ref> |
|||
لم يتم التعّرف على الهوية الكيمائية الحيوية للإنزيمات في بدايات القرن العشرين، على الرغم من أن الكثير من العلماء لاحظوا النشاط الإنزيمي الذي كان مترافقاً مع البروتينات، و لكن بعض العلماء الآخرين (منهم الحائز على جائزة نوبل ريتشارد فيلستاتر) جادلوا في أن البروتينات عبارة عن ناقلة للإنزيمات الحقيقية و أن البروتينات غير قادرة على التحفيز.<ref name = "Willst?tter_1927">{{cite journal| vauthors = Willst?tter R | title = Faraday lecture. Problems and methods in enzyme research | journal = Journal of the Chemical Society (Resumed) | date = 1927 | pages = 1359 | doi = 10.1039/JR9270001359 }} quoted in {{cite journal | vauthors = Blow D | title = So do we understand how enzymes work? | journal = Structure (London, England : 1993) | volume = 8 | issue = 4 | pages = R77–R81 | date = April 2000 | pmid = 10801479 | doi = 10.1016/S0969-2126(00)00125-8 | url = http://cmgm3.stanford.edu/biochem/sb241/Herschlag_lectures/papers/Blow.pdf | format = pdf }}</ref> أظهر جيمس بي. سيمنر عام 1926 أن إنزيم اليوراز بروتينٌ نقيّ و قام ببلورته، قام بالمثل أيضاً عام 1937 مع إنزيم الكاتالاز. أثبت جون هوارد نورثروب و فيندل ميردريث ستانلي اللذان عملا على إنزيم الببسين الهاضم عام 1930 و إنزيم الكيموتربسين و التريبسين، أثبتا أن البروتينات النقية يمكن أن تكون إنزيمات. حصل هؤلاء العلماء الثلاثة على جائزة نوبل في الكيمياء عام 1946.">{{cite web | url = http://nobelprize.org/nobel_prizes/chemistry/laureates/1946/ | title = Nobel Prizes and Laureates: The Nobel Prize in Chemistry 1946 | work = Nobelprize.org | accessdate = 23 February 2015 }}</ref> |
|||
و كما هي حال البروتينات فإن الأنزيمات تتشكل من سلاسل ببتيدية مؤلفة من حموض امينية تلتف على بعضها لتشكيل بنية ثلاثية الأبعاد، كما تترابط السلاسل الببتيدية بعد ذلك بروابط غير تكافؤية لتكون بروتينات معقدة تمتلك خواصا حركية ومراكز ارتباط. |
|||
مكّن اكتشاف إمكانية بلورة الإنزيمات، مكّن من تحليل بنى الإنزيمات بدراسة البلورات بواسطة الأشعة السينية، و تم القيام بهذا الأمر للمرة الأولى من أجل دراسة إنزيم الليزوزوم، و هو إنزيم موجود في اللعابو الدموع و بياض البيض و يقوم هذا الإنزيم بهضم معطف بعض أنواع البكتيريا، حيث تم فهم هيكل هذا الإنزيم من قبل مجموعة من العلماء يقودهم دافيد تشيلتون فيليبس، و نُشر الأمر 1965.<ref>{{cite journal | vauthors = Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR | title = Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 ?ngstr?m resolution | journal = Nature | volume = 206 | issue = 4986 | pages = 757–61 | date = May 1965 | pmid = 5891407 | doi = 10.1038/206757a0 | bibcode = 1965Natur.206..757B }}</ref> شكّل هيكل الليزوزوم عالي الدقة بدايةً لحقل البيولوجيا الهيكلية و بدايةً لجهود فهم كيف تعمل الإنزيمات على المستوى الذري.<ref name="pmid10390620">{{cite journal | vauthors = Johnson LN, Petsko GA | title = David Phillips and the origin of structural enzymology | journal = Trends Biochem. Sci. | volume = 24 | issue = 7 | pages = 287–9 | year = 1999 | pmid = 10390620 | doi = 10.1016/S0968-0004(99)01423-1 }}</ref> |
|||
معظم الأنزيمات تشكل جزيئات بروتينية ضخمة أكبر بكثير من [[ركيزة|الركائز]] التي ترتبط بها لذلك فإن ما يشكل تماسا مباشرا بين الأنزيم والركازة المرتبطة لا يتعدى عشرة حموض امينية تشكل ما يسمى تجويف أو [[موقع الارتباط]]. أحيانا يمتلك الأنزيم أكثر من موقع ارتباط واحد وأحيانا يوجد ضمن الأنزيم موقع ارتباط [[عامل مرافق|تميم العامل]] وارتباطه ضروري لإنجاز التفاعل. بعض المواقع الارتباطية ذات وظيفة تنظيمية، فهي تقوم بزيادة أو تخفيض نشاط الأنزيم. |
|||
==اصطلاحات التسمية== |
|||
يُشتق اسم الإنزيم غالباً من ركيزته أو التفاعل الكيميائي الذي يحفّزه، مع اللاحقة "از" "ase" في النهاية.<ref name="Stryer_2002" /> و من الأمثلة على ذلك اللاكتاز و الكحول ديهيدروجناز و دنا بوليميراز. تُسمَّى الإنزيمات المختلفة التي تحفّز التفاعل الكيميائي نفسه بالإيزوزيمات.<ref name = "Stryer_2002"/> |
|||
طوّر الاتحاد الدولي للكيمياء الحيوية و البيولوجية الجزيئية نظام تسمية الإنزيمات، و هو أرقام التصنيف الإنزيمي، حيث يُوصف كل إنزيم بواسطة تسلسل من أربعة أرقام مسبوقة بالسابقة "EC". يصنِّف الرقم الأول الإنزيمات على أساس آلية عملها.<ref name="url_Enzyme_Classification">{{cite web | url = http://www.chem.qmul.ac.uk/iubmb/enzyme/rules.html | title = Classification and Nomenclature of Enzymes by the Reactions they Catalyse | author = Nomenclature Committee | work = International Union of Biochemistry and Molecular Biology (NC-IUBMB) | publisher = School of Biological and Chemical Sciences, Queen Mary, University of London }}</ref> |
|||
أعلى مستوى للتصنيف هو: |
|||
*EC1 أنزيمات أكسدة-إرجاع: تحفّز تفاعلات الأكسدة-إرجاع |
|||
*EC2 إنزيمات الترانسفيراز: ينقل زمرة وظيفية (كزمرة الميثيل أو الفوسفات) |
|||
*EC3 إنزيمات هيدرولاز : تحفّز تفاعلات التحلل المائي للعديد من الروابط |
|||
*EC4 إنزيمات اللياز: تقوم بإنشاء العديد من الروابط بوسائل غير التحلل المائي أو الأكسدة |
|||
*EC5 إنزيمات الإيزوميراز: تحفّز التغيرات التصاوغية في جزيئة واحدة |
|||
*EC6 أنزيمات الليغاز: تربط جزيئتين بواسطة رابطة تساهمية |
|||
هناك تقسيم فرعي لهذه الأقسام بحسب خصائص أخرى كالركيزة و النواتج و الآلية الكيميائية. فالإنزيم نوعي لأربعة خصائص تصفها الخانات الأربعة في رقم التصنيف الإنزيمي. على سبيل المثال، الهكسوكيناز (EC 2.7.1.1) إنزيم ترانسفيراز أي إنزيم ناقل، يضيف مجموعة الفوسفات (EC 2.7) إلى جزيء الهكسوز، و الهكسوز هو جزيء يحتوي على مجموعة كحولية (EC 2.7.1).<ref>{{cite web|title=EC 2.7.1.1|url=http://www.chem.qmul.ac.uk/iubmb/enzyme/EC2/7/1/1.html | author = Nomenclature Committee | work = International Union of Biochemistry and Molecular Biology (NC-IUBMB) | publisher = School of Biological and Chemical Sciences, Queen Mary, University of London }}</ref> |
|||
==البنية== |
|||
[[File:Q10 graph c.svg|thumb|400px|يزداد نشاط الإنزيم في البداية مع درجة الحرارة (معامل Q10) حتى يتفكك انطواء الإنزيم (يتمسخ)، مما يؤدي إلى أفضل سرعة تفاعل في درجة حرارة متوسطة.]] |
|||
عموماً تكون الإنزيمات بروتينات كروية، تمارس تأثيرها بمفردها أو في معقّدات أكبر. يحدد تسلسل الحموض الأمينية هيكل الإنزيم، و الذي بدوره يحدد نشاطه التحفيزي.<ref>{{cite journal | vauthors = Anfinsen CB | title = Principles that govern the folding of protein chains | journal = Science | volume = 181 | issue = 4096 | pages = 223–30 | date = July 1973 | pmid = 4124164 | doi = 10.1126/science.181.4096.223 | bibcode = 1973Sci...181..223A }}</ref> على الرغم من أن البنية تحدد الوظيفة الإنزيمية، إلا أنه لا يُمكن التنبؤ بكامل النشاط الإنزيمي بواسطة البنية فقط.<ref>{{cite journal | vauthors = Dunaway-Mariano D | title = Enzyme function discovery | journal = Structure (London, England : 1993) | volume = 16 | issue = 11 | pages = 1599–600 | date = November 2008 | pmid = 19000810 | doi = 10.1016/j.str.2008.10.001 }}</ref> يتمسخ الإنزيم عند التسخين أو عند التعرّض لممسخات كيميائية، ما يؤدي لحدوث خلخلة في بنية الإنزيم، يفقد الإنزيم بسببها نشاطه.<ref>{{cite book | last1 = Petsko | first1 = Gregory A. | last2 = Ringe | first2 = Dagmar | title = Protein structure and function | date = 2003 | publisher = New Science | location = London | isbn=978-1405119221 | name-list-format = vanc | chapter = Chapter 1: From sequence to structure | chapterurl = https://books.google.com/books?id=2yRDWkHhN9QC&pg=PA27&dq=Protein+Denaturation+unfold+loss+of+function&hl=en | page = 27 }}</ref> يرتبط تمسّخ الإنزيمات بدرجات الحرارة الأعلى من الأنواع الشائعة، لذلك فإن الإنيمات التي تُستحصل من بكتيريا البيئات البركانية كالينابيع الساخنة تُعتبر ثمينة للغاية لقدرتها على القيام بوظائفها في ظل درجات حرارة عالية، مما يسمح للتفاعلات التي يشرف عليها الإنزيم بالحدوث بمعدّلات عالية جداً. |
|||
عادةً تكون الإنزيمات أكبر بكثير من ركائزها. تتفاوت أحجام الإنزيمات بين ثمالة من الأحماض الأمينية في وحيدة -أوكسالوكروتونات توتوميراز، <ref>{{cite journal | vauthors = Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP | title = 4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer | journal = The Journal of Biological Chemistry | volume = 267 | issue = 25 | pages = 17716–21 | date = September 1992 | pmid = 1339435 }}</ref> حتى أكثر من 2500 ثمالة في تصنيع الأحماض الدهنية الحيوانية.<ref>{{cite journal | vauthors = Smith S | title = The animal fatty acid synthase: one gene, one polypeptide, seven enzymes | journal = FASEB Journal | volume = 8 | issue = 15 | pages = 1248–59 | date = December 1994 | pmid = 8001737 }}</ref> يشترك في عملية التحفيز جزء صغير فقط من بنيتها (حوالي 2 إلى 4 حموض أمينية) و هو يسمى الموقع الحفّاز.<ref>{{ cite web | url = http://www.ebi.ac.uk/thornton-srv/databases/CSA/ | title = The Catalytic Site Atlas | publisher = The European Bioinformatics Institute | accessdate = 4 April 2007 }}</ref> يقع الموقع الحفّاز قريباً من موقع رابط أو أكثر حيث توجّه الثمالات الركائز. يشكل الموقع الحفّاز و الموقع الرابط سويةً الموقع النشط في الإنزيم. معظم ما تبقى من بنية الإنزيم تخدم في الحفاظ على التوجيه الدقيق و ديناميكية الموقع النشط.<ref name = "Suzuki_2015_7">{{cite book | author = Suzuki H | title = How Enzymes Work: From Structure to Function | publisher = CRC Press | location = Boca Raton, FL | year = 2015 | isbn = 978-981-4463-92-8 | chapter = Chapter 7: Active Site Structure | pages = 117–140 }}</ref> |
|||
في بعض الإنزيمات لا تشارك الأحماض الأمينية في التحفيز بشكل مباشر، بل يحتوي الإنزيم على مواقع تربط و توجه العوامل المحفّزة، أي أنه ينشط التفاعل بشكل غير مباشر.<ref name="Suzuki_2015_7" /> يمكن أن تحتوي بنى الإنزيمات أيضاً على مواقع تفارغية حيث يؤدي ربط جزيء صغير إلى إحداث تغيير في التركيب يزيد أو يُنقص النشاط.<ref>{{cite book | author = Krauss G | title = Biochemistry of Signal Transduction and Regulation | date = 2003 | publisher = Wiley-VCH | location = Weinheim | isbn = 9783527605767 | edition = 3rd | pages = 89–114 | chapter = The Regulations of Enzyme Activity | chapterurl = https://books.google.com/books?id=iAvu2XRLnfYC&pg=PA91&dq=enzyme+metabolic+pathways+feedback+regulation&hl=en&redir_esc=y}}</ref> |
|||
الريبزيمات هي مجموعة صغيرة من المحفزات الحيوية التي تحفز تفاعلات رنا، يمكن أن يكون الإنزيم مفرداً أو ضمن معقّد. أشيع هذه الإنزيمات هو الريبوزوم و هو معقّد من البروتينات و مكّونات محفزة لرنا.<ref name = "Stryer_2002"/> |
|||
==الآلية== |
|||
[[File:Enzyme structure.svg|thumb|400px|تنظيم بنية الإنزيم، مثال الليزوزوم. يُظهر اللون الأزرق المواقع الرابطة و اللون الأحمر المواقع الحفّاز، و اللون الأسود ركيزة الببتيدغليكان ({{PDB|9LYZ}}).]] |
|||
===ربط الركيزة=== |
|||
يجب أن تربط الإنزيمات ركائزها قبل أن تحفّز تفاعلاتها.عادةً ما تكون الإنزيمات نوعية جداً بالنسبة لركائزها التي تربطها و التفاعلات التي تحفّزها. تتحدد هذه النوعية بجيوب الربط ذات الشكل و الشحنة الملائمين بالإضافة إلى الصفة المحبة أو الكارهة للماء، بناء على الصفات السابقة تستطيع الإنزيمات التفريق بين الركائز المتشابهة جداً.<ref>{{cite journal | vauthors = Jaeger KE, Eggert T | title = Enantioselective biocatalysis optimized by directed evolution | journal = Current Opinion in Biotechnology | volume = 15 | issue = 4 | pages = 305–13 | date = August 2004 | pmid = 15358000 | doi = 10.1016/j.copbio.2004.06.007 }}</ref> |
|||
تكون الإنزيمات المشاركة في عملية النسخ و تعبير الجينوم عالية الدقة و النوعية، حيث تمتلك بعض هذه الإنزيمات آلية "القراءة للإثبات" مثل إنزيم دنا بوليميراز الذي يحفّز تفاعلاً أولاً و من ثم يتأكد من كون المنتج صحيحاً.<ref>{{cite journal | vauthors = Shevelev IV, Hübscher U | title = The 3' 5' exonucleases | journal = Nature Reviews Molecular Cell Biology | volume = 3 | issue = 5 | pages = 364–76 | date = May 2002 | pmid = 11988770 | doi = 10.1038/nrm804 }}</ref> تؤدي هاتان الخطوتان إلى معدّل أخطاء أقل من 1 إلى 100 مليون تفاعل في بوليميراز عالية الدقة عند الثدييات.<ref name = "Stryer_2002"/> هناك آليات تأكد شبيهة موجودة في رنا بوليميراز،<ref>{{cite journal | vauthors = Zenkin N, Yuzenkova Y, Severinov K | title = Transcript-assisted transcriptional proofreading | journal = Science | volume = 313 | issue = 5786 | pages = 518–20 | date = July 2006 | pmid = 16873663 | doi = 10.1126/science.1127422 | bibcode = 2006Sci...313..518Z }}</ref> و أمينو أسيل رنا الناقل سينثيتازات،<ref>{{cite journal | vauthors = Ibba M, Soll D | title = Aminoacyl-tRNA synthesis | journal = Annual Review of Biochemistry | volume = 69 | pages = 617–50 | pmid = 10966471 | doi = 10.1146/annurev.biochem.69.1.617 | year=2000}}</ref> و الريبوزومات.<ref>{{cite journal | vauthors = Rodnina MV, Wintermeyer W | title = Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms | journal = Annual Review of Biochemistry | volume = 70 | pages = 415–35 | pmid = 11395413 | doi = 10.1146/annurev.biochem.70.1.415 | year=2001}}</ref> |
|||
== الاصطفائية == |
|||
و على العكس من ذلك يوجد العديد من الإنزيمات التي تظهر اختلاطاً إنزيمياً، حيث تمتلك نوعية واسعة و تمارس تأثيراً على ركائز عديدة مختلفة فيزيولوجياً. تؤدي العديد من الإنزيمات إلى حدوث نشاطات جانبية صغيرة، و قد تمثل هذه النشاطات نقطة بداية لانتقاء تطوّري لوظيفة جديدة.<ref name=Tawfik10>{{cite journal | vauthors = Khersonsky O, Tawfik DS | title = Enzyme promiscuity: a mechanistic and evolutionary perspective | journal = Annual Review of Biochemistry | volume = 79 | pages = 471–505 | pmid = 20235827 | pmc = | doi = 10.1146/annurev-biochem-030409-143718 | year=2010}}</ref><ref>{{cite journal | vauthors = O'Brien PJ, Herschlag D | title = Catalytic promiscuity and the evolution of new enzymatic activities | journal = Chemistry & Biology | volume = 6 | issue = 4 | pages = R91–R105 | date = April 1999 | pmid = 10099128 | doi = 10.1016/S1074-5521(99)80033-7 }}</ref> |
|||
[[File:Hexokinase induced fit.svg|alt=Hexokinase displayed as an opaque surface with a pronounced open binding cleft next to unbound substrate (top) and the same enzyme with more closed cleft that surrounds the bound substrate (bottom)|thumb|400px|يغير الإنزيم شكله ليناسب الركيزة، التي ترتبط بالإنزيم فيتشكّل معقّد إنزيم-ركيزة. اللون الأزرق المواقع الرابطة، أما اللون الأسود فهو الركيزة، أما اللون الأصفر يمثّل العامل المرافق و هنا هو أيون المغنزيوم.]] |
|||
====نموذج القفل و المفتاح==== |
|||
الأنزيمات بشكل عام [[اصطفائية]] بالنسبة للتفاعلات والركائز التي تنجز هذه التفاعلات عليها، وتلعب هنا تكاملية الشكل والشحنة لكل من البروتين والركازة (المادة الأساس) دورا مهما في هذه الاصطفائية. |
|||
لشرح النوعية الملحوظة للإنزيمات اقترح إميل فيتشر عام 1894 أن للإنزيم و الركيزة أشكال هندسية محددة تناسب بعضها بعضاً.<ref>{{cite journal | vauthors = Fischer E | year = 1894 | title = Einfluss der Configuration auf die Wirkung der Enzyme | language = German | trans_title = Influence of configuration on the action of enzymes | journal=Berichte der Deutschen chemischen Gesellschaft zu Berlin | volume = 27 | issue = 3 | pages = 2985–93 | url = http://gallica.bnf.fr/ark:/12148/bpt6k90736r/f364.chemindefer|doi=10.1002/cber.18940270364 }} From page 2992: ''"Um ein Bild zu gebrauchen, will ich sagen, dass Enzym und Glucosid wie Schloss und Schlüssel zu einander passen müssen, um eine chemische Wirkung auf einander ausüben zu k?nnen."'' (To use an image, I will say that an enzyme and a glucoside [i.e., glucose derivative] must fit like a lock and key, in order to be able to exert a chemical effect on each other.)</ref> تمت الإشارة إلى هذه الفكرة بـ"نموذج القفل و الفتاح".<ref name="Stryer_2002" /> نجح هذا النموذج في تفسير نوعية الإنزيمات إلا أنه فشل في تفسير استقرار الحالة الانتقالية التي تحققها الإنزيمات.<ref name="Cooper_2000">{{cite book |author = Cooper GM | title = The Cell: a Molecular Approach | date = 2000 | publisher = ASM Press | location = Washington (DC ) | isbn = 0-87893-106-6 | edition = 2nd | chapter = Chapter 2.2: The Central Role of Enzymes as Biological Catalysts | chapterurl = http://www.ncbi.nlm.nih.gov/books/NBK9921/}}</ref> |
|||
== فرضية القفل والمفتاح == |
|||
====نموذج التلاؤم المُستحث==== |
|||
[[ملف:Two substrates ar.png|center|455بك|فرضية القفل والمفتاح لفيشر لتوضيح آلية عمل الأنزيمات.]] |
|||
اقترح دانيال كوشلاند عام 1958 تعدلاً على نموذج القفل و المفتاح لأن هياكل الإنزيمات مرنة نوعاً ما، حيث يتغير شكل الموقع النشط باستمرار من خلال التفاعل مع الركيزة.<ref>{{cite journal | vauthors = Koshland DE | title = Application of a Theory of Enzyme Specificity to Protein Synthesis | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 44 | issue = 2 | pages = 98–104 | date = February 1958 | pmid = 16590179 | pmc = 335371 | doi = 10.1073/pnas.44.2.98 | bibcode = 1958PNAS...44...98K }}</ref> و بالنتيجة فإن الركيزة لا ترتبط ببساطة بموقع نشط جامد، أن السلاسل الجانبية للحموض الأمينية التي تكوّن الموقع النشط تتوضع في أماكن معينة بدقة بالغة حتى تمكّن الإنزيم من أداء وظيفته التحفيزية. يتغير شكل الركيزة أيضاً في بعض الحالات بمجرد دخولها للموقع النشط مثل إنزيم الغلوكوزيداز.<ref>{{cite journal | vauthors = Vasella A, Davies GJ, B?hm M | title = Glycosidase mechanisms | journal = Current Opinion in Chemical Biology | volume = 6 | issue = 5 | pages = 619–29 | date = October 2002 | pmid = 12413546 | doi = 10.1016/S1367-5931(02)00380-0 }}</ref> يستمر الموقع النشط بتغيير شكله حتى ترتبط الركيزة بشكل تام و توفق هذه اللحظة تحديد الشكل النهائي و توزع الشحنات.<ref>{{cite book | last = Boyer | first = Rodney | title = Concepts in Biochemistry | edition = 2nd | publisher = John Wiley & Sons, Inc. | location = New York, Chichester, Weinheim, Brisbane, Singapore, Toronto. | isbn = 0-470-00379-0 | pages=137–8 | chapter = Chapter 6: Enzymes I, Reactions, Kinetics, and Inhibition | year = 2002 | oclc = 51720783 | name-list-format = vanc}}</ref> يزيد التلاؤم المُستحث من دقة التعرّف الجزيئي في ظل وجود منافسة و ضوضاء جزيئية، و هذا يكسب التفاعلات التي تتم بإشراف الإنزيم تدقيقاً للركائز.<ref>{{cite journal | vauthors = Savir Y, Tlusty T | title = Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition | journal = PLoS ONE | volume = 2 | issue = 5 | pages = e468 | year = 2007 | pmid = 17520027 | pmc = 1868595 | doi = 10.1371/journal.pone.0000468 | url = http://www.weizmann.ac.il/complex/tlusty/papers/PLoSONE2007.pdf | editor1-last = Scalas | editor1-first = Enrico |name-list-format=vanc| bibcode = 2007PLoSO...2..468S }}</ref> |
|||
===التحفيز=== |
|||
وضعت هذه الفرضية من قبل اميل فيشر لتفسير اصطفائية الأنزيمات حيث افترض ان موقع الارتباط في الأنزيم يشابه دور القفل الذي لا يفتحه إلا مفتاح مخصص له ينطبق شكله على متطلبات هذا القفل، وهذا ما يؤدي إلى ان جزيئات معينة فقط تستطيع الارتباط بالانزيم في موقع ارتباطه التفاعلي لتخضع للتقاعلات التي ينجزها الأنزيم. |
|||
تحفّز الإنزيمات التفاعلات بطرائق عدة، تشترك هذه الطرق جميعها بمحلة خفض طاقة التنشيط.<ref name="Fersht_1985">{{cite book | author = Fersht A | title = Enzyme Structure and Mechanism | publisher = W.H. Freeman | location = San Francisco | year = 1985 | pages = 50–2 | isbn = 0-7167-1615-1}}</ref> |
|||
# عبر تثبيت الحالة الانتقالية: |
|||
#*خلق بيئة مع توزع شحنات متكاملان مع الحالة الانتقالية لتخفيض طاقة التنشيط.<ref>{{cite journal | vauthors = Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH | title = Electrostatic basis for enzyme catalysis | journal = Chemical Reviews | volume = 106 | issue = 8 | pages = 3210–35 | date = August 2006 | pmid = 16895325 | doi = 10.1021/cr0503106 }}</ref> |
|||
# عبر توفير مسار تفاعلي بديل: |
|||
== فرضية التلاؤم المستحث (المحرض) == |
|||
#*يتم إحداث تفاعل مؤقت مع الركيزة، و يتشكل عبر هذا التفاعل وسيط يساهم في توفير طاقة تنشيط أقل للحالة الانتقالية.<ref>{{cite book | last1 = Cox | first1 = Michael M. | last2 = Nelson | first2 = David L. | title = Lehninger Principles of Biochemistry | date = 2013 | publisher = W.H. Freeman | location = New York, N.Y. | isbn = 978-1464109621 | edition = 6th | chapter = Chapter 6.2: How enzymes work | page = 195 | chapterurl = http://www.amazon.co.uk/Lehninger-Principles-Biochemistry-David-Nelson/dp/1464109621/ref=sr_1_1?s=books&ie=UTF8&qid=1425406097&sr=1-1&keywords=9781464109621 | name-list-format = vanc }}</ref> |
|||
# عبر زعزعة استقرار الحالة الأرضية للركيزة: |
|||
#*دفع الركيزة المرتبطة إلى الحالة الانتقالية لتقليل الطاقة المطلوبة للوصول إلى الحالة الانتقالية.<ref name=PMID12947189>{{cite journal | vauthors = Benkovic SJ, Hammes-Schiffer S | title = A perspective on enzyme catalysis | journal = Science | volume = 301 | issue = 5637 | pages = 1196–202 | date = August 2003 | pmid = 12947189 | doi = 10.1126/science.1085515 | bibcode = 2003Sci...301.1196B }}</ref> |
|||
# عبر توجيه الركائز إلى التفاعلات المنتجة لتقليل تغير إنتروبية التفاعل.<ref>{{cite book | author = Jencks WP | title = Catalysis in Chemistry and Enzymology | publisher = Dover | location = Mineola, N.Y | year = 1987 | isbn = 0-486-65460-5 }}</ref> مساهمة هذه الآلية في التحفيز ضئيلة نسبياً.<ref>{{cite journal | vauthors = Villa J, Strajbl M, Glennon TM, Sham YY, Chu ZT, Warshel A | title = How important are entropic contributions to enzyme catalysis? | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 97 | issue = 22 | pages = 11899–904 | date = October 2000 | pmid = 11050223 | pmc = 17266 | doi = 10.1073/pnas.97.22.11899 | bibcode = 2000PNAS...9711899V }}</ref> |
|||
قد تستخدم الإنزيمات العديد من هذه الآليات في وقت واحد. |
|||
===الدينامية=== |
|||
الإنزيمات ليست هياكل جامدة ثابتة، بل على العكس من ذلك فإن للإنزيمات حركة ديناميكية داخلية معقدة، حيث تتحرك أجزاء من بنية الإنزيم كثمالات الأحماض الأمينية المفردة، أو الزمر لتشكل عروة بروتينية أو وحدة بنية ثانوية أو حتى نطاق بروتين كامل. تؤدي هذه الحركات إلى مجموعة متجانسة من البنى البروتينية المختلفة قليلاً التي تتداخل مع بعضها البعض عند التوازن. تؤدي هذه الحركات إلى اختلافات في وظائف الإنزيم باختلاف الحالات. على سبيل المثال إنزيم ديهيدروفولات ريدوكتاز يقوم بربط الركيزة و يحفّز و يطلق العامل المرافق و يطلق المنتج خلال دورة تحفيزه.<ref>{{cite journal |vauthors=Ramanathan A, Savol A, Burger V, Chennubhotla CS, Agarwal PK |title=Protein conformational populations and functionally relevant substates |journal=Acc. Chem. Res. |volume=47 |issue=1 |pages=149–56 |year=2014 |pmid=23988159 |doi=10.1021/ar400084s |url=}}</ref> |
|||
===التعديل التفارغي=== |
|||
تمثل المواقع التفارغية جيوب على الإنزيم، تتميز عن المواقع النشطة أنها تربط الجزيئات في البيئة الخلوية، حيث تسبب هذه الجزيئات فيما بعد تغييراً في شكل أو ديناميكية الإنزيم، و ينتقل هذا التأثير إلى الموقع النشط، مما يؤدي إلى تغير معدل تفاعل الإنزيم.<ref>{{cite journal |vauthors=Tsai CJ, Del Sol A, Nussinov R |title=Protein allostery, signal transmission and dynamics: a classification scheme of allosteric mechanisms |journal=Mol Biosyst |volume=5 |issue=3 |pages=207–16 |year=2009 |pmid=19225609 |pmc=2898650 |doi=10.1039/b819720b |url=}}</ref> بهذه الطريقة تنشط التعديلات التفارغية أو تثبط الإنزيم. ترفع التعديلات التفارغية مع المستقبلات أو تخفض من استخدام مسار الإنزيم الاستقلابي، و هي آلية تلقيم راجع تنظم التفاعل و تبدّل نشاط الإنزيم تبعاً لما تنتجه المراحل اللاحقة من هذا المسار الإنزيمي.<ref>{{cite journal | vauthors = Changeux JP, Edelstein SJ | title = Allosteric mechanisms of signal transduction | journal = Science | volume = 308 | issue = 5727 | pages = 1424–8 | date = June 2005 | pmid = 15933191 | doi = 10.1126/science.1108595 | bibcode = 2005Sci...308.1424C }}</ref> |
|||
==العوامل المرافقة== |
|||
[[File:Transketolase + TPP.png|thumb|400px|alt=Thiamine pyrophosphate displayed as an opaque globular surface with an open binding cleft where the substrate and cofactor both depicted as stick diagrams fit into.|البنية الكيميائية للثايمين بيروفوسفات و بنية بروتين الترانسكيتولاز. اللون الأصفر العامل المرافق للثايمين بيروفوسفات و اللون الأسود إكسلولاز 5-فوسفات.]] |
|||
لا تحتاج بعض الإنزيمات إلى مكونات إضافية لإطهار نشاطها الكامل، بينما تتطلب بعض الإنزيمات وجود جزيئات غير بروتينية تدعى العوامل المرافقة.<ref>{{cite web |url=http://www.chem.qmul.ac.uk/iupac/bioinorg/CD.html#34 | title = Glossary of Terms Used in Bioinorganic Chemistry: Cofactor | accessdate = 30 October 2007 | last = de Bolster | first = M.W.G. | year = 1997 | publisher = International Union of Pure and Applied Chemistry | name-list-format = vanc }}</ref> يمكن أن تكون العوامل المرافقة مركبات عضوية (مثل الفلافين أو الهيم) أو غير عضوية (مثل أيونات المعادن). تقوم هذه العوامل المرافقة بالعديد من المهام للمساعدة في إنجاز مهمة الإنزيم. يمكن للعوامل المرافقة أن تكون مرافقات إنزيم يتم إطلاقها من موقع الإنزيم النشط أثناء التفاعل أو أن تكون مجموعات اصطناعية ترتبط بشدة بالإنزيم (كالبيوتين في إنزيمات كالبيروفات كاربوكسيلاز).<ref name="pmid10470036">{{cite journal | vauthors = Chapman-Smith A, Cronan JE | title = The enzymatic biotinylation of proteins: a post-translational modification of exceptional specificity | journal = Trends Biochem. Sci. | volume = 24 | issue = 9 | pages = 359–63 | year = 1999 | pmid = 10470036 | doi = 10.1016/s0968-0004(99)01438-3}}</ref> |
|||
[[ملف:Two substrates b ar.png|455بك|center|مخطط لتوضيح آلية التلاؤم المحرض لتفسير الآلية الحركية لعمل الأنزيمات.]] |
|||
مثال على إنزيم يحتوي على عامل مرافق هو الكاربونيك أنهيدراز و عامله المرافق الزنك المرتبط كجزء من موقعه النشط في الشكل أعلاه.<ref>{{cite journal | vauthors = Fisher Z, Hernandez Prada JA, Tu C, Duda D, Yoshioka C, An H, Govindasamy L, Silverman DN, McKenna R | title = Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II | journal = Biochemistry | volume = 44 | issue = 4 | pages = 1097–115 | date = February 2005 | pmid = 15667203 | doi = 10.1021/bi0480279 }}</ref> توجد عادةً الجزيئات أو الأيونات مرتبطة بشدةً بالموقع النشط للإنزيم لتشترك في التحفيز.<ref name = "Stryer_2002"/> |
|||
تُدعى الإنزيمات التي يتطلب نشاطها وجود عوامل مرافقة إلا أنه لا تمتلك عاملاً مرافقاً بأبوإنزيم أو أبوبروتينات. بينما يُدعى الإنزيم مع عامله المرافق معاً بالهولوإنزيم (أو هالوإنزيم)، كما يطلق مصطلح هولوإنزيم على الإنزيمات التي تشتمل على وحدات فرعية عديدة للبروتين مثلاً إنزيمات دنا بوليميراز، حيث أن الهولوإنزيم هو المعقد الكامل الذي يحتوي على كل الوحدات الفرعية المطلوبة في هذا النشاط.<ref name = "Stryer_2002"/> |
|||
===العوامل المرافقة للإنزيمات=== |
|||
العوامل المرافقة للإنزيمات جزيئات عضوية صغيرة ترتبط ارتباطاً شديداً أ, ضعيفاً بالإنزيم. تنقل العوامل المرافقة للإنزيم زمراً كيميائية من إنزيم إلى آخر.<ref name = "Wagner_1975">{{cite book | author = Wagner AL | title = Vitamins and Coenzymes | publisher = Krieger Pub Co | year = 1975 | isbn = 0-88275-258-8}}</ref> مثلاً NADH و NADPH و الأدينوزين ثلاثي الفوسفات ATP. تُشتق بعض العوامل المرافقة للإنزيمات من الفيتامينات مثلاً الفلافين أحادي النيكليوتيد FMN و الفلافين أدينين ثنائي النيكليوتيد FAD و الثيامين بيروفوسفات TPP و تيتراهيدروفولات THF، لا يمكن اصطناع هذه الإنزيمات المشتقة من الفيتامينات بشكل جديد de novo في الجسم، لذلك يجب الحصول على المكبات المرتبطة بها (الفيتامينات المشتقة منها) في حالات الحميات الغذائية. تشمل الزمر الكيميائية المحمولة أيون الهيدريد (H<sup>?</sup>) الذي تحمله مركبات NAD و NADP<sup>+</sup>، كذلك زمرة الفوسفات التي يحملها مركب الأدينوزين ثلاثي الفوسفات، زمرة الأستيل التي يحملها مرافق الإنزيم A، زمر الفورميل أو الميثينيل أو الميثيل يحملها حمض الفوليك، و كذلك يحمل أدينوزيل ميثيونين S زمرة الميثيل.<ref name = "Wagner_1975"/> |
|||
يمكن اعتبار العوامل المرافقة للإنزيمات نوعاً خاصاً من الركائز نظراً لتغيرها الكيميائي نتيجة التفاعل الإنزيمي، أو يمكن اعتبارها ركائز ثانوية شائعة للعديد من الإنزيمات، مثلاً NADH يستخدمها أ:ثر من 1000 إنزيم معروف حتى الآن.<ref>{{cite web | url = http://www.brenda-enzymes.org | title = BRENDA The Comprehensive Enzyme Information System | publisher = Technische Universit?t Braunschweig | accessdate = 23 February 2015 }}</ref> |
|||
يتم تجديد العوامل المرافقة للإنزيمات بشكل مستمر و تبقى تراكيزها في مستوى ثابت تقريباُ داخل الخلية. مثلاً يتجدد NADH عبر سبيل البنتوز فوسفات، كذلك أدينوزيل ميثيونين S يتجدد بواسطة الميثيونين أدينوزيلترانسفيراز. |
|||
==الديناميكا الحرارية== |
|||
اقترح كوشلاند فرضية معدلة عن فرضية القفل والمفتاح آخذا بعين الاعتبار حركية الجزيئات البروتينية، حيث افترض أن المتغير الضروري أن تناسب الركيزة تماما شكل موقع الارتباط، فالسلاسل الببتيدية في موقع الارتباط تستطيع أن تغير مواقعها لتلائم ارتباط بعض الركائز، كما أن هذه السلاسل الببتيدية تأخذ في شكلها الجديد وضعية تسهل عملها التحفيزي مما يؤدي إلى إنجاز التفاعل الكيميائي المطلوب. |
|||
[[File:Enzyme catalysis energy levels 2.svg|thumb|400px|alt=A two dimensional plot of reaction coordinate (x-axis) vs. energy (y-axis) for catalyzed and uncatalyzed reactions. The energy of the system steadily increases from reactants (x = 0) until a maximum is reached at the transition state (x = 0.5), and steadily decreases to the products (x = 1). However, in an enzyme catalysed reaction, binding generates an enzyme-substrate complex (with slightly reduced energy) then increases up to a transition state with a smaller maximum than the uncatalysed reaction.|طاقات مراحل التفاعل الكيميائي. الخط المتقطع يمثل طاقات مراحل تفاعل غير مُحفّز يحتاج لطاقة كبيرة للوصول إلى الحالة الانتقالية التي ما تلبث أن تتحلل إلى نواتجها منخفضة الطاقة. الخط الصلب يُمثّل تفاعلاً مُحفّزاً يربط فيه الإنزيم ركائزه (ES) و يؤسس للمرحلة الانتقالية (ES‡) و من ثم يحرر نواتج التفاعل ذات الطاقة المنخفضة (EP).]] |
|||
لا تغير الإنزيمات -كما كل الحفّازات- من اتجاه التفاعل الكيميائي، حيث يجري التفاعل في حالة وجود إنزيم في الاتجاه ذاته الذي كان سيسر فيه في حالة عدم وجود هذا الإنزيم، و لكن الفارق هو السرعة، حيث يزيد الإنزيم من سرعة التفاعل.<ref name = "Stryer_2002"/> مثلاً الكاربونيك أنهيدراز يحفّز تفاعله في أحد الاتجاهين اعتماداً على تراكيز المواد المتفاعلة:<ref>{{cite book |vauthors=McArdle WD, Katch F, Katch VL | title = Essentials of Exercise Physiology | date = 2006 | publisher = Lippincott Williams & Wilkins | location = Baltimore, Maryland | isbn = 978-0781749916 | pages = 312–3 | edition = 3rd | chapter = Chapter 9: The Pulmonary System and Exercise | chapterurl = https://books.google.com/books?id=L4aZIDbmV3oC&pg=PA313&lpg=PA313&dq=carbonic+anhydrase+lung+tissue+low+high+carbon+dioxide+equilibrium&source=bl&ots=WmoWpbFgYQ&hl=en&sa=X&redir_esc=y#v=onepage&q=carbonic%20anhydrase%20lung%20tissue%20low%20high%20carbon%20dioxide%20equilibrium&f=false}}</ref> |
|||
{{NumBlk|:| <math chem>\begin{matrix}{}\\ |
|||
== عوامل الأنزيم المرافقة == |
|||
\ce{{CO2} + H2O ->[\ce{Carbonic\ anhydrase}] H2CO3}\\ |
|||
{{مفصلة|عامل مرافق (كيمياء حيوية)}} |
|||
{}\end{matrix}</math> (CO<sub>2</sub> في الأنسجة يكون تركيز {{EquationRef|1}}}} |
|||
بعض الأنزيمات تستطيع أن تقوم لوحدها بالمهمة التحفيزية كاملة لكن هذه ليست حالة معظم الانزيمات فمعظم الأنزيمات تحتاج عوامل مرافقة تساعدها على انجاز التفاعلات، هذه العوامل المرافقة هي غالبا جزيئات غير بروتينية يمكننا تصنيفها في ثلاثة أقسام : |
|||
{{NumBlk|:| <math chem>\begin{matrix}{}\\ |
|||
منشطات الأنزيم، تَميمُ الإِنْزيم (كوأنزيم), مَجْمُوْعَةٌ ضَميمَة. |
|||
\ce{{CO2} + H2O <-[\ce{Carbonic\ anhydrase}] H2CO3}\\ |
|||
{}\end{matrix}</math> (في الرئتين يكون تركيز CO<sub>2</sub> منخفض)|{{EquationRef|2}}}} |
|||
تعتمد سرعة التفاعل على طاقة التنشيط المطلوبة للوصول إلى الحالة الانتقالية، التي تنتهي بإطلاق النواتج. تزيد الإنزيمات من سرعة التفاعلات عبر خفض طاقة الحالة الانتقالية. أولاً يقوم الإنزيم بعملية ربط الركيزة ليتشكل معقد إنزيم-تحت ركيزة منخفض الطاقة (ES).ثانياً يؤسس الإنزيم للحالة الانتقالية التي تتطلب طاقةً أقل لتنجز التفاعل من تلك الطاقة المطلوبة في حالة التفاعل غير المُحفّز (ES‡). أخيراً يتحلل المعقّد إنزيم-نواتج (EP) ليطلق النواتج.<ref name = "Stryer_2002"/> |
|||
يمكن أن تنجز الإنزيمات تفاعلين أو أكثر، حيث تقوم تحفّز تفاعلاً مناسباً من ناحية الديناميكا الحرارية،يمكن أن يُستخدم هذا التفاعل ليؤدي لحدوث تفاعل ثاني غير مناسب من ناحية الديناميكا الحرارية بحيث يكون إجمالي طاقة المنتجات أقل من طاقة الركائز. مثلاً التحلل المائي للأزينزوين ثلاثي الفوسفات ATP يؤدي لحدوث تفاعلات كيميائية أخرى.<ref name="Nicholls">{{cite book |vauthors=Ferguson SJ, Nicholls D, Ferguson S | title = Bioenergetics 3 | publisher = Academic | location = San Diego | year = 2002 | isbn = 0-12-518121-3 | edition = 3rd}}</ref> |
|||
==حركية الإنزيمات== |
|||
{{multiple image |
|||
== اصطلاحات تسمية الأنزيمات == |
|||
| direction= vertical |
|||
| width = 325 |
|||
| footer = |
|||
| image1 = Enzyme mechanism 2.svg |
|||
{| border=1 cellspacing="0" cellpadding=3 style="border:1px solid #808080; border-collapse: collapse;" |
|||
| alt1 = Schematic reaction diagrams for uncatalzyed (Substrate to Product) and catalyzed (Enzyme + Substrate to Enzyme/Substrate complex to Enzyme + Product) |
|||
|- |
|||
| caption1 = آلية التفاعل الكيميائي في حالتي وجود تحفيز إنزيمي أو عدم وجود. حيث يربط الإنزيم (E) الركيزة (S) لإنتاج نواتج التفاعل (P). |
|||
| align="center" bgcolor="#C0C0C0"|'''<font color="#FFFFFF">المجموعة</font> |
|||
| align="center" bgcolor="#C0C0C0" | '''<font color="#FFFFFF">التفاعل المحفز</font>''' |
|||
| align="center" bgcolor="#C0C0C0" | <font color="#FFFFFF">'''التفاعل النموذجي'''</font> |
|||
| align="center" bgcolor="#C0C0C0" | <font color="#FFFFFF">'''Enzyme example(s) with trivial name'''</font> |
|||
|- |
|||
| bgcolor="#E0E0E0" | EC 1 <br />''[[أوكسيدوريدوكتاز (أنزيمات الأكسدة-إرجاع)]]'' |
|||
| To catalyze تفاعلات [[تفاعلات أكسدة-اختزال|أكسدة]]/[[تفاعلات أكسدة-اختزال|إرجاع]] ; نقل لذرات H و O أو الكترونات من مادة لأخرى |
|||
| AH + B → A + BH (<small>'''<font color="#C0C0C0">reduced</font>'''</small>)<br />A + O → AO (<small>'''<font color="#C0C0C0">oxidized</font>'''</small>) |
|||
| [[ديهيدروجيناز]], [[أوكسيداز]] |
|||
|- |
|||
| bgcolor="#E0E0E0" | EC 2 <br />''[[ترانسفيراز (أنزيمات النقل]]'' |
|||
| نقل [[مجموعة وظيفية|زمرة وظيفية]] من مادة إلى أخرى another. The الزمرة قد تكون : متيل - أسيل - فوسفات |
|||
| AB + C → A + BC |
|||
| [[ترانسأميناز]], [[كيناز]] |
|||
|- |
|||
| bgcolor="#E0E0E0" | EC 3 <br />''[[هيدرولاز (أنزيمات الحلمهة)]]'' |
|||
| إنتاج مادتين من مادة واحدة بتفاعل الحلمهة |
|||
| AB + H<sub>2</sub>O → AOH + BH |
|||
| [[ليباز]], [[أميلاز]], [[بيبتيداز]] |
|||
|- |
|||
| bgcolor="#E0E0E0" | EC 4 <br />''[[لياز]]'' |
|||
| إضافة أو نزع لمجموعات بطريقة غير إماهية (دون تدخل جزيئة الماء: الروابط التالية C-C, C-N, C-O or C-S يمكن ان تكسر |
|||
| RCOCOOH → RCOH + CO<sub>2</sub> |
|||
|هيستادين دي كربوكسيلايز وجلوتامايت دي كربو كسيلايز |
|||
|- |
|||
| bgcolor="#E0E0E0" | EC 5 <br />''[[إيزوميراز (أنزيمات إعادة الترتيب)]]'' |
|||
| إعادة ترتيب داخل-جزيئي, i.e. [[تزامر]] يغير ترتيب المجموعات الوظيفية داخل الجزيئة الواحدة |
|||
| AB → BA |
|||
| [[ايزوميراز]], [[موتاز]] |
|||
|- |
|||
| bgcolor="#E0E0E0" | EC 6 <br />''[[ليغاز (أنزيمات الربط)]]s'' |
|||
| دمج جزيئتين مع بعضهما عن طريق تشكيل روابط جديدة تكافؤية من نوع C-O, C-S, C-N or C-C يترافق مع تحطم جزيئات [[أدينوسين ثلاثي الفوسفات|ATP]] لكسب الطاقة |
|||
| X + Y+ ATP → XY + ADP + Pi |
|||
| [[سينثيتاز]] |
|||
|} |
|||
| image2 = Michaelis Menten curve 2.svg |
|||
== أنواع الأنزيمات == |
|||
| alt2 = A two dimensional plot of substrate concentration (x axis) vs. reaction rate (y axis). The shape of the curve is hyperbolic. The rate of the reaction is zero at zero concentration of substrate and the rate asymptotically reaches a maximum at high substrate concentration. |
|||
| caption2 = منحنى إشباع تفاعل إنزيم يظهر العلاقة بين تركيز الركيزة و سرعة التفاعل. |
|||
}} |
|||
حركية الإنزيم هي التحقيق في كيفية ربط الإنزيم للركائز و تحويله إياهم إلى نواتج التفاعل. تستخدم بيانات سرعة التفاعل في تحليل حركية الإنزيم من خلال الحصول عليها عبر المقايسة الإنزيمية. اقترح ليونور ميكايليس و ماود مينتين نظرية كميّة للحركية الإنزيمية، يُشار إلى تلكالنظرية بـ"حركية مياكيليس و مينتين". <ref>{{cite journal | vauthors = Michaelis L, Menten M | year = 1913 | title = Die Kinetik der Invertinwirkung | journal = Biochem. Z. | volume = 49 | pages = 333–369 | language = German | trans-title = The Kinetics of Invertase Action }}; {{cite journal | vauthors = Michaelis L, Menten ML, Johnson KA, Goody RS | title = The original Michaelis constant: translation of the 1913 Michaelis-Menten paper | journal = Biochemistry | volume = 50 | issue = 39 | pages = 8264–9 | year = 2011 | pmid = 21888353 | pmc = 3381512 | doi = 10.1021/bi201284u }}</ref> كانت مساهمة ميكايليس و مينتين الأعظم هي تفكيرهما في أن تفاعل الإنزيم يجري على خطوتين. بدايةً ترتبط الركيزة بشكل عكوس بالإنزيم و يتشكّل معقد إنزيم-ركيزة، يُدعى أحياناً بمعقد ميكايليس-مينتين تكريماً لهما. يحفّز الإنزيم الخطوة الكيميائية في التفاعل و يطلق النواتج. طُوِّر هذا العمل بواسطة جورج إدوارد بريغز و جون هولدين، الذان اشتقا المعادلات الحركية التي ما تزال مُستخدمة حتى يومنا هذا.<ref>{{cite journal | vauthors = Briggs GE, Haldane JB | title = A Note on the Kinetics of Enzyme Action | journal = The Biochemical Journal | volume = 19 | issue = 2 | pages = 339–339 | year = 1925 | pmid = 16743508 | pmc = 1259181 | doi=10.1042/bj0190338}}</ref> |
|||
تعتمد سرعة الإنزيم على ظروف الذوبانية و تركيز الركيزة. لاكتشاف أعلى سرعة لتفاعلٍ إنزيميّ ما يتم زيادة تركيز الركيزة حتى تصبح سرعة تشكيل النواتج ثابتة. يظهر هذا في منحنى الإشباع إلى اليمين. يحدث الإشباع بسبب ازدياد تركيز الركيزة، و مع ازدياد تركيز الركيزة يزداد تحول الإنزم الحر إلى معقّد نزيم-ركيزة، عند الوصول إلى أعلى سرعة للإنزيم (Vmax) تكون جميع المواقع النشطة في الإنزيم مرتبطة بالركيزة، و كمية المعقّد هي كل كمية الإنزيم.<ref name = "Stryer_2002"/> |
|||
تعتبر أعظم سرعة للإنزيم ''V''<sub>max</sub> أحد مقاييس الحركية الإنزيمية المهمة. كذلك فإن تركيز الركيزة اللازم لتحقيق سرعة إنزيم معينة هي قيمة مهمة أيضاً، و هي تُعطى من ثابت ميكايليس-مينتين (''K''<sub>m</sub>)، و هو تركيز الركيزة المطلوب ليصل الإنزيم إلى نصف سرعة تفاعله العظمى، و يمتلك كل إنزيم قيمة Km مميزة لركيزة معينة. هناك ثابت آخر مهم هو ''k''<sub>cat</sub> و هو عدد جزيئات الركيزة التي يعالجها موقع نشط واحد في ثانية واحدة.<ref name = "Stryer_2002"/> |
|||
يمكن التعبير عن فعالية إنزيم باستخدام المصطلحات ''k''<sub>cat</sub>/''K''<sub>m</sub>. يدعى أيضاً يثابت النوعية و هو يدمج بين ثوابت سرعة كل خطوات التفاعل بما في ذلك أول خطوة غير عكوسة. يُستخدم ثابت النوعية للمقارنة بين الإنزيمات أو نفس الإنزيم بالنسبة لمختلف الركائز، و ذلك لأن ثابت النوعية يعكس القدرة على الجذب و التحفيز. يُدعى الحد الأقصى نظرياً لثابت النوعية بحد الانتشار و هو حوالي 10<sup>8</sup> إلى 10<sup>9</sup> (M<sup>?1</sup> s<sup>?1</sup>). عند هذا الحد يؤدي كل تصادم بين الركيزة و الإنزيم إلى تحفيز تفاعل، و يكون معدل تكوين النواتج غير محصور بمعدل التفاعل بل بحد الانتشار. تدعى الإنزيمات التي تتحلى بهذه الخاصية بالإنزيمات المثالية حركياً أو تحفيزياً. على سبيل المثال التريوز-فوسفات إيزوميراز، و الكاربونيك أنهيدراز، و الأستيل كولين إستيراز، و الكاتالاز، و الفوماراز، و بيتا لاكتاماز، و سوبر أكسيد ديسميوتاز.<ref name = "Stryer_2002"/> يمكن أن تصل قيمة ''k''<sub>cat</sub> لهذه الإ،زيمات حتى ملايين التفاعلات خلال ثانية.<ref name = "Stryer_2002"/> |
|||
تعتمد حركية ميكايليس-مينتين على قانون فاعلية الكتلة، المستمد من فرضيات الانتشار الحر و من ناحية الديناميكا الحرارية فهو مشتق من الاصطدام العشوائي. لكن العديد من العمليات الخلوية و الكيميائية الحيوية تنحرف بشكل كبير عن هذه الظروف، و ذلك بسبب الحشد الجزيئي الهائل و تقييد الحركة الجزيئية.<ref>{{cite journal | vauthors = Ellis RJ | title = Macromolecular crowding: obvious but underappreciated | journal = Trends in Biochemical Sciences | volume = 26 | issue = 10 | pages = 597–604 | date = October 2001 | pmid = 11590012 | doi = 10.1016/S0968-0004(01)01938-7 }}</ref> أُضيف إلى النموذج إضافات معقّدة في محاولة لتصحيح هذه التأثيرات.<ref>{{cite journal | vauthors = Kopelman R | title = Fractal reaction kinetics | journal = Science | volume = 241 | issue = 4873 | pages = 1620–26 | date = September 1988 | pmid = 17820893 | doi = 10.1126/science.241.4873.1620 | bibcode = 1988Sci...241.1620K }}</ref> |
|||
==التثبيط== |
|||
{{multiple image |
|||
| direction= vertical |
|||
| width = 400 |
|||
| footer = |
|||
| image1 = DHFR methotrexate inhibitor.svg |
|||
| alt1 = |
|||
| caption1 = يمكن للموقع الرابط في الإ،زيم، و الذي سيقوم في الحالة الطبيعية بربط الركيزة، يمكن له بدلاً من ذلك أن يربط مثبط تنافسي، يمنع بموجبه الركيزة من الارتباط. ثنائي هيدروفولات ريدوكتاز يُثبط بواسطة الميثوتركسات الذي يمنع ارتباط ركيزته و هي حمض الفوليك. اللون الأزرق الموقع الرابط. اللون الأخضر المثبط. اللون الأسود الركيزة.}}) |
|||
| image2 = Methotrexate vs folate 2.svg |
|||
| alt2 = Two dimensional representations of the chemical structure of folic acid and methotrexate highlighting the differences between these two substances (amidation of pyrimidone and methylation of secondary amine). |
|||
| caption2 = مرافق الإنزيم حمض الفوليك (اليسار) و العقار مضاد السرطان الميثوتركسات (اليمين) متشابهان جداً في البنية، تظهر الاختلافات في اللون الأخضر. بالنتيجة يمثل الميثوتركسات مثبط تنافسي للعديد من الإنزيمات التي تستخدم الفولات. |
|||
}} |
|||
يمكن أن تنفض سرعات تفاعل إنزيمي بمثبطات الإنزيم المتنوعة.<ref name = "Cornish-Bowden_2004">{{cite book | author = Cornish-Bowden A | title = Fundamentals of Enzyme Kinetics | date = 2004 | publisher = Portland Press | location = London | isbn = 1-85578-158-1 | edition = 3 }}</ref> |
|||
===أنماط المثبطات=== |
|||
====المثبط التنافسي==== |
|||
لا يمكن أن يرتبط المثبط التنافسي و الركيزة مع الإنزيم في الوقت ذاته.<ref name = "Price_1979">{{cite journal | vauthors = Price NC | year = 1979 | title = What is meant by 'competitive inhibition'? | journal = Trends in Biochemical Sciences | volume = 4 | issue=11 | pages = N272–N273 | doi = 10.1016/0968-0004(79)90205-6 }}</ref> معظم المثبطات التنافسية تشبه بشكل كبير ركائز الإنزيمات التي تثبطها. على سبيل المثال، عقار الميثوتركسات مثبط تنافسي لإنزيم ديهيدروفولات ريدوكتاز الذي يحفّز إرجاع ديهيدروفولات إلى تيتراهيدروفولات. في الشكل المجاور يظهر التشابه بين بنية الميثوتركسات و الديهيدروفولات. يمكن التغلب على التثبيط في هذه الحالة بزيادة تركيز الركيزة. في بعض الحالات يرتيط المثبط بموقع غير الموقع الرابط للركيزة المعتادة و يمارس تأثيراً تفارغياً يغير بموجبه الشكل المعتاد للموقع الرابط. |
|||
====المثبط غير التنافسي==== |
|||
يرتبط المثبط غير التنافسي بموقع غير موقع ربط الركيزة. ترتبط الركيزة و تتمتع بألفتها المعتادة و تبقى قيمة K<sub>m</sub> ذاتها. يقوم المثبط بخفض الفعالية التحفيزية للإنزيم فتنخفض بذلك قيمة السرعة العظمى V<sub>max</sub>. على النقيض من المثبط التنافسي، فإن المثبط غير التنافسي لا يمكن التغلب عليه عبر زيادة تركيز الركيزة.<ref name = "Cornish-Bowden_2004"/> |
|||
====مثبط ضد التنافسي==== |
|||
لا يستطيع المثبط ضد التنافسي أن يرتبط بالإنزيم الحر، بل يرتبط فقط بالمعقد إنزيم-ركيزة،و بالتالي فإن هذا النوع من المثبطات هو الأكثر فعالية في التراكيز المرتفعة من الركيزة. في وجود المثبط يصبح المعقد إنزيم-ركيزة غير فعّال.<ref name = "Cornish-Bowden_2004"/> إلا أن هذا النوع من المثبطات نادر.<ref>{{cite journal | vauthors = Cornish-Bowden A | title = Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides | journal = FEBS Letters | volume = 203 | issue = 1 | pages = 3–6 | date = July 1986 | pmid = 3720956 | doi=10.1016/0014-5793(86)81424-7}}</ref> |
|||
====مختلط==== |
|||
يرتبط المثبط المختلط بموقع تفارغي و يتآثر ارتباط الركيزة و ارتباط المثبط. تقلّ وظيفة الإنزيم و لكن لا تختفي عند ارتباط المثبط به. هذا النوع من الثبطات لا يتبع لمعادلة ميكايليس-مينتين.<ref name = "Cornish-Bowden_2004"/> |
|||
====المثبط غير العكوس===== |
|||
اليعطل المثبط غير العكوس الإنزيم بشكل دائم، و ذلك عادةً عبر تشكيل رابطة تساهمية للبروتين. من الأ/ثلة الشائعة عن هذه الطريقة أدوية البنسلين،<ref>{{cite journal | vauthors = Fisher JF, Meroueh SO, Mobashery S | title = Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity | journal = Chemical Reviews | volume = 105 | issue = 2 | pages = 395–424 | date = February 2005 | pmid = 15700950 | doi = 10.1021/cr030102i }}</ref> و الأسبرين.<ref name="Johnson">{{cite journal | vauthors = Johnson DS, Weerapana E, Cravatt BF | title = Strategies for discovering and derisking covalent, irreversible enzyme inhibitors | journal = Future Medicinal Chemistry | volume = 2 | issue = 6 | pages = 949–64 | date = June 2010 | pmid = 20640225 | pmc = 2904065 | doi=10.4155/fmc.10.21}}</ref> |
|||
===وظائف المثبطات=== |
|||
تعتبر المثبطات جزءاً من آليات التلقيم الراجع في العديد من الأحياء. فإذاا أنتج إنزيم ما كمية أكبر من اللازم لركيزة ما في الكائن الحي، يمكن لهذه المادة المنتجة أن تمارس دوراً مثبطاً لهذا الإنزيم في المراحل الأولى من المسار الإنتاجي، مما يؤدي لإبطاء إنتاج هذه المادة أو إيقافه عند وجود كمية كافية منها. يعتبر هذا شكلاً من أشكال التقليم الراجع السلبي. تستخدم مسارات الاستقلاب الرئيسية هذه الآلية.<ref name = "Stryer_2002" /> |
|||
بما أن مثبطات الإنزيم تعدل الوظيفة الإنزيمية فقد اِستُخدمت كأدوية. العديد من الأدوية هي مثبطات تنافسية عكوسة تشبه ركيزة الإنزيم الأصلية، كما هو الحال في مثال الميثوتركسات أعلاه، من الأمثلة المعروفة الأخرى الستاتينات التي تستخدم لمعالجة الكوليسترول المرتفع،<ref name="Endo1992">{{cite journal | author = Endo A | title = The discovery and development of HMG-CoA reductase inhibitors | journal = J. Lipid Res. | volume = 33 | issue = 11 | pages = 1569–82 | date = 1 November 1992 | pmid = 1464741 | url = http://www.jlr.org/cgi/reprint/33/11/1569 | format = PDF }}</ref> و مثبطات إنزيم البروتياز التي تستخدم لعلاج عدوى الفيروس العكسي كفيروس HIV.<ref>{{cite journal | vauthors = Wlodawer A, Vondrasek J | title = Inhibitors of HIV-1 protease: a major success of structure-assisted drug design | journal = Annual Review of Biophysics and Biomolecular Structure | volume = 27 | pages = 249–84 | date = 1998 | pmid = 9646869 | doi = 10.1146/annurev.biophys.27.1.249 }}</ref> أما الأسبرين فيعتبر مثالاً شائعاً للمثبطات الإنزيمية غير العكوسة التي تستعمل دوائياً، و هو يثبط إنزيمات COX-1 و COX-2 التي تنتج البروستاجلاندين رسول الالتهاب.<ref name="Johnson" /> المثبطات الإنزيمية الأخرى سموم، مثلاً سم السيانيد هو مثبط إنزيمي غير عكوس يجتمع مع النحاس و الحديد في الموقع النشط للإنزيم السيتوكروم سي أوكسيداز و يقوم بإحصار التنفس الخلوي.<ref>{{cite journal | vauthors = Yoshikawa S, Caughey WS | title = Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction | journal = The Journal of Biological Chemistry | volume = 265 | issue = 14 | pages = 7945–58 | date = May 1990 | pmid = 2159465 }}</ref> |
|||
==الوظيفة البيولوجية== |
|||
يقوم الإ،زيم بوظائف عديدة داخل الكائن الحي. فلا غنى عن الإنزيمات من أجل التنبيه الإشاري في التنظيم الخلوي و غالباً عبر إنزيمات الكيناز و الفوسفاتاز.<ref>{{cite journal | vauthors = Hunter T | title = Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling | journal = Cell | volume = 80 | issue = 2 | pages = 225–36 | date = January 1995 | pmid = 7834742 | doi = 10.1016/0092-8674(95)90405-0 }}</ref> كما أنها تقوم بتوليد الحركة عبر توليد التقلص العضلي و نقل المواد عبر الخلية كجزء من الهيكل الخلوي.<ref>{{cite journal | vauthors = Berg JS, Powell BC, Cheney RE | title = A millennial myosin census | journal = Molecular Biology of the Cell | volume = 12 | issue = 4 | pages = 780–94 | date = April 2001 | pmid = 11294886 | pmc = 32266 | doi = 10.1091/mbc.12.4.780 }}</ref> إنزيمات أخرى مرتبطة بـ ATP موجودة في غشاء الخلية و هي مضخات أيونية تقوم بالنقل الفاعل لهذه الأيونات عبر الغشاء. تشترك الإنزيمات كذلك في وظائف أكثر غرابةً كتوليد الضوء في اليراعات.<ref>{{cite journal | vauthors = Meighen EA | title = Molecular biology of bacterial bioluminescence | journal = Microbiological Reviews | volume = 55 | issue = 1 | pages = 123–42 | date = March 1991 | pmid = 2030669 | pmc = 372803 }}</ref> يمكن أن تحتوي الفيروسات أيضاً على إنزيمات تقوم بوظائف دخل الخلية المصابة مثل إنزيم HIV إنترغاز، و ترانسكريبتاز العكسي، أو لإطلاق الفيروس من الخلية مثل إنزيمات نيورامينيداز الخاص بفيروس الإنفلونزا.<ref name="pmid12370077">{{cite journal | vauthors = De Clercq E | title = Highlights in the development of new antiviral agents | journal = Mini Rev Med Chem | volume = 2 | issue = 2 | pages = 163–75 | year = 2002 | pmid = 12370077 | doi = 10.2174/1389557024605474 }}</ref> |
|||
في الحيوانات تظهر وظيفة هامة للإنزيمات في الجهاز الهضمي كإنزيمات الأميارز و البروتياز التي تقوم بتحطيم الجزيئات الكبيرة (النشاء و البروتينات على التوالي) إلى جزيئات صغيرة، لتتمكّن الأمعاء من امتصاصها. مثلاً جزيئات النشاء كبيرة جداً لتستطيع الأمعاء امتصاصها، تقوم الإنزيمات بحلمهة هذه سلاسل النشاء الطويلة إلى جزيئات صغيرة كالمالتوز و من ثم تنتهي إلى جزيئات غلوكوز هي قابلة للامتصاصا في الأمعاء. تختلف الإنزيمات الهاضمة باختلاف ركائزها. في المجترات ذات النظام الغذائي العاشب، تنتج الأحياءالدقيقة داخل أمعائها إنزيم السيللوز الذي يكسر جدران الخلايا النباتية في الألياف النباتية.<ref>{{cite journal | vauthors = Mackie RI, White BA | title = Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output | journal = Journal of Dairy Science | volume = 73 | issue = 10 | pages = 2971–95 | date = October 1990 | pmid = 2178174 | doi = 10.3168/jds.S0022-0302(90)78986-2 }}</ref> |
|||
===الاستقلاب=== |
|||
[[Image:Glycolysis metabolic pathway.svg|thumb|400px|alt=Schematic diagram of the glycolytic metabolic pathway starting with glucose and ending with pyruvate via several intermediate chemicals. Each step in the pathway is catalyzed by a unique enzyme.|المسار الاستقلابي لتحلل الغلوكوز يطلق طاقة عبر تحويل البيروفات إلى سلسلة من الستقبلات المتوسطة. كل تعديل كيميائي (صندوق أحمر) يتم تنفيذه بواسطة إنزيم مختلف.]] |
|||
===الاستقلاب=== |
|||
العديد من الإنزيمات يمكن أن تعمل معاً في تكامل من أجل صنع مسار استقلابي.<ref name = "Stryer_2002" /> في المسار الاستقلابي، يأخذ الإنزيم نواتج الإنزيم السابق كركيزة له، و من ثم تمرر نواتج التفاعل إلى الإنزيم الذي يليه ليستخدمه كركيزة. في بعض الأحيان قد يُحفّز التفاعل بأكثر من إنزيم بشكل متوازي، يسمح هذا التحفيز بتنظيم أكثر تعقيداً، على سبيل المثال انخفاض النشاط التفاعلي لأحد الإنزيمات بينما يستمر النشاط في إنزيم ثاني.<ref name="Rouzer_2009">{{cite journal | vauthors = Rouzer CA, Marnett LJ | title = Cyclooxygenases: structural and functional insights | journal = J. Lipid Res. | volume = 50 Suppl | issue = | pages = S29–34 | year = 2009 | pmid = 18952571 | pmc = 2674713 | doi = 10.1194/jlr.R800042-JLR200 }}</ref> |
|||
تحدد الإنزيمات الخطوات التي تحدث في هذه المسارات الاستقلابية. و بدون الإنزيمات لن تستمر العلميات الاستقلابية في الخطوات نفسها، و لايمكن حتى تنظشم الاستقلاب لتلبية احتياجات الخلية. معظم المسارات الاستقلابية المركزية تُنظَّم عبر خطوات مفتاحية، عبر الإنزيمات من خلال الإنزيمات ذات النشاط المرتبط بحلمهة ATP، لأن هذه التفاعلات تطلق كمية كبيرة من الطاقة، بينما يوجد تفاعلات أخرى غير مناسبة من ناحية الديناميكا الحرارية يمكن أن تقترن بحلمهة ATP، حيث تمثل حلمهة ATP شرارة كل أنماط التفاعلات الاستقلابية التي تليها.<ref name = "Stryer_2002" /> |
|||
===التحكم في النشاط=== |
|||
هناك خمسة طرق رئيسية للتحكم بنشاط الإنزيم في الخلية.<ref name = "Stryer_2002" /> |
|||
====التنظيم==== |
|||
يمكن للإنزيمات أن تكون منشطة أو مثبطة بواسطة جزيئات عديدة. على سبيل المثال المنتج (أو المنتجات)النهائي لأحد المسارات الاستقلابية غالباً هي مثبطات لواحد من الإنزيمات الأولى في هذا المسار، هذه الآلية من التنظيم تُدعى بالتلقيم الراجع السلبي، لأن كمية المنتج النهائي التي يتم إنتاجها يتم ضبطها عبر تركيز هذا المنتج.<ref name = "Suzuki_2015_8"/> يمكن لآلية التلقيم الراجع السلبي أن تضبط بشكل فعّال معدل تخليق المستقلبات المتوسطة تبعاً لطلب الخلايا. تساعد هذه الآلية في تخصيص فعّال للمواد و اقتصاد في الطاقة و تمنع تصنيع فائض من المنتجات النهائية. التحكم في الفعل الإنزيمي يساعد عفي الحفاظ على بيئة داخلية متوازنة في المتعضيات الحية كما كل أجهزةضبط الاستتباب الداخلي.<ref name = "Suzuki_2015_8"/> |
|||
====تعديل بعد الترجمة==== |
|||
تتضمن الأمثلة على آلية التعديل بعد الترجمة الفسفرة و الغلكزة.<ref name = "Suzuki_2015_8">{{cite book | author = Suzuki H | title = How Enzymes Work: From Structure to Function | publisher = CRC Press | location = Boca Raton, FL | year = 2015 | isbn = 978-981-4463-92-8 | chapter = Chapter 8: Control of Enzyme Activity | pages = 141–69 }}</ref> مثلاً في الاستجابة للإنسولين، تتم فسفرة إنزيمات متعددة بما في ذلك الغليكوجين سينثاز، تساعد هذه الفسفرة في التحكم في تصنيع أو تقويض الغليكوجين و تسمح للخلايا بالاستجابة للتغيرات في السكر الدم.<ref name = "Doble_2003">{{cite journal | vauthors = Doble BW, Woodgett JR | title = GSK-3: tricks of the trade for a multi-tasking kinase | journal = Journal of Cell Science | volume = 116 | issue = Pt 7 | pages = 1175–86 | date = April 2003 | pmid = 12615961 | pmc = 3006448 | doi = 10.1242/jcs.00384 }}</ref> مثالٌ آخر على التعديل بعد الترجمة هو تقسيم سلسلة عديد الببتيد، مثلاً إنزيم الكيموتربسين و هو من نوع إنزيمات البروتياز، يتم إنتاجه في البنكرياس و يكون اسمه الكيموترسينوجين أو مولد الكيموتربسين و هو الشكل غير الفعّال، و من ثم يُنقل و هو في الشكل غير الفعّال إلى المعدة حيث يتم تفعيله. هذا السلوك يمنع الإنزيم من هضم البنكرياس أو الأنسجة الأُخرى قبل أن يدخل لمعة المعي. هذا النمط من طليعة الإنزيم غير الفعّالة تُعرف باسم طليعة الإنزيم. |
|||
====الكمية==== |
|||
يمكن أن ينخفض أو يزداد إنتاج الإنزيم (نسخ و ترجمة جينات الإنزيم) في الخلية كاستجابة للتغيرات في بيئة الخلية. هذا النموذج من التنظيم الجيني يدعى بتحريض الإنزيم. مثلاً إنزيم السيتوكروم بي450 أوكسيداز في الكبد و هو مهم جداً في استقلاب الأدوية. يمكن أن يؤدي تحريض أو تثبيط هذه الإنزيمات إلى تداخلات دوائية.<ref name = "Skett_Gibson_2001">{{cite book |vauthors=Skett P, Gibson GG | title = Introduction to Drug Metabolism | date = 2001 | publisher = Nelson Thornes Publishers | location = Cheltenham, UK | isbn = 978-0748760114 | pages = 87–118 | edition = 3 | chapter = Chapter 3: Induction and Inhibition of Drug Metabolism }}</ref> مستويات الإنزيم يمكن أن تُنظم أيضاً عبر تغيير معدل تقويض الإنزيم.<ref name="Stryer_2002" /> |
|||
====التوزيع داخل الخلوي==== |
|||
يمكن أن تُجزأ الإنزيمات عبر مسارات استقلابية تحدث في الحجرات الخلوية المختلفة. مثلاً تُصنّع الحموض الدسمة بواسطة مجموعة واحدة من الإنزيمات في العصارة الخلوية و الشبكة الإندوبلاسمية و جهاز غولجي، بينم تستخدم من قبل مجموعة مختلفة من الإنزيمات كمصدر للطاقة في الميتاكوندريا عبر أكسدة بيتا.<ref>{{cite journal | vauthors = Faergeman NJ, Knudsen J | title = Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling | journal = The Biochemical Journal | volume = 323 | issue = Pt 1 | pages = 1–12 | date = April 1997 | pmid = 9173866 | pmc = 1218279 }}</ref> بالإضافة إلى ذلك فإن نقل الإنزيم إلى حجرات مختلفة يمكن أن يغير في درجة البروتونات (حيث السيتوبلاسم محايد بينما الليزوزوم حامضي) أو في الحالة التأكسدية، و هذا يؤثر على نشاط الإنزيم.<ref name = "Suzuki_2015_4">{{cite book | author = Suzuki H | title = How Enzymes Work: From Structure to Function | publisher = CRC Press | location = Boca Raton, FL | year = 2015 | isbn = 978-981-4463-92-8 | chapter = Chapter 4: Effect of pH, Temperature, and High Pressure on Enzymatic Activity | pages = 53–74 }}</ref> |
|||
====اختصاص الأعضاء==== |
|||
في عديدات الخلايا حقيقيات النوى، تمتلك الخلايا في النسج المختلفة أنماطاً مختلفة في التعبير الجيني، لذا فإنها تمتلك مجموعات مختلفة من الإنزيمات (تُعرف باسم الإيزوزيمات) متاحة للتفاعلات الاستقلابية. هذا يوفر آلية للتنظيم لكل استقلاب العضوية. مثلاً الهيكسوكيناز أول إنزيم في سبيل تحلل الغلوكوز له شكل خاص يدعى الغلوكوكيناز يتم التعبير عنه في الكبد و البنكرياس، لهذا الشكل من الإنزيم ألفة منخفضة للغلوكوز و لكنه أكثر حساسية لتركيز الغلوكوز.<ref>{{cite journal | vauthors = Kamata K, Mitsuya M, Nishimura T, Eiki J, Nagata Y | title = Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase | journal = Structure | volume = 12 | issue = 3 | pages = 429–38 | date = March 2004 | pmid = 15016359 | doi = 10.1016/j.str.2004.02.005 }}</ref> يشترك هذا الإنزيم في التحسس لسكر الدم و تنظيم إنتاج الأنسولين.<ref>{{cite journal | vauthors = Froguel P, Zouali H, Vionnet N, Velho G, Vaxillaire M, Sun F, Lesage S, Stoffel M, Takeda J, Passa P | title = Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus | journal = The New England Journal of Medicine | volume = 328 | issue = 10 | pages = 697–702 | date = March 1993 | pmid = 8433729 | doi = 10.1056/NEJM199303113281005 }}</ref> |
|||
===المشاركة في الأمراض=== |
|||
[[File:Phenylalanine hydroxylase mutations.svg|thumb|400px|alt= Ribbon diagram of phenylalanine hydroxylase with bound cofactor, coenzyme and substrate|في إنزيم الفينيل ألانين هيدروكسيلاز أكثر من 300 تغير في البنية تسبب بيلة فينيل كيتون. اللون الأسود ركيزة الفينيل ألانين و العامل المرافق للإنزيم تيتراهيدروبيوبترين، اللون الأصفر العامل المرافق الحديد Fe<sup>2+</sup>]] |
|||
يعتبر التحكم الصارم في نشاط الإنزيم أمراً ضرورياً للتوازن، حيث أن أي خلل (طفرة، أو إنتاج مفرط، أو إنتاج أقل، أو حذف) في إنزيم حرج واحد يقود إلى مرض وراثي. الخلل في نوع واحد من الإنزيمات من بين آلاف الأنواع الموجودة في جسم الإنسان يمكن أن يكون قاتلاً. من الأمثلة على الأمراض الوراثية القاتلة بسبب قصور إنزيم مرض تاي-ساكس حيث يكون لدى المريض عوز في إنزيم الهيسكوسامينيداز.<ref>{{cite journal | vauthors = Okada S, O'Brien JS | title = Tay-Sachs disease: generalized absence of a beta-D-N-acetylhexosaminidase component | journal = Science | volume = 165 | issue = 3894 | pages = 698–700 | date = August 1969 | pmid = 5793973 | doi=10.1126/science.165.3894.698| bibcode = 1969Sci...165..698O }}</ref><ref>{{cite web | title = Learning About Tay-Sachs Disease | url = http://www.genome.gov/10001220 | publisher = U.S. National Human Genome Research Institute | accessdate = 1 March 2015 }}</ref> |
|||
أحد أمثلة عوز الإنزيم هو النمط الأكثر شيوعاً من بيلة الفينيل كيتون. العديد من الطفرات في أحماض أمينية مفردة في إنزيم الفنيل ألانين هيدروكسيلاز، و هو الإنزيم الذي يحفز الخطوة الأولى في تقويض الفنيل ألانين، و هذا ما يؤدي إلى تراكم الفينيل ألانين و المنتجات ذات الصلة. توجد بعض الطفرات في الموقع النشط، تعطِّل بشكل مباشر الارتباط و التحفيز، و لكن العديد من الطفرات تكون بعيدة عن الموقع النشط و هي تقلل النشاط عبر زعزعة استقرار بنية البروتين، أو عبر آليات أخرى.<ref name=pmid10527663>{{cite journal | vauthors = Erlandsen H, Stevens RC | title = The structural basis of phenylketonuria | journal = Molecular Genetics and Metabolism | volume = 68 | issue = 2 | pages = 103–25 | date = October 1999 | pmid = 10527663 | doi = 10.1006/mgme.1999.2922 }}</ref><ref>{{cite journal | vauthors = Flatmark T, Stevens RC | title = Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms | journal = Chemical Reviews | volume = 99 | issue = 8 | pages = 2137–2160 | date = August 1999 | pmid = 11849022 | doi = 10.1021/cr980450y }}</ref> يمكن أن يؤدي هذا إلى إعاقة ذهنية إذا لم يتم علاج المرض.<ref>{{cite book | title = Genes and Disease [Internet] | chapterurl = http://www.ncbi.nlm.nih.gov/books/NBK22253/ | chapter = Phenylketonuria | publisher = National Center for Biotechnology Information (US) | location = Bethesda (MD) | year = 1998–2015 }}</ref> مثالٌ آخر هو عوز كولين إستيراز الكاذب، في هذه الحالة تضعف قدرة الجسم على تحطيم أدوية كولين إستير.<ref>{{cite web | title = Pseudocholinesterase deficiency | url = http://ghr.nlm.nih.gov/condition/pseudocholinesterase-deficiency | publisher = U.S. National Library of Medicine | accessdate = 5 September 2013 }}</ref> حالات قصور الإنزيمات الوظيفيةيمكن علاجها عبر الإعطاء الفموي للإنزيمات مثل قصور البنكرياس<ref>{{cite journal | vauthors = Fieker A, Philpott J, Armand M | title = Enzyme replacement therapy for pancreatic insufficiency: present and future | journal = Clinical and Experimental Gastroenterology | volume = 4 | pages = 55–73 | date = 2011 | pmid = 21753892 | pmc = 3132852 | doi = 10.2147/CEG.S17634 }}</ref> و عدم تحمل اللاكتوز.<ref>{{cite journal | vauthors = Misselwitz B, Pohl D, Frühauf H, Fried M, Vavricka SR, Fox M | title = Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment | journal = United European Gastroenterology Journal | volume = 1 | issue = 3 | pages = 151–9 | date = June 2013 | pmid = 24917953 | pmc = 4040760 | doi = 10.1177/2050640613484463 }}</ref> |
|||
كما أن هناك طرقاً أخرى تحدث أمراض فيها بسبب خلل إنزيمي يأتي منطفرات جرثومية في الجينات المرمّزة لإنزيمات إصلاحدنا. تسبب العيوب في هذه الإنزيمات سرطاناً لأن الخلايا تصبح أقل قدرةً على إصلاح الطفرات في جينوماتها. هذا يسبب تراكم بطيء للطفرات و يؤدي إلى تطور السرطانات. مثلاً متلازمة السرطان الوراثي هي جفاف الجلد المصطبغ، و هي تسبب تطور سرطانات الجلد استجابةً للحد الأدنى من التعرض للأشعة فوق البنفسجية.<ref>{{cite journal | vauthors = Cleaver JE | title = Defective repair replication of DNA in xeroderma pigmentosum | journal = Nature | volume = 218 | issue = 5142 | pages = 652–6 | date = May 1968 | pmid = 5655953 | doi = 10.1038/218652a0 | bibcode = 1968Natur.218..652C }}</ref><ref name="Andrews">{{cite book | last1 = James | first1 = William D | last2 = Elston | first2 = Dirk | last3 = Berger | first3 = Timothy G | title = Andrews' Diseases of the Skin: Clinical Dermatology | date = 2011 | publisher = Saunders/ Elsevier | location = London | isbn = 978-1437703146 | edition = 11th | page = 567 | name-list-format = vanc }}</ref> |
|||
==تطبيقات صناعية== |
|||
تستخدم الإنزيمات في الصناعات الكيمائية و التطبيقات الصناعية الأخرى عندما يكون هناك حاجة لمحفّزات نوعية للغاية. عموماً الإنزيمات محدودة في التفاعلات التي تحفّزها، لأنها تطورت لتحفز هذه التفاعلات بالإضافة إلى عدم استقرارها في المذيبات العضوية و في درجات الحرارة المرتفعة. نتيجةً لذلك، فإن هندسة البروتين هي مجال بحث نشيط يحاول أن يصنع إنزيمات جديدة إما من خلال تصميم عقلاني أو من خلال التطوير في المخبر.<ref>{{cite journal | vauthors = Renugopalakrishnan V, Gardu?o-Ju?rez R, Narasimhan G, Verma CS, Wei X, Li P | title = Rational design of thermally stable proteins: relevance to bionanotechnology | journal = Journal of Nanoscience and Nanotechnology | volume = 5 | issue = 11 | pages = 1759–1767 | date = November 2005 | pmid = 16433409 | doi = 10.1166/jnn.2005.441 }}</ref><ref>{{cite journal | vauthors = Hult K, Berglund P | title = Engineered enzymes for improved organic synthesis | journal = Current Opinion in Biotechnology | volume = 14 | issue = 4 | pages = 395–400 | date = August 2003 | pmid = 12943848 | doi = 10.1016/S0958-1669(03)00095-8 }}</ref> بدأت تلقى هذه الجهود نجاحاً، حيث قد تم بالفعل تصميم بعض الإنزيمات "من الصفر" لتحفيز تفاعلات لا تحدث في الطبيعة.<ref>{{cite journal | vauthors = Jiang L, Althoff EA, Clemente FR, Doyle L, R?thlisberger D, Zanghellini A, Gallaher JL, Betker JL, Tanaka F, Barbas CF, Hilvert D, Houk KN, Stoddard BL, Baker D | title = De novo computational design of retro-aldol enzymes | journal = Science | volume = 319 | issue = 5868 | pages = 1387–91 | date = March 2008 | pmid = 18323453 | pmc = 3431203 | doi = 10.1126/science.1152692 | bibcode = 2008Sci...319.1387J }}</ref> |
|||
{| class="wikitable" |
|||
|- style="text-align:center;" |
|||
! style="width:24%; "|التطبيق |
|||
! style="width:38%; "|الإنزيمات المستخدمة |
|||
! style="width:38%; "|الاستخدامات |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;" rowspan="2"|'''صناعة الوقود الحيوي''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات السيلولاز |
|||
| style="border-top:solid 3px #aaa;"|تحطيم السيللوز إلى جزيئات سكرية يمكن تخميرها للحصول على إيثانول سيللوزي.<ref name="cheng">{{cite journal | vauthors = Sun Y, Cheng J | title = Hydrolysis of lignocellulosic materials for ethanol production: a review | journal = Bioresource Technology | volume = 83 | issue = 1 | pages = 1–11 | date = May 2002 | pmid = 12058826 | doi = 10.1016/S0960-8524(01)00212-7 }}</ref> |
|||
|- valign="top" |
|||
| إنزيمات اللينغيناز |
|||
| المعالجة الأولية للكتلة الحيوية من أجل إنتاج الوقود الحيوي.<ref name="cheng" /> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;" rowspan="2"| '''المنظفات الحيوية''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات البروتياز، و الأميلاز، و الليباز |
|||
| style="border-top:solid 3px #aaa;"|إزالة البقع البروتينية و الدهنية و الزيتية و بقع النشاء من الغسيل و الأطباق.<ref name="Kirk">{{cite journal | vauthors = Kirk O, Borchert TV, Fuglsang CC | title = Industrial enzyme applications | journal = Current Opinion in Biotechnology | date = August 2002 | volume = 13 | issue = 4 | pages = 345–351 | doi = 10.1016/S0958-1669(02)00328-2| pmid = 12323357 }}</ref> |
|||
|- valign="top" |
|||
| إنزيمات المانّاز |
|||
| إزالة بقع الطعام من إضافات الطعام الشائعة صمغ الغوار.<ref name="Kirk" /> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;" rowspan="4"| '''صناعة الجعة''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات الأميلاز، و الغلوكوناز، و البروتياز |
|||
| style="border-top:solid 3px #aaa;"|تقسيم عديدات السكريات و البروتينات في الجعة.<ref name="briggs">{{cite book | last1 = Briggs | first1 = Dennis E. | title = Malts and Malting | date = 1998 | publisher = Blackie Academic | location = London | isbn = 978-0412298004 | edition = 1st | name-list-format = vanc }}</ref>{{rp|150–9}} |
|||
|- valign="top" |
|||
| إنزيمات بيتا غلوكاناز |
|||
| تحسين خصائص ترشيح النبتة و البيرة.<ref name="briggs" />{{rp|545}} |
|||
|- valign="top" |
|||
| إنزيمات الأميلوغلوكوزيداز، و البولولوناز |
|||
| صنع بيرة منخفضة السعرات الحرارية ضبط التخمير.<ref name="briggs" />{{rp|575}} |
|||
|- valign="top" |
|||
| إنزيمات أسيتولاكتات ثنائي كاربوكسيلاز (ALDC) |
|||
| زيادة فعالية التخمير عبر إنقاص تشكيل دي أستيل.<ref>{{cite journal | vauthors = Dulieu C, Moll M, Boudrant J, Poncelet D | title = Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling | journal = Biotechnology Progress | volume = 16 | issue = 6 | pages = 958–65 | pmid = 11101321 | doi = 10.1021/bp000128k | year=2000}}</ref> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;"|'''استخدامات في الطبخ''' |
|||
| style="border-top:solid 3px #aaa;"|باباين |
|||
| style="border-top:solid 3px #aaa;"|ترقيق اللحوم من أجل الطبخ.<ref>{{cite book | first1 = Rodrigo | last1 =Tarté | title = Ingredients in Meat Products Properties, Functionality and Applications | date = 2008 | publisher = Springer | location = New York | isbn = 978-0-387-71327-4 | pages = 177| name-list-format = vanc }}</ref> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;" rowspan="2"| '''إنتاج الحليب''' |
|||
| style = "border-top:solid 3px #aaa;"|الرينين (يسمى أيضاً الكيموسين) |
|||
| style="border-top:solid 3px #aaa;"|تحليل البروتين في تصنيع الجبن.<ref>{{cite web|url=http://www.gmo-compass.org/eng/database/enzymes/83.chymosin.html|accessdate=1 March 2015|date=10 July 2010|title=Chymosin – GMO Database|work=GMO Compass|publisher = European Union}}</ref> |
|||
|- valign="top" |
|||
| إنزيمات الليباز |
|||
| إنتاج جبن كامامبير و الأجبان الزرقاء كجبن روكفور.<ref>{{cite journal | vauthors = Molimard P, Spinnler HE | title = Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties | journal = Journal of Dairy Science | date = February 1996 | volume = 79 | issue = 2 | pages = 169–184 | doi = 10.3168/jds.S0022-0302(96)76348-8}}</ref> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;" rowspan="4"| '''معالجة الطعام''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات الأميلاز |
|||
| style="border-top:solid 3px #aaa;"|إنتاج السكريات من النشاء كما في صناعة شراب الذرة عالي الفركتوز.<ref>{{cite journal | vauthors = Guzm?n-Maldonado H, Paredes-L?pez O | title = Amylolytic enzymes and products derived from starch: a review | journal = Critical Reviews in Food Science and Nutrition | volume = 35 | issue = 5 | pages = 373–403 | date = September 1995 | pmid = 8573280 | doi = 10.1080/10408399509527706 }}</ref> |
|||
|- valign="top" |
|||
| إنزيمات البروتياز |
|||
| خفض مستوى البروتين في الدقيق كما هو الحال في صناعة البسكويت.<ref name="GMOdatabase" /> |
|||
|- valign="top" |
|||
||التربسين |
|||
|صناعة أطعمة الأطفال من أجل حالات الحساسية.<ref name="GMOdatabase">{{cite web | url = http://www.gmo-compass.org/eng/database/enzymes/94.protease.html | title = Protease – GMO Database | date = 10 July 2010 | work = GMO Compass | publisher = European Union | accessdate = 28 February 2015 }}</ref> |
|||
|- valign="top" |
|||
| إنزيمات السيلولاز، و البيكتيناز |
|||
| تنقية عصائر الفواكه.<ref>{{cite journal | vauthors = Alkorta I, Garbisu C, Llama MJ, Serra JL | title = Industrial applications of pectic enzymes: a review | journal = Process Biochemistry | date = January 1998 | volume = 33 | issue = 1 | pages = 21–28 | doi = 10.1016/S0032-9592(97)00046-0 }}</ref> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;"|'''البيولوجيا الجزيئية''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات النوكلياز، و دنا ليغاز، و البوليميراز |
|||
| style="border-top:solid 3px #aaa;"|استخدام الهضم المُقيَّد، و تفاعل بلمرة السلاسل لصناعة الحمض النووي.<ref name="Stryer_2002" />{{rp|6.2}} |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;"|'''صناعة الورق''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات الزيلاناز، و الهيميسيلولاز، و اللينغين بيروكسيداز |
|||
| style="border-top:solid 3px #aaa;"|إزالة الليجنين من عجينة ورق كرافت.<ref>{{cite journal | vauthors = Bajpai P | title = Application of enzymes in the pulp and paper industry | journal = Biotechnology Progress | volume = 15 | issue = 2 | pages = 147–157 | date = March 1999 | pmid = 10194388 | doi = 10.1021/bp990013k }}</ref> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;"|'''الرعاية الشخصية''' |
|||
| style="border-top:solid 3px #aaa;"|إنزيمات البروتياز |
|||
| style="border-top:solid 3px #aaa;"|إزالة البروتينات من العدسات اللاصقة لمنع العدوى.<ref>{{cite journal | vauthors = Begley CG, Paragina S, Sporn A | title = An analysis of contact lens enzyme cleaners | journal = Journal of the American Optometric Association | volume = 61 | issue = 3 | pages = 190–4 | date = March 1990 | pmid = 2186082 }}</ref> |
|||
|- valign="top" |
|||
| style="border-top:solid 3px #aaa;" rowspan="1"| '''صناعة النشاء''' |
|||
| style="border-top:solid 3px #aaa;"| إنزيمات الأميلاز |
|||
| style="border-top:solid 3px #aaa;"| تحويل النشاء إلى غلوكوز و شرابات مختلفة.<ref>{{cite book | editor1-last = BeMiller | editor1-first = James N. | editor2-last = Whistler | editor2-first = Roy L. | title = Starch Chemistry and Technology | date = 2009 | publisher = Academic | location = London | isbn = 9780080926551 | edition=3rd | name-list-format = vanc | last1 = Farris | first1 = Paul L. | chapter = Economic Growth and Organization of the U.S. Starch Industry }}</ref> |
|||
|} |
|||
انظر [[قائمة الإنزيمات|قائمة الأنزيمات]] |
|||
==مميزات الإنزيم == |
|||
* تسريع التفاعل |
|||
*يؤثر بكميات قليلة |
|||
* تأثيرها نوعي (لكل انزيم تاثير على مادة واحدة) |
|||
== مراجع == |
== مراجع == |
||
نسخة 23:57، 31 يوليو 2017

الإنزيمات محفِّزاتٌ بيولوجية جزيئية، تسرِّعُ التفاعلات الكيميائية. تُسمى الجزيئات التي تمارس الأنزيمات تأثيرها عليها بالركائز، حيث يحوّل الإنزيم الركيزة إلى جزيئات تُعرف باسم النواتج. تحتاج معظم عمليات الاستقلاب (الأيض) إلى إنزيمات من أجل أن تحدث بسرعة كافية للحفاظ على الحياة.[1]:8.1 تحدد الإنزيمات في الخلية أي مسار استقلابي سيحدث في تلك الخلية. تُعرف دراسة الإنزيمات بالإنزيمولوجي و هناك حقل جديد فيه لتحليل "الإنزيمات الكاذبة" ينمو باستمرار، حيث يدرس هذا الحقل الإنزيمات التي فقدت قدرتها التحفيزية البيولوجية خلال التطور و هذا غالباً يؤثر على تسلسلات الأحماض الأمينية و يعطيها خصائص تحفيزية كاذبة غير عادية.[2][3]
تُعرف الإنزيمات بقدرتها على تحفيز أكثر من 5000 نوع من التفاعلات الكيميائيةالحيوية.[4] معظم الإنزيمات بروتينات، و لكن بعضها جزيئات محفزة لرنا تدعى ريبوزومات. تأتي نوعية الإنزيمات من بينتها ثلاثية الأبعاد المميزة. تزيد الإنزيمات كما كل الحفّازات سرعة التفاعل من خلال تخفيض طاقة التنشيط. تصل قدرة بعض الإنزيمات حتى جعل تحوّل الركيزة إلى المنتج أسرع بملايين المرات من التحول دون وجود الإنزيم. أحد الأمثلة هو إنزيم أورتيدين 5'-فوسفات ديكربوكسيلاز الذي يسمح بتفاعل من الممكن خلال ثوانٍ، بينما سيتطلب هذا التفاعل دون الإنزيم ملايين السنين.[5][6] كيميائياً، لا تُستهلك الإنزيمات في التفاعلات الكيميائية و لا تقوم بتغيير التوازن في التفاعلات الكيميائية، كما كل الحفّازات الكيميائية. تتميز الإنزيمات عن بقية الحفّازات الكيميائية بنوعيتها الشديدة. يمكن أن يتأثر النشاط الإنزيمي بجزيئات معينة كالمثبطات التي تقلل من النشاط الإنزيمي، أو المنشطات التي تنشط عمل الإنزيم. الكثير من الأدوية العلاجية و السموم هي مثبطات إنزيمية. ينخفض النشاط الإنزيمي بشكل ملحوظ كذلك خارج درجة الحرارة و الحموضة المثاليتين. تُستخدم بعض الإنزيمات تجارياً، لتصنيع المضادات الحيوية مثلاً، حتى أن بعض المنتجات المنزلية تستخدم الإنزيمات لتسريع تفاعلات كيميائية معينة كبعض الإنزيمات الموجودة في مساحيق الغسيل الحيوية التي تحطم البروتينات أو النشاء أو الدهون الموجودة الي تسبب بقع الملابس.

بحلول أواخر القرن السابع عشر و بدايات القرن الثامن عشر، كان قد تم التعرّف على هضم المعدة للَّحم بواسطة مفرزاتها، [7] و تحويل النشاء إلى سكاكر عبر المستخلصات النباتية و اللعاب، إلا أن الآليات التي يتم من خلالها هذا كانت مجهولة..[8] كان الكيميائي الفرنسي أنسيلم باين أول من اكتشف إنزيماً و هو إنزيم دي أسيتاز عام 1833[9] بعد عدّة عقود و أثناء دراسة تخمّر السكر و تحوله إلى كحول بواسطة الخميرة، خلص لويس باستر أن قوةً حيوية هي من تسبب هذا التخمّر و هي موجودة في خلايا الخميرة، أطلق على هذه القوة اسم "Ferments" "التخمّر"، و اِعْتُقِدَ أن التخمّر وظيفة موجودة فقط في الكائنات الحيّة. كتب باستر أن "التخمّر الكحولي فعل مرتبط بحياة و تنظيم خلايا الخميرة، و ليس مرتبطاً بموت أو تعفّن هذه الخلايا."
[10] عام 1877، استخدم الفيزيولوجي الألماني Wilhelm Kühne (1830-1900( المصطلح "إنزيم" للمرة الأولى، مشتَقَّةً من الكلمة اليونانية (???????)، و التي تعني "مُخمَّر" أو "في الخميرة"، و قد استخدم هذا المصطلح النشاط كيميائي تقوم به الكائنات الحية.[11]
قدّم إدوارد بوخنر أول ورقة له عن دراسة مستخلصات الخمائر عام 1897. وجد بوخنر في سلسلة من التجارب التي أُجريت في جامعة برلين أن السكر تخمّر بواسطة مستخلصات الخمائر حتى عندما لم يحتوِ المزيج على خلايا خمائر حيّة [12] و أطلق اسم "زيماز" على الإنزيم الذي خمّر السكروز.[13] تلقى بوخنر جائزة نوبل في الكيمياء عام 1907 عن "اكتشافه التخمّر دون الخلايا". سُمِّيت الإنزيمات بعد بوخنر تبعاً للتفاعل الذي تقوم بإجراءه، حيث اِصطُلح على إدماج اللاحقة "ase" "از"مع اسم الركيزة (مثلاً اللاكتاز هو الإنزيم الذي يقسم اللاكتوز) أو مع اسم التفاعل (مثلاً دنا بوليميراز يقوم بتشكيل بوليميرات الحمض النووي منقوص الأوكسجين).[14]
لم يتم التعّرف على الهوية الكيمائية الحيوية للإنزيمات في بدايات القرن العشرين، على الرغم من أن الكثير من العلماء لاحظوا النشاط الإنزيمي الذي كان مترافقاً مع البروتينات، و لكن بعض العلماء الآخرين (منهم الحائز على جائزة نوبل ريتشارد فيلستاتر) جادلوا في أن البروتينات عبارة عن ناقلة للإنزيمات الحقيقية و أن البروتينات غير قادرة على التحفيز.[15] أظهر جيمس بي. سيمنر عام 1926 أن إنزيم اليوراز بروتينٌ نقيّ و قام ببلورته، قام بالمثل أيضاً عام 1937 مع إنزيم الكاتالاز. أثبت جون هوارد نورثروب و فيندل ميردريث ستانلي اللذان عملا على إنزيم الببسين الهاضم عام 1930 و إنزيم الكيموتربسين و التريبسين، أثبتا أن البروتينات النقية يمكن أن تكون إنزيمات. حصل هؤلاء العلماء الثلاثة على جائزة نوبل في الكيمياء عام 1946.">"Nobel Prizes and Laureates: The Nobel Prize in Chemistry 1946". Nobelprize.org. اطلع عليه بتاريخ 2015-02-23.</ref>
مكّن اكتشاف إمكانية بلورة الإنزيمات، مكّن من تحليل بنى الإنزيمات بدراسة البلورات بواسطة الأشعة السينية، و تم القيام بهذا الأمر للمرة الأولى من أجل دراسة إنزيم الليزوزوم، و هو إنزيم موجود في اللعابو الدموع و بياض البيض و يقوم هذا الإنزيم بهضم معطف بعض أنواع البكتيريا، حيث تم فهم هيكل هذا الإنزيم من قبل مجموعة من العلماء يقودهم دافيد تشيلتون فيليبس، و نُشر الأمر 1965.[16] شكّل هيكل الليزوزوم عالي الدقة بدايةً لحقل البيولوجيا الهيكلية و بدايةً لجهود فهم كيف تعمل الإنزيمات على المستوى الذري.[17]
اصطلاحات التسمية
يُشتق اسم الإنزيم غالباً من ركيزته أو التفاعل الكيميائي الذي يحفّزه، مع اللاحقة "از" "ase" في النهاية.[1] و من الأمثلة على ذلك اللاكتاز و الكحول ديهيدروجناز و دنا بوليميراز. تُسمَّى الإنزيمات المختلفة التي تحفّز التفاعل الكيميائي نفسه بالإيزوزيمات.[1] طوّر الاتحاد الدولي للكيمياء الحيوية و البيولوجية الجزيئية نظام تسمية الإنزيمات، و هو أرقام التصنيف الإنزيمي، حيث يُوصف كل إنزيم بواسطة تسلسل من أربعة أرقام مسبوقة بالسابقة "EC". يصنِّف الرقم الأول الإنزيمات على أساس آلية عملها.[18] أعلى مستوى للتصنيف هو:
- EC1 أنزيمات أكسدة-إرجاع: تحفّز تفاعلات الأكسدة-إرجاع
- EC2 إنزيمات الترانسفيراز: ينقل زمرة وظيفية (كزمرة الميثيل أو الفوسفات)
- EC3 إنزيمات هيدرولاز : تحفّز تفاعلات التحلل المائي للعديد من الروابط
- EC4 إنزيمات اللياز: تقوم بإنشاء العديد من الروابط بوسائل غير التحلل المائي أو الأكسدة
- EC5 إنزيمات الإيزوميراز: تحفّز التغيرات التصاوغية في جزيئة واحدة
- EC6 أنزيمات الليغاز: تربط جزيئتين بواسطة رابطة تساهمية
هناك تقسيم فرعي لهذه الأقسام بحسب خصائص أخرى كالركيزة و النواتج و الآلية الكيميائية. فالإنزيم نوعي لأربعة خصائص تصفها الخانات الأربعة في رقم التصنيف الإنزيمي. على سبيل المثال، الهكسوكيناز (EC 2.7.1.1) إنزيم ترانسفيراز أي إنزيم ناقل، يضيف مجموعة الفوسفات (EC 2.7) إلى جزيء الهكسوز، و الهكسوز هو جزيء يحتوي على مجموعة كحولية (EC 2.7.1).[19]
البنية

عموماً تكون الإنزيمات بروتينات كروية، تمارس تأثيرها بمفردها أو في معقّدات أكبر. يحدد تسلسل الحموض الأمينية هيكل الإنزيم، و الذي بدوره يحدد نشاطه التحفيزي.[20] على الرغم من أن البنية تحدد الوظيفة الإنزيمية، إلا أنه لا يُمكن التنبؤ بكامل النشاط الإنزيمي بواسطة البنية فقط.[21] يتمسخ الإنزيم عند التسخين أو عند التعرّض لممسخات كيميائية، ما يؤدي لحدوث خلخلة في بنية الإنزيم، يفقد الإنزيم بسببها نشاطه.[22] يرتبط تمسّخ الإنزيمات بدرجات الحرارة الأعلى من الأنواع الشائعة، لذلك فإن الإنيمات التي تُستحصل من بكتيريا البيئات البركانية كالينابيع الساخنة تُعتبر ثمينة للغاية لقدرتها على القيام بوظائفها في ظل درجات حرارة عالية، مما يسمح للتفاعلات التي يشرف عليها الإنزيم بالحدوث بمعدّلات عالية جداً. عادةً تكون الإنزيمات أكبر بكثير من ركائزها. تتفاوت أحجام الإنزيمات بين ثمالة من الأحماض الأمينية في وحيدة -أوكسالوكروتونات توتوميراز، [23] حتى أكثر من 2500 ثمالة في تصنيع الأحماض الدهنية الحيوانية.[24] يشترك في عملية التحفيز جزء صغير فقط من بنيتها (حوالي 2 إلى 4 حموض أمينية) و هو يسمى الموقع الحفّاز.[25] يقع الموقع الحفّاز قريباً من موقع رابط أو أكثر حيث توجّه الثمالات الركائز. يشكل الموقع الحفّاز و الموقع الرابط سويةً الموقع النشط في الإنزيم. معظم ما تبقى من بنية الإنزيم تخدم في الحفاظ على التوجيه الدقيق و ديناميكية الموقع النشط.[26]
في بعض الإنزيمات لا تشارك الأحماض الأمينية في التحفيز بشكل مباشر، بل يحتوي الإنزيم على مواقع تربط و توجه العوامل المحفّزة، أي أنه ينشط التفاعل بشكل غير مباشر.[26] يمكن أن تحتوي بنى الإنزيمات أيضاً على مواقع تفارغية حيث يؤدي ربط جزيء صغير إلى إحداث تغيير في التركيب يزيد أو يُنقص النشاط.[27] الريبزيمات هي مجموعة صغيرة من المحفزات الحيوية التي تحفز تفاعلات رنا، يمكن أن يكون الإنزيم مفرداً أو ضمن معقّد. أشيع هذه الإنزيمات هو الريبوزوم و هو معقّد من البروتينات و مكّونات محفزة لرنا.[1]
الآلية

ربط الركيزة
يجب أن تربط الإنزيمات ركائزها قبل أن تحفّز تفاعلاتها.عادةً ما تكون الإنزيمات نوعية جداً بالنسبة لركائزها التي تربطها و التفاعلات التي تحفّزها. تتحدد هذه النوعية بجيوب الربط ذات الشكل و الشحنة الملائمين بالإضافة إلى الصفة المحبة أو الكارهة للماء، بناء على الصفات السابقة تستطيع الإنزيمات التفريق بين الركائز المتشابهة جداً.[28]
تكون الإنزيمات المشاركة في عملية النسخ و تعبير الجينوم عالية الدقة و النوعية، حيث تمتلك بعض هذه الإنزيمات آلية "القراءة للإثبات" مثل إنزيم دنا بوليميراز الذي يحفّز تفاعلاً أولاً و من ثم يتأكد من كون المنتج صحيحاً.[29] تؤدي هاتان الخطوتان إلى معدّل أخطاء أقل من 1 إلى 100 مليون تفاعل في بوليميراز عالية الدقة عند الثدييات.[1] هناك آليات تأكد شبيهة موجودة في رنا بوليميراز،[30] و أمينو أسيل رنا الناقل سينثيتازات،[31] و الريبوزومات.[32] و على العكس من ذلك يوجد العديد من الإنزيمات التي تظهر اختلاطاً إنزيمياً، حيث تمتلك نوعية واسعة و تمارس تأثيراً على ركائز عديدة مختلفة فيزيولوجياً. تؤدي العديد من الإنزيمات إلى حدوث نشاطات جانبية صغيرة، و قد تمثل هذه النشاطات نقطة بداية لانتقاء تطوّري لوظيفة جديدة.[33][34]

نموذج القفل و المفتاح
لشرح النوعية الملحوظة للإنزيمات اقترح إميل فيتشر عام 1894 أن للإنزيم و الركيزة أشكال هندسية محددة تناسب بعضها بعضاً.[35] تمت الإشارة إلى هذه الفكرة بـ"نموذج القفل و الفتاح".[1] نجح هذا النموذج في تفسير نوعية الإنزيمات إلا أنه فشل في تفسير استقرار الحالة الانتقالية التي تحققها الإنزيمات.[36]
نموذج التلاؤم المُستحث
اقترح دانيال كوشلاند عام 1958 تعدلاً على نموذج القفل و المفتاح لأن هياكل الإنزيمات مرنة نوعاً ما، حيث يتغير شكل الموقع النشط باستمرار من خلال التفاعل مع الركيزة.[37] و بالنتيجة فإن الركيزة لا ترتبط ببساطة بموقع نشط جامد، أن السلاسل الجانبية للحموض الأمينية التي تكوّن الموقع النشط تتوضع في أماكن معينة بدقة بالغة حتى تمكّن الإنزيم من أداء وظيفته التحفيزية. يتغير شكل الركيزة أيضاً في بعض الحالات بمجرد دخولها للموقع النشط مثل إنزيم الغلوكوزيداز.[38] يستمر الموقع النشط بتغيير شكله حتى ترتبط الركيزة بشكل تام و توفق هذه اللحظة تحديد الشكل النهائي و توزع الشحنات.[39] يزيد التلاؤم المُستحث من دقة التعرّف الجزيئي في ظل وجود منافسة و ضوضاء جزيئية، و هذا يكسب التفاعلات التي تتم بإشراف الإنزيم تدقيقاً للركائز.[40]
التحفيز
تحفّز الإنزيمات التفاعلات بطرائق عدة، تشترك هذه الطرق جميعها بمحلة خفض طاقة التنشيط.[41]
- عبر تثبيت الحالة الانتقالية:
- خلق بيئة مع توزع شحنات متكاملان مع الحالة الانتقالية لتخفيض طاقة التنشيط.[42]
- عبر توفير مسار تفاعلي بديل:
- يتم إحداث تفاعل مؤقت مع الركيزة، و يتشكل عبر هذا التفاعل وسيط يساهم في توفير طاقة تنشيط أقل للحالة الانتقالية.[43]
- عبر زعزعة استقرار الحالة الأرضية للركيزة:
- دفع الركيزة المرتبطة إلى الحالة الانتقالية لتقليل الطاقة المطلوبة للوصول إلى الحالة الانتقالية.[44]
- عبر توجيه الركائز إلى التفاعلات المنتجة لتقليل تغير إنتروبية التفاعل.[45] مساهمة هذه الآلية في التحفيز ضئيلة نسبياً.[46]
قد تستخدم الإنزيمات العديد من هذه الآليات في وقت واحد.
الدينامية
الإنزيمات ليست هياكل جامدة ثابتة، بل على العكس من ذلك فإن للإنزيمات حركة ديناميكية داخلية معقدة، حيث تتحرك أجزاء من بنية الإنزيم كثمالات الأحماض الأمينية المفردة، أو الزمر لتشكل عروة بروتينية أو وحدة بنية ثانوية أو حتى نطاق بروتين كامل. تؤدي هذه الحركات إلى مجموعة متجانسة من البنى البروتينية المختلفة قليلاً التي تتداخل مع بعضها البعض عند التوازن. تؤدي هذه الحركات إلى اختلافات في وظائف الإنزيم باختلاف الحالات. على سبيل المثال إنزيم ديهيدروفولات ريدوكتاز يقوم بربط الركيزة و يحفّز و يطلق العامل المرافق و يطلق المنتج خلال دورة تحفيزه.[47]
التعديل التفارغي
تمثل المواقع التفارغية جيوب على الإنزيم، تتميز عن المواقع النشطة أنها تربط الجزيئات في البيئة الخلوية، حيث تسبب هذه الجزيئات فيما بعد تغييراً في شكل أو ديناميكية الإنزيم، و ينتقل هذا التأثير إلى الموقع النشط، مما يؤدي إلى تغير معدل تفاعل الإنزيم.[48] بهذه الطريقة تنشط التعديلات التفارغية أو تثبط الإنزيم. ترفع التعديلات التفارغية مع المستقبلات أو تخفض من استخدام مسار الإنزيم الاستقلابي، و هي آلية تلقيم راجع تنظم التفاعل و تبدّل نشاط الإنزيم تبعاً لما تنتجه المراحل اللاحقة من هذا المسار الإنزيمي.[49]
العوامل المرافقة

لا تحتاج بعض الإنزيمات إلى مكونات إضافية لإطهار نشاطها الكامل، بينما تتطلب بعض الإنزيمات وجود جزيئات غير بروتينية تدعى العوامل المرافقة.[50] يمكن أن تكون العوامل المرافقة مركبات عضوية (مثل الفلافين أو الهيم) أو غير عضوية (مثل أيونات المعادن). تقوم هذه العوامل المرافقة بالعديد من المهام للمساعدة في إنجاز مهمة الإنزيم. يمكن للعوامل المرافقة أن تكون مرافقات إنزيم يتم إطلاقها من موقع الإنزيم النشط أثناء التفاعل أو أن تكون مجموعات اصطناعية ترتبط بشدة بالإنزيم (كالبيوتين في إنزيمات كالبيروفات كاربوكسيلاز).[51] مثال على إنزيم يحتوي على عامل مرافق هو الكاربونيك أنهيدراز و عامله المرافق الزنك المرتبط كجزء من موقعه النشط في الشكل أعلاه.[52] توجد عادةً الجزيئات أو الأيونات مرتبطة بشدةً بالموقع النشط للإنزيم لتشترك في التحفيز.[1] تُدعى الإنزيمات التي يتطلب نشاطها وجود عوامل مرافقة إلا أنه لا تمتلك عاملاً مرافقاً بأبوإنزيم أو أبوبروتينات. بينما يُدعى الإنزيم مع عامله المرافق معاً بالهولوإنزيم (أو هالوإنزيم)، كما يطلق مصطلح هولوإنزيم على الإنزيمات التي تشتمل على وحدات فرعية عديدة للبروتين مثلاً إنزيمات دنا بوليميراز، حيث أن الهولوإنزيم هو المعقد الكامل الذي يحتوي على كل الوحدات الفرعية المطلوبة في هذا النشاط.[1]
العوامل المرافقة للإنزيمات
العوامل المرافقة للإنزيمات جزيئات عضوية صغيرة ترتبط ارتباطاً شديداً أ, ضعيفاً بالإنزيم. تنقل العوامل المرافقة للإنزيم زمراً كيميائية من إنزيم إلى آخر.[53] مثلاً NADH و NADPH و الأدينوزين ثلاثي الفوسفات ATP. تُشتق بعض العوامل المرافقة للإنزيمات من الفيتامينات مثلاً الفلافين أحادي النيكليوتيد FMN و الفلافين أدينين ثنائي النيكليوتيد FAD و الثيامين بيروفوسفات TPP و تيتراهيدروفولات THF، لا يمكن اصطناع هذه الإنزيمات المشتقة من الفيتامينات بشكل جديد de novo في الجسم، لذلك يجب الحصول على المكبات المرتبطة بها (الفيتامينات المشتقة منها) في حالات الحميات الغذائية. تشمل الزمر الكيميائية المحمولة أيون الهيدريد (H?) الذي تحمله مركبات NAD و NADP+، كذلك زمرة الفوسفات التي يحملها مركب الأدينوزين ثلاثي الفوسفات، زمرة الأستيل التي يحملها مرافق الإنزيم A، زمر الفورميل أو الميثينيل أو الميثيل يحملها حمض الفوليك، و كذلك يحمل أدينوزيل ميثيونين S زمرة الميثيل.[53] يمكن اعتبار العوامل المرافقة للإنزيمات نوعاً خاصاً من الركائز نظراً لتغيرها الكيميائي نتيجة التفاعل الإنزيمي، أو يمكن اعتبارها ركائز ثانوية شائعة للعديد من الإنزيمات، مثلاً NADH يستخدمها أ:ثر من 1000 إنزيم معروف حتى الآن.[54] يتم تجديد العوامل المرافقة للإنزيمات بشكل مستمر و تبقى تراكيزها في مستوى ثابت تقريباُ داخل الخلية. مثلاً يتجدد NADH عبر سبيل البنتوز فوسفات، كذلك أدينوزيل ميثيونين S يتجدد بواسطة الميثيونين أدينوزيلترانسفيراز.
الديناميكا الحرارية

لا تغير الإنزيمات -كما كل الحفّازات- من اتجاه التفاعل الكيميائي، حيث يجري التفاعل في حالة وجود إنزيم في الاتجاه ذاته الذي كان سيسر فيه في حالة عدم وجود هذا الإنزيم، و لكن الفارق هو السرعة، حيث يزيد الإنزيم من سرعة التفاعل.[1] مثلاً الكاربونيك أنهيدراز يحفّز تفاعله في أحد الاتجاهين اعتماداً على تراكيز المواد المتفاعلة:[55]
-
(CO2 في الأنسجة يكون تركيز
({{{3}}})
-
(في الرئتين يكون تركيز CO2 منخفض)
(2)
تعتمد سرعة التفاعل على طاقة التنشيط المطلوبة للوصول إلى الحالة الانتقالية، التي تنتهي بإطلاق النواتج. تزيد الإنزيمات من سرعة التفاعلات عبر خفض طاقة الحالة الانتقالية. أولاً يقوم الإنزيم بعملية ربط الركيزة ليتشكل معقد إنزيم-تحت ركيزة منخفض الطاقة (ES).ثانياً يؤسس الإنزيم للحالة الانتقالية التي تتطلب طاقةً أقل لتنجز التفاعل من تلك الطاقة المطلوبة في حالة التفاعل غير المُحفّز (ES‡). أخيراً يتحلل المعقّد إنزيم-نواتج (EP) ليطلق النواتج.[1] يمكن أن تنجز الإنزيمات تفاعلين أو أكثر، حيث تقوم تحفّز تفاعلاً مناسباً من ناحية الديناميكا الحرارية،يمكن أن يُستخدم هذا التفاعل ليؤدي لحدوث تفاعل ثاني غير مناسب من ناحية الديناميكا الحرارية بحيث يكون إجمالي طاقة المنتجات أقل من طاقة الركائز. مثلاً التحلل المائي للأزينزوين ثلاثي الفوسفات ATP يؤدي لحدوث تفاعلات كيميائية أخرى.[56]
حركية الإنزيمات
حركية الإنزيم هي التحقيق في كيفية ربط الإنزيم للركائز و تحويله إياهم إلى نواتج التفاعل. تستخدم بيانات سرعة التفاعل في تحليل حركية الإنزيم من خلال الحصول عليها عبر المقايسة الإنزيمية. اقترح ليونور ميكايليس و ماود مينتين نظرية كميّة للحركية الإنزيمية، يُشار إلى تلكالنظرية بـ"حركية مياكيليس و مينتين". [57] كانت مساهمة ميكايليس و مينتين الأعظم هي تفكيرهما في أن تفاعل الإنزيم يجري على خطوتين. بدايةً ترتبط الركيزة بشكل عكوس بالإنزيم و يتشكّل معقد إنزيم-ركيزة، يُدعى أحياناً بمعقد ميكايليس-مينتين تكريماً لهما. يحفّز الإنزيم الخطوة الكيميائية في التفاعل و يطلق النواتج. طُوِّر هذا العمل بواسطة جورج إدوارد بريغز و جون هولدين، الذان اشتقا المعادلات الحركية التي ما تزال مُستخدمة حتى يومنا هذا.[58] تعتمد سرعة الإنزيم على ظروف الذوبانية و تركيز الركيزة. لاكتشاف أعلى سرعة لتفاعلٍ إنزيميّ ما يتم زيادة تركيز الركيزة حتى تصبح سرعة تشكيل النواتج ثابتة. يظهر هذا في منحنى الإشباع إلى اليمين. يحدث الإشباع بسبب ازدياد تركيز الركيزة، و مع ازدياد تركيز الركيزة يزداد تحول الإنزم الحر إلى معقّد نزيم-ركيزة، عند الوصول إلى أعلى سرعة للإنزيم (Vmax) تكون جميع المواقع النشطة في الإنزيم مرتبطة بالركيزة، و كمية المعقّد هي كل كمية الإنزيم.[1] تعتبر أعظم سرعة للإنزيم Vmax أحد مقاييس الحركية الإنزيمية المهمة. كذلك فإن تركيز الركيزة اللازم لتحقيق سرعة إنزيم معينة هي قيمة مهمة أيضاً، و هي تُعطى من ثابت ميكايليس-مينتين (Km)، و هو تركيز الركيزة المطلوب ليصل الإنزيم إلى نصف سرعة تفاعله العظمى، و يمتلك كل إنزيم قيمة Km مميزة لركيزة معينة. هناك ثابت آخر مهم هو kcat و هو عدد جزيئات الركيزة التي يعالجها موقع نشط واحد في ثانية واحدة.[1] يمكن التعبير عن فعالية إنزيم باستخدام المصطلحات kcat/Km. يدعى أيضاً يثابت النوعية و هو يدمج بين ثوابت سرعة كل خطوات التفاعل بما في ذلك أول خطوة غير عكوسة. يُستخدم ثابت النوعية للمقارنة بين الإنزيمات أو نفس الإنزيم بالنسبة لمختلف الركائز، و ذلك لأن ثابت النوعية يعكس القدرة على الجذب و التحفيز. يُدعى الحد الأقصى نظرياً لثابت النوعية بحد الانتشار و هو حوالي 108 إلى 109 (M?1 s?1). عند هذا الحد يؤدي كل تصادم بين الركيزة و الإنزيم إلى تحفيز تفاعل، و يكون معدل تكوين النواتج غير محصور بمعدل التفاعل بل بحد الانتشار. تدعى الإنزيمات التي تتحلى بهذه الخاصية بالإنزيمات المثالية حركياً أو تحفيزياً. على سبيل المثال التريوز-فوسفات إيزوميراز، و الكاربونيك أنهيدراز، و الأستيل كولين إستيراز، و الكاتالاز، و الفوماراز، و بيتا لاكتاماز، و سوبر أكسيد ديسميوتاز.[1] يمكن أن تصل قيمة kcat لهذه الإ،زيمات حتى ملايين التفاعلات خلال ثانية.[1] تعتمد حركية ميكايليس-مينتين على قانون فاعلية الكتلة، المستمد من فرضيات الانتشار الحر و من ناحية الديناميكا الحرارية فهو مشتق من الاصطدام العشوائي. لكن العديد من العمليات الخلوية و الكيميائية الحيوية تنحرف بشكل كبير عن هذه الظروف، و ذلك بسبب الحشد الجزيئي الهائل و تقييد الحركة الجزيئية.[59] أُضيف إلى النموذج إضافات معقّدة في محاولة لتصحيح هذه التأثيرات.[60]
التثبيط
)
| image2 = Methotrexate vs folate 2.svg | alt2 = Two dimensional representations of the chemical structure of folic acid and methotrexate highlighting the differences between these two substances (amidation of pyrimidone and methylation of secondary amine). | caption2 = مرافق الإنزيم حمض الفوليك (اليسار) و العقار مضاد السرطان الميثوتركسات (اليمين) متشابهان جداً في البنية، تظهر الاختلافات في اللون الأخضر. بالنتيجة يمثل الميثوتركسات مثبط تنافسي للعديد من الإنزيمات التي تستخدم الفولات. }}
يمكن أن تنفض سرعات تفاعل إنزيمي بمثبطات الإنزيم المتنوعة.[61]
أنماط المثبطات
المثبط التنافسي
لا يمكن أن يرتبط المثبط التنافسي و الركيزة مع الإنزيم في الوقت ذاته.[62] معظم المثبطات التنافسية تشبه بشكل كبير ركائز الإنزيمات التي تثبطها. على سبيل المثال، عقار الميثوتركسات مثبط تنافسي لإنزيم ديهيدروفولات ريدوكتاز الذي يحفّز إرجاع ديهيدروفولات إلى تيتراهيدروفولات. في الشكل المجاور يظهر التشابه بين بنية الميثوتركسات و الديهيدروفولات. يمكن التغلب على التثبيط في هذه الحالة بزيادة تركيز الركيزة. في بعض الحالات يرتيط المثبط بموقع غير الموقع الرابط للركيزة المعتادة و يمارس تأثيراً تفارغياً يغير بموجبه الشكل المعتاد للموقع الرابط.
المثبط غير التنافسي
يرتبط المثبط غير التنافسي بموقع غير موقع ربط الركيزة. ترتبط الركيزة و تتمتع بألفتها المعتادة و تبقى قيمة Km ذاتها. يقوم المثبط بخفض الفعالية التحفيزية للإنزيم فتنخفض بذلك قيمة السرعة العظمى Vmax. على النقيض من المثبط التنافسي، فإن المثبط غير التنافسي لا يمكن التغلب عليه عبر زيادة تركيز الركيزة.[61]
مثبط ضد التنافسي
لا يستطيع المثبط ضد التنافسي أن يرتبط بالإنزيم الحر، بل يرتبط فقط بالمعقد إنزيم-ركيزة،و بالتالي فإن هذا النوع من المثبطات هو الأكثر فعالية في التراكيز المرتفعة من الركيزة. في وجود المثبط يصبح المعقد إنزيم-ركيزة غير فعّال.[61] إلا أن هذا النوع من المثبطات نادر.[63]
مختلط
يرتبط المثبط المختلط بموقع تفارغي و يتآثر ارتباط الركيزة و ارتباط المثبط. تقلّ وظيفة الإنزيم و لكن لا تختفي عند ارتباط المثبط به. هذا النوع من الثبطات لا يتبع لمعادلة ميكايليس-مينتين.[61]
المثبط غير العكوس=
اليعطل المثبط غير العكوس الإنزيم بشكل دائم، و ذلك عادةً عبر تشكيل رابطة تساهمية للبروتين. من الأ/ثلة الشائعة عن هذه الطريقة أدوية البنسلين،[64] و الأسبرين.[65]
وظائف المثبطات
تعتبر المثبطات جزءاً من آليات التلقيم الراجع في العديد من الأحياء. فإذاا أنتج إنزيم ما كمية أكبر من اللازم لركيزة ما في الكائن الحي، يمكن لهذه المادة المنتجة أن تمارس دوراً مثبطاً لهذا الإنزيم في المراحل الأولى من المسار الإنتاجي، مما يؤدي لإبطاء إنتاج هذه المادة أو إيقافه عند وجود كمية كافية منها. يعتبر هذا شكلاً من أشكال التقليم الراجع السلبي. تستخدم مسارات الاستقلاب الرئيسية هذه الآلية.[1] بما أن مثبطات الإنزيم تعدل الوظيفة الإنزيمية فقد اِستُخدمت كأدوية. العديد من الأدوية هي مثبطات تنافسية عكوسة تشبه ركيزة الإنزيم الأصلية، كما هو الحال في مثال الميثوتركسات أعلاه، من الأمثلة المعروفة الأخرى الستاتينات التي تستخدم لمعالجة الكوليسترول المرتفع،[66] و مثبطات إنزيم البروتياز التي تستخدم لعلاج عدوى الفيروس العكسي كفيروس HIV.[67] أما الأسبرين فيعتبر مثالاً شائعاً للمثبطات الإنزيمية غير العكوسة التي تستعمل دوائياً، و هو يثبط إنزيمات COX-1 و COX-2 التي تنتج البروستاجلاندين رسول الالتهاب.[65] المثبطات الإنزيمية الأخرى سموم، مثلاً سم السيانيد هو مثبط إنزيمي غير عكوس يجتمع مع النحاس و الحديد في الموقع النشط للإنزيم السيتوكروم سي أوكسيداز و يقوم بإحصار التنفس الخلوي.[68]
الوظيفة البيولوجية
يقوم الإ،زيم بوظائف عديدة داخل الكائن الحي. فلا غنى عن الإنزيمات من أجل التنبيه الإشاري في التنظيم الخلوي و غالباً عبر إنزيمات الكيناز و الفوسفاتاز.[69] كما أنها تقوم بتوليد الحركة عبر توليد التقلص العضلي و نقل المواد عبر الخلية كجزء من الهيكل الخلوي.[70] إنزيمات أخرى مرتبطة بـ ATP موجودة في غشاء الخلية و هي مضخات أيونية تقوم بالنقل الفاعل لهذه الأيونات عبر الغشاء. تشترك الإنزيمات كذلك في وظائف أكثر غرابةً كتوليد الضوء في اليراعات.[71] يمكن أن تحتوي الفيروسات أيضاً على إنزيمات تقوم بوظائف دخل الخلية المصابة مثل إنزيم HIV إنترغاز، و ترانسكريبتاز العكسي، أو لإطلاق الفيروس من الخلية مثل إنزيمات نيورامينيداز الخاص بفيروس الإنفلونزا.[72] في الحيوانات تظهر وظيفة هامة للإنزيمات في الجهاز الهضمي كإنزيمات الأميارز و البروتياز التي تقوم بتحطيم الجزيئات الكبيرة (النشاء و البروتينات على التوالي) إلى جزيئات صغيرة، لتتمكّن الأمعاء من امتصاصها. مثلاً جزيئات النشاء كبيرة جداً لتستطيع الأمعاء امتصاصها، تقوم الإنزيمات بحلمهة هذه سلاسل النشاء الطويلة إلى جزيئات صغيرة كالمالتوز و من ثم تنتهي إلى جزيئات غلوكوز هي قابلة للامتصاصا في الأمعاء. تختلف الإنزيمات الهاضمة باختلاف ركائزها. في المجترات ذات النظام الغذائي العاشب، تنتج الأحياءالدقيقة داخل أمعائها إنزيم السيللوز الذي يكسر جدران الخلايا النباتية في الألياف النباتية.[73]
الاستقلاب

الاستقلاب
العديد من الإنزيمات يمكن أن تعمل معاً في تكامل من أجل صنع مسار استقلابي.[1] في المسار الاستقلابي، يأخذ الإنزيم نواتج الإنزيم السابق كركيزة له، و من ثم تمرر نواتج التفاعل إلى الإنزيم الذي يليه ليستخدمه كركيزة. في بعض الأحيان قد يُحفّز التفاعل بأكثر من إنزيم بشكل متوازي، يسمح هذا التحفيز بتنظيم أكثر تعقيداً، على سبيل المثال انخفاض النشاط التفاعلي لأحد الإنزيمات بينما يستمر النشاط في إنزيم ثاني.[74] تحدد الإنزيمات الخطوات التي تحدث في هذه المسارات الاستقلابية. و بدون الإنزيمات لن تستمر العلميات الاستقلابية في الخطوات نفسها، و لايمكن حتى تنظشم الاستقلاب لتلبية احتياجات الخلية. معظم المسارات الاستقلابية المركزية تُنظَّم عبر خطوات مفتاحية، عبر الإنزيمات من خلال الإنزيمات ذات النشاط المرتبط بحلمهة ATP، لأن هذه التفاعلات تطلق كمية كبيرة من الطاقة، بينما يوجد تفاعلات أخرى غير مناسبة من ناحية الديناميكا الحرارية يمكن أن تقترن بحلمهة ATP، حيث تمثل حلمهة ATP شرارة كل أنماط التفاعلات الاستقلابية التي تليها.[1]
التحكم في النشاط
هناك خمسة طرق رئيسية للتحكم بنشاط الإنزيم في الخلية.[1]
التنظيم
يمكن للإنزيمات أن تكون منشطة أو مثبطة بواسطة جزيئات عديدة. على سبيل المثال المنتج (أو المنتجات)النهائي لأحد المسارات الاستقلابية غالباً هي مثبطات لواحد من الإنزيمات الأولى في هذا المسار، هذه الآلية من التنظيم تُدعى بالتلقيم الراجع السلبي، لأن كمية المنتج النهائي التي يتم إنتاجها يتم ضبطها عبر تركيز هذا المنتج.[75] يمكن لآلية التلقيم الراجع السلبي أن تضبط بشكل فعّال معدل تخليق المستقلبات المتوسطة تبعاً لطلب الخلايا. تساعد هذه الآلية في تخصيص فعّال للمواد و اقتصاد في الطاقة و تمنع تصنيع فائض من المنتجات النهائية. التحكم في الفعل الإنزيمي يساعد عفي الحفاظ على بيئة داخلية متوازنة في المتعضيات الحية كما كل أجهزةضبط الاستتباب الداخلي.[75]
تعديل بعد الترجمة
تتضمن الأمثلة على آلية التعديل بعد الترجمة الفسفرة و الغلكزة.[75] مثلاً في الاستجابة للإنسولين، تتم فسفرة إنزيمات متعددة بما في ذلك الغليكوجين سينثاز، تساعد هذه الفسفرة في التحكم في تصنيع أو تقويض الغليكوجين و تسمح للخلايا بالاستجابة للتغيرات في السكر الدم.[76] مثالٌ آخر على التعديل بعد الترجمة هو تقسيم سلسلة عديد الببتيد، مثلاً إنزيم الكيموتربسين و هو من نوع إنزيمات البروتياز، يتم إنتاجه في البنكرياس و يكون اسمه الكيموترسينوجين أو مولد الكيموتربسين و هو الشكل غير الفعّال، و من ثم يُنقل و هو في الشكل غير الفعّال إلى المعدة حيث يتم تفعيله. هذا السلوك يمنع الإنزيم من هضم البنكرياس أو الأنسجة الأُخرى قبل أن يدخل لمعة المعي. هذا النمط من طليعة الإنزيم غير الفعّالة تُعرف باسم طليعة الإنزيم.
الكمية
يمكن أن ينخفض أو يزداد إنتاج الإنزيم (نسخ و ترجمة جينات الإنزيم) في الخلية كاستجابة للتغيرات في بيئة الخلية. هذا النموذج من التنظيم الجيني يدعى بتحريض الإنزيم. مثلاً إنزيم السيتوكروم بي450 أوكسيداز في الكبد و هو مهم جداً في استقلاب الأدوية. يمكن أن يؤدي تحريض أو تثبيط هذه الإنزيمات إلى تداخلات دوائية.[77] مستويات الإنزيم يمكن أن تُنظم أيضاً عبر تغيير معدل تقويض الإنزيم.[1]
التوزيع داخل الخلوي
يمكن أن تُجزأ الإنزيمات عبر مسارات استقلابية تحدث في الحجرات الخلوية المختلفة. مثلاً تُصنّع الحموض الدسمة بواسطة مجموعة واحدة من الإنزيمات في العصارة الخلوية و الشبكة الإندوبلاسمية و جهاز غولجي، بينم تستخدم من قبل مجموعة مختلفة من الإنزيمات كمصدر للطاقة في الميتاكوندريا عبر أكسدة بيتا.[78] بالإضافة إلى ذلك فإن نقل الإنزيم إلى حجرات مختلفة يمكن أن يغير في درجة البروتونات (حيث السيتوبلاسم محايد بينما الليزوزوم حامضي) أو في الحالة التأكسدية، و هذا يؤثر على نشاط الإنزيم.[79]
اختصاص الأعضاء
في عديدات الخلايا حقيقيات النوى، تمتلك الخلايا في النسج المختلفة أنماطاً مختلفة في التعبير الجيني، لذا فإنها تمتلك مجموعات مختلفة من الإنزيمات (تُعرف باسم الإيزوزيمات) متاحة للتفاعلات الاستقلابية. هذا يوفر آلية للتنظيم لكل استقلاب العضوية. مثلاً الهيكسوكيناز أول إنزيم في سبيل تحلل الغلوكوز له شكل خاص يدعى الغلوكوكيناز يتم التعبير عنه في الكبد و البنكرياس، لهذا الشكل من الإنزيم ألفة منخفضة للغلوكوز و لكنه أكثر حساسية لتركيز الغلوكوز.[80] يشترك هذا الإنزيم في التحسس لسكر الدم و تنظيم إنتاج الأنسولين.[81]
المشاركة في الأمراض
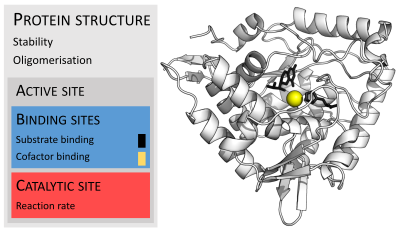
يعتبر التحكم الصارم في نشاط الإنزيم أمراً ضرورياً للتوازن، حيث أن أي خلل (طفرة، أو إنتاج مفرط، أو إنتاج أقل، أو حذف) في إنزيم حرج واحد يقود إلى مرض وراثي. الخلل في نوع واحد من الإنزيمات من بين آلاف الأنواع الموجودة في جسم الإنسان يمكن أن يكون قاتلاً. من الأمثلة على الأمراض الوراثية القاتلة بسبب قصور إنزيم مرض تاي-ساكس حيث يكون لدى المريض عوز في إنزيم الهيسكوسامينيداز.[82][83] أحد أمثلة عوز الإنزيم هو النمط الأكثر شيوعاً من بيلة الفينيل كيتون. العديد من الطفرات في أحماض أمينية مفردة في إنزيم الفنيل ألانين هيدروكسيلاز، و هو الإنزيم الذي يحفز الخطوة الأولى في تقويض الفنيل ألانين، و هذا ما يؤدي إلى تراكم الفينيل ألانين و المنتجات ذات الصلة. توجد بعض الطفرات في الموقع النشط، تعطِّل بشكل مباشر الارتباط و التحفيز، و لكن العديد من الطفرات تكون بعيدة عن الموقع النشط و هي تقلل النشاط عبر زعزعة استقرار بنية البروتين، أو عبر آليات أخرى.[84][85] يمكن أن يؤدي هذا إلى إعاقة ذهنية إذا لم يتم علاج المرض.[86] مثالٌ آخر هو عوز كولين إستيراز الكاذب، في هذه الحالة تضعف قدرة الجسم على تحطيم أدوية كولين إستير.[87] حالات قصور الإنزيمات الوظيفيةيمكن علاجها عبر الإعطاء الفموي للإنزيمات مثل قصور البنكرياس[88] و عدم تحمل اللاكتوز.[89] كما أن هناك طرقاً أخرى تحدث أمراض فيها بسبب خلل إنزيمي يأتي منطفرات جرثومية في الجينات المرمّزة لإنزيمات إصلاحدنا. تسبب العيوب في هذه الإنزيمات سرطاناً لأن الخلايا تصبح أقل قدرةً على إصلاح الطفرات في جينوماتها. هذا يسبب تراكم بطيء للطفرات و يؤدي إلى تطور السرطانات. مثلاً متلازمة السرطان الوراثي هي جفاف الجلد المصطبغ، و هي تسبب تطور سرطانات الجلد استجابةً للحد الأدنى من التعرض للأشعة فوق البنفسجية.[90][91]
تطبيقات صناعية
تستخدم الإنزيمات في الصناعات الكيمائية و التطبيقات الصناعية الأخرى عندما يكون هناك حاجة لمحفّزات نوعية للغاية. عموماً الإنزيمات محدودة في التفاعلات التي تحفّزها، لأنها تطورت لتحفز هذه التفاعلات بالإضافة إلى عدم استقرارها في المذيبات العضوية و في درجات الحرارة المرتفعة. نتيجةً لذلك، فإن هندسة البروتين هي مجال بحث نشيط يحاول أن يصنع إنزيمات جديدة إما من خلال تصميم عقلاني أو من خلال التطوير في المخبر.[92][93] بدأت تلقى هذه الجهود نجاحاً، حيث قد تم بالفعل تصميم بعض الإنزيمات "من الصفر" لتحفيز تفاعلات لا تحدث في الطبيعة.[94]
| التطبيق | الإنزيمات المستخدمة | الاستخدامات |
|---|---|---|
| صناعة الوقود الحيوي | إنزيمات السيلولاز | تحطيم السيللوز إلى جزيئات سكرية يمكن تخميرها للحصول على إيثانول سيللوزي.[95] |
| إنزيمات اللينغيناز | المعالجة الأولية للكتلة الحيوية من أجل إنتاج الوقود الحيوي.[95] | |
| المنظفات الحيوية | إنزيمات البروتياز، و الأميلاز، و الليباز | إزالة البقع البروتينية و الدهنية و الزيتية و بقع النشاء من الغسيل و الأطباق.[96] |
| إنزيمات المانّاز | إزالة بقع الطعام من إضافات الطعام الشائعة صمغ الغوار.[96] | |
| صناعة الجعة | إنزيمات الأميلاز، و الغلوكوناز، و البروتياز | تقسيم عديدات السكريات و البروتينات في الجعة.[97]:150–9 |
| إنزيمات بيتا غلوكاناز | تحسين خصائص ترشيح النبتة و البيرة.[97]:545 | |
| إنزيمات الأميلوغلوكوزيداز، و البولولوناز | صنع بيرة منخفضة السعرات الحرارية ضبط التخمير.[97]:575 | |
| إنزيمات أسيتولاكتات ثنائي كاربوكسيلاز (ALDC) | زيادة فعالية التخمير عبر إنقاص تشكيل دي أستيل.[98] | |
| استخدامات في الطبخ | باباين | ترقيق اللحوم من أجل الطبخ.[99] |
| إنتاج الحليب | الرينين (يسمى أيضاً الكيموسين) | تحليل البروتين في تصنيع الجبن.[100] |
| إنزيمات الليباز | إنتاج جبن كامامبير و الأجبان الزرقاء كجبن روكفور.[101] | |
| معالجة الطعام | إنزيمات الأميلاز | إنتاج السكريات من النشاء كما في صناعة شراب الذرة عالي الفركتوز.[102] |
| إنزيمات البروتياز | خفض مستوى البروتين في الدقيق كما هو الحال في صناعة البسكويت.[103] | |
| التربسين | صناعة أطعمة الأطفال من أجل حالات الحساسية.[103] | |
| إنزيمات السيلولاز، و البيكتيناز | تنقية عصائر الفواكه.[104] | |
| البيولوجيا الجزيئية | إنزيمات النوكلياز، و دنا ليغاز، و البوليميراز | استخدام الهضم المُقيَّد، و تفاعل بلمرة السلاسل لصناعة الحمض النووي.[1]:6.2 |
| صناعة الورق | إنزيمات الزيلاناز، و الهيميسيلولاز، و اللينغين بيروكسيداز | إزالة الليجنين من عجينة ورق كرافت.[105] |
| الرعاية الشخصية | إنزيمات البروتياز | إزالة البروتينات من العدسات اللاصقة لمنع العدوى.[106] |
| صناعة النشاء | إنزيمات الأميلاز | تحويل النشاء إلى غلوكوز و شرابات مختلفة.[107] |
مراجع
- ^ ا ب ج د ه و ز ح ط ي يا يب يج يد يه يو يز يح يط ك Stryer L، Berg JM، Tymoczko JL (2002). Biochemistry (ط. 5th). San Francisco: W.H. Freeman. ISBN:0-7167-4955-6.

- ^ Murphy JM, Farhan H and Eyers PA (2017) Bio-Zombie: the rise of pseudoenzymes in biology.Biochem Soc Trans. 45:537-544
- ^ Murphy JM، وآخرون (2014). "A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties". Biochemical Journal. ج. 457 ع. 2: 323–334. DOI:10.1042/BJ20131174. PMID:24107129.
- ^ Schomburg I، Chang A، Placzek S، S?hngen C، Rother M، Lang M، Munaretto C، Ulas S، Stelzer M، Grote A، Scheer M، Schomburg D (يناير 2013). "BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA". Nucleic Acids Research. ج. 41 ع. Database issue: D764–72. DOI:10.1093/nar/gks1049. PMC:3531171. PMID:23203881.
{{استشهاد بدورية محكمة}}: Vancouver style error: حرف غير لاتيني in name 4 (مساعدة) - ^ Radzicka A، Wolfenden R (يناير 1995). "A proficient enzyme". Science. ج. 267 ع. 5194: 90–931. Bibcode:1995Sci...267...90R. DOI:10.1126/science.7809611. PMID:7809611.
- ^ Callahan BP، Miller BG (ديسمبر 2007). "OMP decarboxylase—An enigma persists". Bioorganic Chemistry. ج. 35 ع. 6: 465–9. DOI:10.1016/j.bioorg.2007.07.004. PMID:17889251.
- ^ de Réaumur RA (1752). "Observations sur la digestion des oiseaux". Histoire de l'academie royale des sciences. ج. 1752: 266, 461.
- ^ Williams، Henry Smith (1904). A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences. Harper and Brothers.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Payen A, Persoz JF (1833). "Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels" [Memoir on diastase, the principal products of its reactions, and their applications to the industrial arts]. Annales de chimie et de physique. 2nd (بالفرنسية). 53: 73–92.
- ^ Manchester KL (ديسمبر 1995). "Louis Pasteur (1822–1895)–chance and the prepared mind". Trends in Biotechnology. ج. 13 ع. 12: 511–5. DOI:10.1016/S0167-7799(00)89014-9. PMID:8595136.
- ^ Holmes، Frederic Lawrence (2003). "Enzymes". في Heilbron، John L. (المحرر). The Oxford Companion to the History of Modern Science. Oxford: Oxford University Press. ص. 270.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة)، الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)، وروابط خارجية في|chapterurl= - ^ "Eduard Buchner". Nobel Laureate Biography. Nobelprize.org. اطلع عليه بتاريخ 2015-02-23.
- ^ "Eduard Buchner – Nobel Lecture: Cell-Free Fermentation". Nobelprize.org. 1907. اطلع عليه بتاريخ 2015-02-23.
- ^ The naming of enzymes by adding the suffix "-ase" to the substrate on which the enzyme acts, has been traced to French scientist Emile Duclaux (1840–1904), who intended to honor the discoverers of diastase – the first enzyme to be isolated – by introducing this practice in his book Duclaux E (1899). Traité de microbiologie: Diastases, toxines et venins [Microbiology Treatise: diastases , toxins and venoms] (بالفرنسية). Paris, France: Masson and Co. See Chapter 1, especially page 9.
- ^ Willst?tter R (1927). "Faraday lecture. Problems and methods in enzyme research". Journal of the Chemical Society (Resumed): 1359. DOI:10.1039/JR9270001359.
{{استشهاد بدورية محكمة}}: Vancouver style error: حرف غير لاتيني in name 1 (مساعدة) quoted in Blow D (أبريل 2000). "So do we understand how enzymes work?" (pdf). Structure (London, England : 1993). ج. 8 ع. 4: R77–R81. DOI:10.1016/S0969-2126(00)00125-8. PMID:10801479. - ^ Blake CC، Koenig DF، Mair GA، North AC، Phillips DC، Sarma VR (مايو 1965). "Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 ?ngstr?m resolution". Nature. ج. 206 ع. 4986: 757–61. Bibcode:1965Natur.206..757B. DOI:10.1038/206757a0. PMID:5891407.
- ^ Johnson LN، Petsko GA (1999). "David Phillips and the origin of structural enzymology". Trends Biochem. Sci. ج. 24 ع. 7: 287–9. DOI:10.1016/S0968-0004(99)01423-1. PMID:10390620.
- ^ Nomenclature Committee. "Classification and Nomenclature of Enzymes by the Reactions they Catalyse". International Union of Biochemistry and Molecular Biology (NC-IUBMB). School of Biological and Chemical Sciences, Queen Mary, University of London.
- ^ Nomenclature Committee. "EC 2.7.1.1". International Union of Biochemistry and Molecular Biology (NC-IUBMB). School of Biological and Chemical Sciences, Queen Mary, University of London.
- ^ Anfinsen CB (يوليو 1973). "Principles that govern the folding of protein chains". Science. ج. 181 ع. 4096: 223–30. Bibcode:1973Sci...181..223A. DOI:10.1126/science.181.4096.223. PMID:4124164.
- ^ Dunaway-Mariano D (نوفمبر 2008). "Enzyme function discovery". Structure (London, England : 1993). ج. 16 ع. 11: 1599–600. DOI:10.1016/j.str.2008.10.001. PMID:19000810.
- ^ Petsko، Gregory A.؛ Ringe، Dagmar (2003). "Chapter 1: From sequence to structure". Protein structure and function. London: New Science. ص. 27. ISBN:978-1405119221.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة)، الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)، وروابط خارجية في|chapterurl= - ^ Chen LH، Kenyon GL، Curtin F، Harayama S، Bembenek ME، Hajipour G، Whitman CP (سبتمبر 1992). "4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer". The Journal of Biological Chemistry. ج. 267 ع. 25: 17716–21. PMID:1339435.
- ^ Smith S (ديسمبر 1994). "The animal fatty acid synthase: one gene, one polypeptide, seven enzymes". FASEB Journal. ج. 8 ع. 15: 1248–59. PMID:8001737.
- ^ "The Catalytic Site Atlas". The European Bioinformatics Institute. اطلع عليه بتاريخ 2007-04-04.
- ^ ا ب Suzuki H (2015). "Chapter 7: Active Site Structure". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ص. 117–140. ISBN:978-981-4463-92-8.
- ^ Krauss G (2003). "The Regulations of Enzyme Activity". Biochemistry of Signal Transduction and Regulation (ط. 3rd). Weinheim: Wiley-VCH. ص. 89–114. ISBN:9783527605767.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة) وروابط خارجية في|chapterurl= - ^ Jaeger KE، Eggert T (أغسطس 2004). "Enantioselective biocatalysis optimized by directed evolution". Current Opinion in Biotechnology. ج. 15 ع. 4: 305–13. DOI:10.1016/j.copbio.2004.06.007. PMID:15358000.
- ^ Shevelev IV، Hübscher U (مايو 2002). "The 3' 5' exonucleases". Nature Reviews Molecular Cell Biology. ج. 3 ع. 5: 364–76. DOI:10.1038/nrm804. PMID:11988770.
- ^ Zenkin N، Yuzenkova Y، Severinov K (يوليو 2006). "Transcript-assisted transcriptional proofreading". Science. ج. 313 ع. 5786: 518–20. Bibcode:2006Sci...313..518Z. DOI:10.1126/science.1127422. PMID:16873663.
- ^ Ibba M، Soll D (2000). "Aminoacyl-tRNA synthesis". Annual Review of Biochemistry. ج. 69: 617–50. DOI:10.1146/annurev.biochem.69.1.617. PMID:10966471.
- ^ Rodnina MV، Wintermeyer W (2001). "Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms". Annual Review of Biochemistry. ج. 70: 415–35. DOI:10.1146/annurev.biochem.70.1.415. PMID:11395413.
- ^ Khersonsky O، Tawfik DS (2010). "Enzyme promiscuity: a mechanistic and evolutionary perspective". Annual Review of Biochemistry. ج. 79: 471–505. DOI:10.1146/annurev-biochem-030409-143718. PMID:20235827.
- ^ O'Brien PJ، Herschlag D (أبريل 1999). "Catalytic promiscuity and the evolution of new enzymatic activities". Chemistry & Biology. ج. 6 ع. 4: R91–R105. DOI:10.1016/S1074-5521(99)80033-7. PMID:10099128.
- ^ Fischer E (1894). "Einfluss der Configuration auf die Wirkung der Enzyme". Berichte der Deutschen chemischen Gesellschaft zu Berlin (بالألمانية). 27 (3): 2985–93. DOI:10.1002/cber.18940270364.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|trans_title=تم تجاهله يقترح استخدام|عنوان مترجم=(help) From page 2992: "Um ein Bild zu gebrauchen, will ich sagen, dass Enzym und Glucosid wie Schloss und Schlüssel zu einander passen müssen, um eine chemische Wirkung auf einander ausüben zu k?nnen." (To use an image, I will say that an enzyme and a glucoside [i.e., glucose derivative] must fit like a lock and key, in order to be able to exert a chemical effect on each other.) - ^ Cooper GM (2000). "Chapter 2.2: The Central Role of Enzymes as Biological Catalysts". The Cell: a Molecular Approach (ط. 2nd). Washington (DC ): ASM Press. ISBN:0-87893-106-6.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة) وروابط خارجية في|chapterurl= - ^ Koshland DE (فبراير 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proceedings of the National Academy of Sciences of the United States of America. ج. 44 ع. 2: 98–104. Bibcode:1958PNAS...44...98K. DOI:10.1073/pnas.44.2.98. PMC:335371. PMID:16590179.
- ^ Vasella A، Davies GJ، B?hm M (أكتوبر 2002). "Glycosidase mechanisms". Current Opinion in Chemical Biology. ج. 6 ع. 5: 619–29. DOI:10.1016/S1367-5931(02)00380-0. PMID:12413546.
{{استشهاد بدورية محكمة}}: Vancouver style error: حرف غير لاتيني in name 3 (مساعدة) - ^ Boyer، Rodney (2002). "Chapter 6: Enzymes I, Reactions, Kinetics, and Inhibition". Concepts in Biochemistry (ط. 2nd). New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc. ص. 137–8. ISBN:0-470-00379-0. OCLC:51720783.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Savir Y، Tlusty T (2007). Scalas E (المحرر). "Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition" (PDF). PLoS ONE. ج. 2 ع. 5: e468. Bibcode:2007PLoSO...2..468S. DOI:10.1371/journal.pone.0000468. PMC:1868595. PMID:17520027.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Fersht A (1985). Enzyme Structure and Mechanism. San Francisco: W.H. Freeman. ص. 50–2. ISBN:0-7167-1615-1.
- ^ Warshel A، Sharma PK، Kato M، Xiang Y، Liu H، Olsson MH (أغسطس 2006). "Electrostatic basis for enzyme catalysis". Chemical Reviews. ج. 106 ع. 8: 3210–35. DOI:10.1021/cr0503106. PMID:16895325.
- ^ Cox، Michael M.؛ Nelson، David L. (2013). "Chapter 6.2: How enzymes work". Lehninger Principles of Biochemistry (ط. 6th). New York, N.Y.: W.H. Freeman. ص. 195. ISBN:978-1464109621.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة)، الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)، وروابط خارجية في|chapterurl= - ^ Benkovic SJ، Hammes-Schiffer S (أغسطس 2003). "A perspective on enzyme catalysis". Science. ج. 301 ع. 5637: 1196–202. Bibcode:2003Sci...301.1196B. DOI:10.1126/science.1085515. PMID:12947189.
- ^ Jencks WP (1987). Catalysis in Chemistry and Enzymology. Mineola, N.Y: Dover. ISBN:0-486-65460-5.
- ^ Villa J، Strajbl M، Glennon TM، Sham YY، Chu ZT، Warshel A (أكتوبر 2000). "How important are entropic contributions to enzyme catalysis?". Proceedings of the National Academy of Sciences of the United States of America. ج. 97 ع. 22: 11899–904. Bibcode:2000PNAS...9711899V. DOI:10.1073/pnas.97.22.11899. PMC:17266. PMID:11050223.
- ^ Ramanathan A، Savol A، Burger V، Chennubhotla CS، Agarwal PK (2014). "Protein conformational populations and functionally relevant substates". Acc. Chem. Res. ج. 47 ع. 1: 149–56. DOI:10.1021/ar400084s. PMID:23988159.
- ^ Tsai CJ، Del Sol A، Nussinov R (2009). "Protein allostery, signal transmission and dynamics: a classification scheme of allosteric mechanisms". Mol Biosyst. ج. 5 ع. 3: 207–16. DOI:10.1039/b819720b. PMC:2898650. PMID:19225609.
- ^ Changeux JP، Edelstein SJ (يونيو 2005). "Allosteric mechanisms of signal transduction". Science. ج. 308 ع. 5727: 1424–8. Bibcode:2005Sci...308.1424C. DOI:10.1126/science.1108595. PMID:15933191.
- ^ de Bolster، M.W.G. (1997). "Glossary of Terms Used in Bioinorganic Chemistry: Cofactor". International Union of Pure and Applied Chemistry. اطلع عليه بتاريخ 2007-10-30.
{{استشهاد ويب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Chapman-Smith A، Cronan JE (1999). "The enzymatic biotinylation of proteins: a post-translational modification of exceptional specificity". Trends Biochem. Sci. ج. 24 ع. 9: 359–63. DOI:10.1016/s0968-0004(99)01438-3. PMID:10470036.
- ^ Fisher Z، Hernandez Prada JA، Tu C، Duda D، Yoshioka C، An H، Govindasamy L، Silverman DN، McKenna R (فبراير 2005). "Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II". Biochemistry. ج. 44 ع. 4: 1097–115. DOI:10.1021/bi0480279. PMID:15667203.
- ^ ا ب Wagner AL (1975). Vitamins and Coenzymes. Krieger Pub Co. ISBN:0-88275-258-8.
- ^ "BRENDA The Comprehensive Enzyme Information System". Technische Universit?t Braunschweig. اطلع عليه بتاريخ 2015-02-23.
- ^ McArdle WD، Katch F، Katch VL (2006). "Chapter 9: The Pulmonary System and Exercise". Essentials of Exercise Physiology (ط. 3rd). Baltimore, Maryland: Lippincott Williams & Wilkins. ص. 312–3. ISBN:978-0781749916.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة) وروابط خارجية في|chapterurl= - ^ Ferguson SJ، Nicholls D، Ferguson S (2002). Bioenergetics 3 (ط. 3rd). San Diego: Academic. ISBN:0-12-518121-3.
- ^ Michaelis L, Menten M (1913). "Die Kinetik der Invertinwirkung" [The Kinetics of Invertase Action]. Biochem. Z. (بالألمانية). 49: 333–369.; Michaelis L، Menten ML، Johnson KA، Goody RS (2011). "The original Michaelis constant: translation of the 1913 Michaelis-Menten paper". Biochemistry. ج. 50 ع. 39: 8264–9. DOI:10.1021/bi201284u. PMC:3381512. PMID:21888353.
- ^ Briggs GE، Haldane JB (1925). "A Note on the Kinetics of Enzyme Action". The Biochemical Journal. ج. 19 ع. 2: 339–339. DOI:10.1042/bj0190338. PMC:1259181. PMID:16743508.
- ^ Ellis RJ (أكتوبر 2001). "Macromolecular crowding: obvious but underappreciated". Trends in Biochemical Sciences. ج. 26 ع. 10: 597–604. DOI:10.1016/S0968-0004(01)01938-7. PMID:11590012.
- ^ Kopelman R (سبتمبر 1988). "Fractal reaction kinetics". Science. ج. 241 ع. 4873: 1620–26. Bibcode:1988Sci...241.1620K. DOI:10.1126/science.241.4873.1620. PMID:17820893.
- ^ ا ب ج د Cornish-Bowden A (2004). Fundamentals of Enzyme Kinetics (ط. 3). London: Portland Press. ISBN:1-85578-158-1.
- ^ Price NC (1979). "What is meant by 'competitive inhibition'?". Trends in Biochemical Sciences. ج. 4 ع. 11: N272–N273. DOI:10.1016/0968-0004(79)90205-6.
- ^ Cornish-Bowden A (يوليو 1986). "Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides". FEBS Letters. ج. 203 ع. 1: 3–6. DOI:10.1016/0014-5793(86)81424-7. PMID:3720956.
- ^ Fisher JF، Meroueh SO، Mobashery S (فبراير 2005). "Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity". Chemical Reviews. ج. 105 ع. 2: 395–424. DOI:10.1021/cr030102i. PMID:15700950.
- ^ ا ب Johnson DS، Weerapana E، Cravatt BF (يونيو 2010). "Strategies for discovering and derisking covalent, irreversible enzyme inhibitors". Future Medicinal Chemistry. ج. 2 ع. 6: 949–64. DOI:10.4155/fmc.10.21. PMC:2904065. PMID:20640225.
- ^ Endo A (1 نوفمبر 1992). "The discovery and development of HMG-CoA reductase inhibitors" (PDF). J. Lipid Res. ج. 33 ع. 11: 1569–82. PMID:1464741.
- ^ Wlodawer A، Vondrasek J (1998). "Inhibitors of HIV-1 protease: a major success of structure-assisted drug design". Annual Review of Biophysics and Biomolecular Structure. ج. 27: 249–84. DOI:10.1146/annurev.biophys.27.1.249. PMID:9646869.
- ^ Yoshikawa S، Caughey WS (مايو 1990). "Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction". The Journal of Biological Chemistry. ج. 265 ع. 14: 7945–58. PMID:2159465.
- ^ Hunter T (يناير 1995). "Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling". Cell. ج. 80 ع. 2: 225–36. DOI:10.1016/0092-8674(95)90405-0. PMID:7834742.
- ^ Berg JS، Powell BC، Cheney RE (أبريل 2001). "A millennial myosin census". Molecular Biology of the Cell. ج. 12 ع. 4: 780–94. DOI:10.1091/mbc.12.4.780. PMC:32266. PMID:11294886.
- ^ Meighen EA (مارس 1991). "Molecular biology of bacterial bioluminescence". Microbiological Reviews. ج. 55 ع. 1: 123–42. PMC:372803. PMID:2030669.
- ^ De Clercq E (2002). "Highlights in the development of new antiviral agents". Mini Rev Med Chem. ج. 2 ع. 2: 163–75. DOI:10.2174/1389557024605474. PMID:12370077.
- ^ Mackie RI، White BA (أكتوبر 1990). "Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output". Journal of Dairy Science. ج. 73 ع. 10: 2971–95. DOI:10.3168/jds.S0022-0302(90)78986-2. PMID:2178174.
- ^ Rouzer CA، Marnett LJ (2009). "Cyclooxygenases: structural and functional insights". J. Lipid Res. 50 Suppl: S29–34. DOI:10.1194/jlr.R800042-JLR200. PMC:2674713. PMID:18952571.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب ج Suzuki H (2015). "Chapter 8: Control of Enzyme Activity". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ص. 141–69. ISBN:978-981-4463-92-8.
- ^ Doble BW، Woodgett JR (أبريل 2003). "GSK-3: tricks of the trade for a multi-tasking kinase". Journal of Cell Science. ج. 116 ع. Pt 7: 1175–86. DOI:10.1242/jcs.00384. PMC:3006448. PMID:12615961.
- ^ Skett P، Gibson GG (2001). "Chapter 3: Induction and Inhibition of Drug Metabolism". Introduction to Drug Metabolism (ط. 3). Cheltenham, UK: Nelson Thornes Publishers. ص. 87–118. ISBN:978-0748760114.
- ^ Faergeman NJ، Knudsen J (أبريل 1997). "Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling". The Biochemical Journal. ج. 323 ع. Pt 1: 1–12. PMC:1218279. PMID:9173866.
- ^ Suzuki H (2015). "Chapter 4: Effect of pH, Temperature, and High Pressure on Enzymatic Activity". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ص. 53–74. ISBN:978-981-4463-92-8.
- ^ Kamata K، Mitsuya M، Nishimura T، Eiki J، Nagata Y (مارس 2004). "Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase". Structure. ج. 12 ع. 3: 429–38. DOI:10.1016/j.str.2004.02.005. PMID:15016359.
- ^ Froguel P، Zouali H، Vionnet N، Velho G، Vaxillaire M، Sun F، Lesage S، Stoffel M، Takeda J، Passa P (مارس 1993). "Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus". The New England Journal of Medicine. ج. 328 ع. 10: 697–702. DOI:10.1056/NEJM199303113281005. PMID:8433729.
- ^ Okada S، O'Brien JS (أغسطس 1969). "Tay-Sachs disease: generalized absence of a beta-D-N-acetylhexosaminidase component". Science. ج. 165 ع. 3894: 698–700. Bibcode:1969Sci...165..698O. DOI:10.1126/science.165.3894.698. PMID:5793973.
- ^ "Learning About Tay-Sachs Disease". U.S. National Human Genome Research Institute. اطلع عليه بتاريخ 2015-03-01.
- ^ Erlandsen H، Stevens RC (أكتوبر 1999). "The structural basis of phenylketonuria". Molecular Genetics and Metabolism. ج. 68 ع. 2: 103–25. DOI:10.1006/mgme.1999.2922. PMID:10527663.
- ^ Flatmark T، Stevens RC (أغسطس 1999). "Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms". Chemical Reviews. ج. 99 ع. 8: 2137–2160. DOI:10.1021/cr980450y. PMID:11849022.
- ^ "Phenylketonuria". Genes and Disease [Internet]. Bethesda (MD): National Center for Biotechnology Information (US). 1998–2015.
{{استشهاد بكتاب}}: الوسيط غير المعروف|chapterurl=تم تجاهله يقترح استخدام|مسار الفصل=(مساعدة) وروابط خارجية في|chapterurl= - ^ "Pseudocholinesterase deficiency". U.S. National Library of Medicine. اطلع عليه بتاريخ 2013-09-05.
- ^ Fieker A، Philpott J، Armand M (2011). "Enzyme replacement therapy for pancreatic insufficiency: present and future". Clinical and Experimental Gastroenterology. ج. 4: 55–73. DOI:10.2147/CEG.S17634. PMC:3132852. PMID:21753892.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Misselwitz B، Pohl D، Frühauf H، Fried M، Vavricka SR، Fox M (يونيو 2013). "Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment". United European Gastroenterology Journal. ج. 1 ع. 3: 151–9. DOI:10.1177/2050640613484463. PMC:4040760. PMID:24917953.
- ^ Cleaver JE (مايو 1968). "Defective repair replication of DNA in xeroderma pigmentosum". Nature. ج. 218 ع. 5142: 652–6. Bibcode:1968Natur.218..652C. DOI:10.1038/218652a0. PMID:5655953.
- ^ James، William D؛ Elston، Dirk؛ Berger، Timothy G (2011). Andrews' Diseases of the Skin: Clinical Dermatology (ط. 11th). London: Saunders/ Elsevier. ص. 567. ISBN:978-1437703146.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Renugopalakrishnan V، Gardu?o-Ju?rez R، Narasimhan G، Verma CS، Wei X، Li P (نوفمبر 2005). "Rational design of thermally stable proteins: relevance to bionanotechnology". Journal of Nanoscience and Nanotechnology. ج. 5 ع. 11: 1759–1767. DOI:10.1166/jnn.2005.441. PMID:16433409.
{{استشهاد بدورية محكمة}}: Vancouver style error: حرف غير لاتيني in name 2 (مساعدة) - ^ Hult K، Berglund P (أغسطس 2003). "Engineered enzymes for improved organic synthesis". Current Opinion in Biotechnology. ج. 14 ع. 4: 395–400. DOI:10.1016/S0958-1669(03)00095-8. PMID:12943848.
- ^ Jiang L، Althoff EA، Clemente FR، Doyle L، R?thlisberger D، Zanghellini A، Gallaher JL، Betker JL، Tanaka F، Barbas CF، Hilvert D، Houk KN، Stoddard BL، Baker D (مارس 2008). "De novo computational design of retro-aldol enzymes". Science. ج. 319 ع. 5868: 1387–91. Bibcode:2008Sci...319.1387J. DOI:10.1126/science.1152692. PMC:3431203. PMID:18323453.
{{استشهاد بدورية محكمة}}: Vancouver style error: حرف غير لاتيني in name 5 (مساعدة) - ^ ا ب Sun Y، Cheng J (مايو 2002). "Hydrolysis of lignocellulosic materials for ethanol production: a review". Bioresource Technology. ج. 83 ع. 1: 1–11. DOI:10.1016/S0960-8524(01)00212-7. PMID:12058826.
- ^ ا ب Kirk O، Borchert TV، Fuglsang CC (أغسطس 2002). "Industrial enzyme applications". Current Opinion in Biotechnology. ج. 13 ع. 4: 345–351. DOI:10.1016/S0958-1669(02)00328-2. PMID:12323357.
- ^ ا ب ج Briggs، Dennis E. (1998). Malts and Malting (ط. 1st). London: Blackie Academic. ISBN:978-0412298004.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Dulieu C، Moll M، Boudrant J، Poncelet D (2000). "Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling". Biotechnology Progress. ج. 16 ع. 6: 958–65. DOI:10.1021/bp000128k. PMID:11101321.
- ^ Tarté، Rodrigo (2008). Ingredients in Meat Products Properties, Functionality and Applications. New York: Springer. ص. 177. ISBN:978-0-387-71327-4.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ "Chymosin – GMO Database". GMO Compass. European Union. 10 يوليو 2010. اطلع عليه بتاريخ 2015-03-01.
- ^ Molimard P، Spinnler HE (فبراير 1996). "Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties". Journal of Dairy Science. ج. 79 ع. 2: 169–184. DOI:10.3168/jds.S0022-0302(96)76348-8.
- ^ Guzm?n-Maldonado H، Paredes-L?pez O (سبتمبر 1995). "Amylolytic enzymes and products derived from starch: a review". Critical Reviews in Food Science and Nutrition. ج. 35 ع. 5: 373–403. DOI:10.1080/10408399509527706. PMID:8573280.
{{استشهاد بدورية محكمة}}: Vancouver style error: حرف غير لاتيني in name 1 (مساعدة) - ^ ا ب "Protease – GMO Database". GMO Compass. European Union. 10 يوليو 2010. اطلع عليه بتاريخ 2015-02-28.
- ^ Alkorta I، Garbisu C، Llama MJ، Serra JL (يناير 1998). "Industrial applications of pectic enzymes: a review". Process Biochemistry. ج. 33 ع. 1: 21–28. DOI:10.1016/S0032-9592(97)00046-0.
- ^ Bajpai P (مارس 1999). "Application of enzymes in the pulp and paper industry". Biotechnology Progress. ج. 15 ع. 2: 147–157. DOI:10.1021/bp990013k. PMID:10194388.
- ^ Begley CG، Paragina S، Sporn A (مارس 1990). "An analysis of contact lens enzyme cleaners". Journal of the American Optometric Association. ج. 61 ع. 3: 190–4. PMID:2186082.
- ^ Farris، Paul L. (2009). "Economic Growth and Organization of the U.S. Starch Industry". في BeMiller، James N.؛ Whistler، Roy L. (المحررون). Starch Chemistry and Technology (ط. 3rd). London: Academic. ISBN:9780080926551.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)
قراءة إضافيةتاريخ وتسمية الإنزيمات
بنية وآلية عمل الإنزيمات
الترموديناميك
|
الحركيات والتثبيط الإنزيمي
وظيفة وتحكم الإنزيمات في الخلية
اصطلاحات تسمية الإنزيمات
تطبيقات صناعية
|
وصلات خارجية
- Structure/Function of Enzymes, Web tutorial on enzyme structure and function.
- * Enzyme spotlight Monthly feature at the European Bioinformatics Institute on a selected enzyme.
- UK biotech and pharmaceutical industry The Biosystems Informatics Institute (Bii) is a new UK government initiative funded by the Department of Trade and Industry and the Regional Development Agency, One NorthEast. From its outset the Institute will undertake industry-facing research and development in collaboration with the UK biotech and pharmaceutical industry.
- AMFEP, Association of Manufacturers and Formulators of Enzyme Products
- BRENDA database, a comprehensive compilation of information and literature references about all known enzymes; requires payment by commercial users.
- Enzyme Structures Database links to the known 3-D structure data of enzymes in the بنك بيانات البروتين.
- ExPASy enzyme database, links to يونيبروت sequence data, entries in other databases and to related literature searches.
- KEGG: Kyoto Encyclopedia of Genes and Genomes Graphical and hypertext-based information on biochemical pathways and enzymes.
- MACiE database of enzyme reaction mechanisms.
- ميتاسيك database of enzymes and metabolic pathways
- 'Face-to-Face Interview with Sir John Cornforth who was awarded a Nobel Prize for work on stereochemistry of enzyme-catalyzed reactions Freeview video by the Vega Science Trust
- بوابة أيض
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء
- بوابة علم الأحياء
- بوابة مطاعم وطعام
- بوابة الكيمياء الحيوية
| في كومنز صور وملفات عن: إنزيم |

![{\displaystyle {\begin{matrix}{}\\{\ce {{CO2}+H2O->[{\ce {Carbonic\ anhydrase}}]H2CO3}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d17f8a66c1a14f8d4718f1efb0cb0fa604bcfb15)
![{\displaystyle {\begin{matrix}{}\\{\ce {{CO2}+H2O<-[{\ce {Carbonic\ anhydrase}}]H2CO3}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e370d6af4d3f76c17cb40f65ca8cdbceec4dd77c)


