حمض نووي ريبوزي منقوص الأكسجين: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
إضافة عنوان: أشكال خاصة |
إضافة عنوان: التغيرات الكيميائية وتحزيم الدنا المعدل |
||
| سطر 29: | سطر 29: | ||
لا يتواجد الدنا عـادة في الكائنات الحية على شكل جزيء واحد، وإنما زوج من الجزيئات مشدود لبعضه بشدة <ref name=FWPUB /><ref name=berg>Berg J., Tymoczko J. and Stryer L. (2002) ''Biochemistry.'' W. H. Freeman and Company {{ISBN|0-7167-4955-6}}</ref>، يلتف هذان الجزيئان (الشريطان) حول بعضهما البعض على شكل [[لولب مزدوج]]، تحوي النوكليوتيد على كل من الوحدة الأساسية للجزيء (التي تضمن تماسك السلسلة) و[[قاعدة نووية]] (التي تتفاعل مع الشريط الآخر في اللولب). القاعدة النووية المرتبطة بسكر تسمى [[نيوكليوسيد]] والقاعدة المرتبطة بسكر ومجموعة من الفوسفات أو أكثر تسمى [[نوكليوتيد]]. البوليمر المتكون من عدة نوكليوتيدات مترابطة يسمى [[عديد النوكليوتيد|عَدِيْدُ النوكليوتيد]]. <ref name="IUPAC">[http://www.chem.qmul.ac.uk/iupac/misc/naabb.html Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents] {{webarchive|url=https://web.archive.org/web/20070205191106/http://www.chem.qmul.ac.uk/iupac/misc/naabb.html |date=5 February 2007 }} IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Retrieved 3 January 2006.</ref> |
لا يتواجد الدنا عـادة في الكائنات الحية على شكل جزيء واحد، وإنما زوج من الجزيئات مشدود لبعضه بشدة <ref name=FWPUB /><ref name=berg>Berg J., Tymoczko J. and Stryer L. (2002) ''Biochemistry.'' W. H. Freeman and Company {{ISBN|0-7167-4955-6}}</ref>، يلتف هذان الجزيئان (الشريطان) حول بعضهما البعض على شكل [[لولب مزدوج]]، تحوي النوكليوتيد على كل من الوحدة الأساسية للجزيء (التي تضمن تماسك السلسلة) و[[قاعدة نووية]] (التي تتفاعل مع الشريط الآخر في اللولب). القاعدة النووية المرتبطة بسكر تسمى [[نيوكليوسيد]] والقاعدة المرتبطة بسكر ومجموعة من الفوسفات أو أكثر تسمى [[نوكليوتيد]]. البوليمر المتكون من عدة نوكليوتيدات مترابطة يسمى [[عديد النوكليوتيد|عَدِيْدُ النوكليوتيد]]. <ref name="IUPAC">[http://www.chem.qmul.ac.uk/iupac/misc/naabb.html Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents] {{webarchive|url=https://web.archive.org/web/20070205191106/http://www.chem.qmul.ac.uk/iupac/misc/naabb.html |date=5 February 2007 }} IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Retrieved 3 January 2006.</ref> |
||
الوحدة الأساسية لسلسة الدنـا تتكون من [[سكريات|سكر]] و[[فوسفات]] <ref name=Ghosh>{{cite journal | vauthors = Ghosh A, Bansal M | title = A glossary of DNA structures from A to Z | journal = Acta Crystallographica Section D | volume = 59 | issue = Pt 4 | pages = 620–6 | date = April 2003 | pmid = 12657780 | doi = 10.1107/S0907444903003251 }}</ref>، السكر في الدنا هو [[ريبوز منقوص الأكسجين]] وهو [[سكر خماسي (بنتوز)|بنتوز]] (سكر يحتوي على خمس ذرات [[كربون]])، ترتبط جزيئات السكر ببعضها بواسطة مجموعات فوسفات والتي تشكل روابط [[رابطة |
الوحدة الأساسية لسلسة الدنـا تتكون من [[سكريات|سكر]] و[[فوسفات]] <ref name=Ghosh>{{cite journal | vauthors = Ghosh A, Bansal M | title = A glossary of DNA structures from A to Z | journal = Acta Crystallographica Section D | volume = 59 | issue = Pt 4 | pages = 620–6 | date = April 2003 | pmid = 12657780 | doi = 10.1107/S0907444903003251 }}</ref>، السكر في الدنا هو [[ريبوز منقوص الأكسجين]] وهو [[سكر خماسي (بنتوز)|بنتوز]] (سكر يحتوي على خمس ذرات [[كربون]])، ترتبط جزيئات السكر ببعضها بواسطة مجموعات فوسفات والتي تشكل روابط [[رابطة فوسفات ثنائي الأستر|فوسفات ثنائية الأستر]] بين الذرة الثالثة والخامسة لحلقتي سكر متجاورتين. هذه [[رابطة تساهمية|الروابط]] اللامتناظرة تعني أن لسلسلة الدنا اتجاه، وفي اللولب المزدوج اتجاه النوكليوتيدات في أحد السلسلتين مضاد للاتجاه في السلسلة الأخرى وهذا يعني أن السلسلتين عكسيتا التوازي، نهايتا سلسلتا الدنا اللامتناظرتين يقال بأن لها [[الاتجاهية (علم الأحياء الجزيئي)|اتجاهية]] خمسة فتحة (5') و ثلاثة فتحة (3') حيث تحتوي نهاية 5' على مجموعة فوسفات طرفية والنهاية 3' على مجموعة [[هيدروكسيل]] طرفية، أحد الفروق الكبيرة بين الدنا و[[حمض نووي ريبوزي|الرنا]] هو السكر ففي الرنا يحل مكان الريبوز منقوص الأكسجين بنتوز وهو ال[[ريبوز]]. <ref name=berg/> |
||
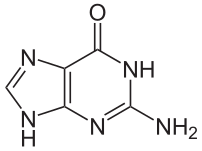
يستقر اللولب المزدوج للدنا أساسا بواسطة قوتين: [[رابطة هيدروجينية|الروابط الهيدروجينية]] بين النوكليوتيدات وتفاعلات التراص بين القواعد النووية ال[[عطرية]]. <ref name="Yakovchuk2006">{{cite journal | vauthors = Yakovchuk P, Protozanova E, Frank-Kamenetskii MD | title = Base-stacking and base-pairing contributions into thermal stability of the DNA double helix | journal = Nucleic Acids Research | volume = 34 | issue = 2 | pages = 564–74 | year = 2006 | pmid = 16449200 | pmc = 1360284 | doi = 10.1093/nar/gkj454 }}</ref>، في الوسط المائي للخلية [[رابطة باي|روابط باي]] (π) [[نظام مترافق|المترافقة]] لقواعد النوكليوتيدات تتراص عموديا مع محور جزيء الدنا مقللة تفاعلاتها مع [[صدفة مائية|الصدفة المائية]]. القواعد الأربعة المكونة للدنا هي [[أدينين]] (A)، [[سايتوسين]] (C)، [[غوانين]] (G) وال[[ثايمين]] (T)، وترتبط هذه القواعد بـ سكر-فوسفات لتشكل نوكليوتيدات كاملة (الصور بالأسفل)، يرتبط الأدينين مع الثايمين والغوانين مع سايتوسين ويمثلان بالزوج القاعدي A-T والزوج القاعدي G-C. <ref>Burton E. Tropp – ''"Molecular Biology"''- Jones and Barlett Learning, {{ISBN|978-0-7637-8663-2}}</ref><ref>{{cite web|url=https://www.mun.ca/biology/scarr/Watson-Crick_Model.html|title=Watson-Crick Structure of DNA – 1953|work=Steven Carr|publisher=Memorial University of Newfoundland|accessdate=13 July 2016|deadurl=no|archiveurl=https://web.archive.org/web/20160719095721/http://www.mun.ca/biology/scarr/Watson-Crick_Model.html|archivedate=19 July 2016|df=dmy-all}}</ref> |
يستقر اللولب المزدوج للدنا أساسا بواسطة قوتين: [[رابطة هيدروجينية|الروابط الهيدروجينية]] بين النوكليوتيدات وتفاعلات التراص بين القواعد النووية ال[[عطرية]]. <ref name="Yakovchuk2006">{{cite journal | vauthors = Yakovchuk P, Protozanova E, Frank-Kamenetskii MD | title = Base-stacking and base-pairing contributions into thermal stability of the DNA double helix | journal = Nucleic Acids Research | volume = 34 | issue = 2 | pages = 564–74 | year = 2006 | pmid = 16449200 | pmc = 1360284 | doi = 10.1093/nar/gkj454 }}</ref>، في الوسط المائي للخلية [[رابطة باي|روابط باي]] (π) [[نظام مترافق|المترافقة]] لقواعد النوكليوتيدات تتراص عموديا مع محور جزيء الدنا مقللة تفاعلاتها مع [[صدفة مائية|الصدفة المائية]]. القواعد الأربعة المكونة للدنا هي [[أدينين]] (A)، [[سايتوسين]] (C)، [[غوانين]] (G) وال[[ثايمين]] (T)، وترتبط هذه القواعد بـ سكر-فوسفات لتشكل نوكليوتيدات كاملة (الصور بالأسفل)، يرتبط الأدينين مع الثايمين والغوانين مع سايتوسين ويمثلان بالزوج القاعدي A-T والزوج القاعدي G-C. <ref>Burton E. Tropp – ''"Molecular Biology"''- Jones and Barlett Learning, {{ISBN|978-0-7637-8663-2}}</ref><ref>{{cite web|url=https://www.mun.ca/biology/scarr/Watson-Crick_Model.html|title=Watson-Crick Structure of DNA – 1953|work=Steven Carr|publisher=Memorial University of Newfoundland|accessdate=13 July 2016|deadurl=no|archiveurl=https://web.archive.org/web/20160719095721/http://www.mun.ca/biology/scarr/Watson-Crick_Model.html|archivedate=19 July 2016|df=dmy-all}}</ref> |
||
| سطر 112: | سطر 112: | ||
</gallery> |
</gallery> |
||
== التغيرات الكيميائية وتحزيم الدنا المعدل == |
|||
== أقدم دي أن إيه للمتكوكوندريا البشرية == |
|||
=== تغير القواعد وتحزيم الدنا === |
|||
* أقدم DNA: أعاد العلماء في عام 2013 تكوين [[جين]] [[ميتوكوندريا]] من بقايا إنسان أول يرجع تاريخه إلى نحو 400.000 سنة مضت وجد في [[أسبانيا]]، مما يجعله أقدم دي أن إيه يحصلون عليه من إنسان أولي. |
|||
<div class="thumb tleft" style="background:#f9f9f9; border:1px solid #ccc; margin:0.5em;"> |
|||
{| border="0" border="0" cellpadding="2" cellspacing="0" style="width:300px; font-size:85%; border:1px solid #ccc; margin:0.3em;" |
|||
|- |
|||
|[[File:Cytosin.svg|75px]] |
|||
|[[File:5-Methylcytosine.svg|95px]] |
|||
|[[File:Thymin.svg|97px]] |
|||
|- |
|||
|align=center|[[سايتوسين]] |
|||
|align=center|[[5-ميثيل سايتوسين]] |
|||
|align=center|[[ثايمين]] |
|||
|} |
|||
<div style="border: none; width:300px;font-size: 90%;"><div class="thumbcaption">بنية السايتوسين مع ومن دون المجموعة 5-ميثيل، [[نزع أمين|نزع الأمين]] يحول الـ5-ميثيل سايتوسين إلى ثايمين.</div></div></div> |
|||
يتأثر [[تعبير جيني|التعبير الجيني]] بطريقة تحزيم الدنا في [[كروموسوم|الصبغيات]] على هيئة تسمى [[كروماتين]]، يمكن لبعض القواعد أن تتغير حين يتم تكوين الكروماتينات في المناطق ضعيفة أو عديمة التعبير الجيني والغنية بقواعد ال[[سايتوسين]] عن طريق ال[[مثيلة]] خاصة في [[منطقة CpG|المناطق CpG]]، يمكن [[هستون|للهستونات]] التي يلتف حولها الدنا في الكروماتين أن تتغير بطريقة [[رابطة تساهمية|تساهمية]] ويمكن للكروماتين بحد ذاته أن يتغير بواسطة مركبات إعادة تشكيل الكروماتين، علاوة على ذلك فإن مثيلة الدنا والتعديل التساهمي للهستونات يساهمان معا في التأثير على الكروماتين والتعبير الجيني. <ref>{{cite journal | vauthors = Hu Q, Rosenfeld MG | title = Epigenetic regulation of human embryonic stem cells | journal = Frontiers in Genetics | volume = 3 | pages = 238 | year = 2012 | pmid = 23133442 | pmc = 3488762 | doi = 10.3389/fgene.2012.00238 }}</ref> |
|||
على سبيل المثال تُنتج مثيلة السايتوسين [[5-ميثيل سايتوسين]] وهو ضروري في [[تعطيل الصبغي X]] <ref>{{cite journal | vauthors = Klose RJ, Bird AP | title = Genomic DNA methylation: the mark and its mediators | journal = Trends in Biochemical Sciences | volume = 31 | issue = 2 | pages = 89–97 | date = February 2006 | pmid = 16403636 | doi = 10.1016/j.tibs.2005.12.008 }}</ref>، يختلف متوسط معدلات المثيلة بين الكائنات فالدودة [[ربداء رشيقة]] تعوز مثيلة السايتوسين في حين أن ال[[فقاريات]] لديها معدل مرتفع يصل حتى 1% من الدنا الخاص بها يحوي 5-ميثيل سايتوسين <ref>{{cite journal | vauthors = Bird A | title = DNA methylation patterns and epigenetic memory | journal = Genes & Development | volume = 16 | issue = 1 | pages = 6–21 | date = January 2002 | pmid = 11782440 | doi = 10.1101/gad.947102 }}</ref>، رغم أهمية الـ5-ميثيل سايتوسين إلا أنه قد يتعرض إلى [[نزع أمين]] ويصبح ثايمين وكذلك السايتوسين الذي يصبح [[يوراسيل]]، قواعد السايتوسين المُمَثْيَلة عرضة [[طفرة (أحياء)|للطفرات]] <ref>{{cite journal | vauthors = Walsh CP, Xu GL | title = Cytosine methylation and DNA repair | journal = Current Topics in Microbiology and Immunology | volume = 301 | pages = 283–315 | year = 2006 | pmid = 16570853 | doi = 10.1007/3-540-31390-7_11 | isbn = 3-540-29114-8 | series = Current Topics in Microbiology and Immunology }}</ref>. من التغييرات الأخرى للقواعد مثيلة الأدنين عند البكتيريا ووجود [[5-هيدروكسي ميثيل سايتوسين]] في الدماغ. <ref>{{cite journal | vauthors = Kriaucionis S, Heintz N | title = The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain | journal = Science | volume = 324 | issue = 5929 | pages = 929–30 | date = May 2009 | pmid = 19372393 | pmc = 3263819 | doi = 10.1126/science.1169786 | bibcode = 2009Sci...324..929K }}</ref> و[[ارتباط بالغليكوزيل|غلكزة]] اليوراسيل لإنتاج ال[[قاعدة ج]] لدى [[ذوات منشأ الحركة]]. <ref>{{cite journal | vauthors = Ratel D, Ravanat JL, Berger F, Wion D | title = N6-methyladenine: the other methylated base of DNA | journal = BioEssays | volume = 28 | issue = 3 | pages = 309–15 | date = March 2006 | pmid = 16479578 | pmc = 2754416 | doi = 10.1002/bies.20342 }}</ref><ref>{{cite journal | vauthors = Gommers-Ampt JH, Van Leeuwen F, de Beer AL, Vliegenthart JF, Dizdaroglu M, Kowalak JA, Crain PF, Borst P | title = beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei | journal = Cell | volume = 75 | issue = 6 | pages = 1129–36 | date = December 1993 | pmid = 8261512 | doi = 10.1016/0092-8674(93)90322-H }}</ref> التي تعمل كإشارة إنهاء [[نسخ (وراثة)|النسخ]] للأنزيم [[بوليميرايز الرنا 2]]. <ref name="10.1016/j.cell.2012.07.030">{{Article| nom1 = Henri G.A.M. van Luenen, Carol Farris, Sabrina Jan, Paul-Andre Genest, Pankaj Tripathi, Arno Velds, Ron M. Kerkhoven, Marja Nieuwland, Andrew Haydock, Gowthaman Ramasamy, Saara Vainio, Tatjana Heidebrecht, Anastassis Perrakis, Ludo Pagie, Bas van Steensel, Peter J. Myler et Piet Borst| titre = Glucosylated Hydroxymethyluracil, DNA Base J, Prevents Transcriptional Readthrough in ''Leishmania''| périodique = Cellvolume = 150| numéro = 5| jour = 31| mois = août| année = 2012| pages = 909-921| url texte = http://www.cell.com/cell/abstract/S0092-8674%2812%2900942-7| consulté le = 12 mars 2015| doi = 10.1016/j.cell.2012.07.030| pmid = 22939620| pmc = 3684241 |
|||
}}</ref> <ref name="10.1016/j.cub.2012.10.010">{{Article| nom1 = Dane Z. Hazelbaker et Stephen Buratowski| titre = Transcription: Base J Blocks the Way| périodique = Current Biology| volume = 22| numéro = 22| jour = 20mois = novembre| année = 2012| pages = R960-R962| url texte = http://www.cell.com/current-biology/abstract/S0960-9822%2812%2901195-5| consulté le = 12 mars 2015| doi = 10.1016/j.cub.2012.10.010| pmid = 23174300| pmc = 3648658 |
|||
}}</ref> |
|||
=== تضرر === |
|||
==هيموجلوبين الجنين== |
==هيموجلوبين الجنين== |
||
| سطر 126: | سطر 145: | ||
{{مفصلة| جين | التليف الكيسي}} |
{{مفصلة| جين | التليف الكيسي}} |
||
== انظر |
== انظر أيضا == |
||
{{columns-list|5| |
|||
* [[حمض نووي|الحمض النووي]]. |
* [[حمض نووي|الحمض النووي]]. |
||
* [[حمض نووي ريبوزي]] (RNA) |
* [[حمض نووي ريبوزي]] (RNA) |
||
| سطر 142: | سطر 162: | ||
* [[فضلة الدي أن إيه]]. |
* [[فضلة الدي أن إيه]]. |
||
* [[تي بلازميد]]. |
* [[تي بلازميد]]. |
||
}} |
|||
== معلومات إضافية == |
== معلومات إضافية == |
||
* {{مشروع الدليل المفتوح|Science/Biology/Biochemistry_and_Molecular_Biology/Biomolecules/Nucleic_Acids/DNA/|DNA}} |
* {{مشروع الدليل المفتوح|Science/Biology/Biochemistry_and_Molecular_Biology/Biomolecules/Nucleic_Acids/DNA/|DNA}} |
||
نسخة 12:36، 26 فبراير 2018
هذه المقالة غير مكتملة، وربما تنقصها بعض المعلومات الضرورية. |


الحمض الريبوزي النووي المنزوع الأكسجين أو حمض الديوكسي ريبونيوكليك[1] أو الحمض النووي الريبوزي منقوص الأكسجين أو الحمض النووي الصبغي أو كما يسمى في هذه المقالة دي إن إيه (DNA) بالإنجليزية، والدِنا هو مجموعات كبيرة متكررة من الأحماض النووية تتشكل في هيئة سلسلتين طويلتين حلزونتين من الجزيئات وتربط بين السلسلتين أحماضا نووية مثل درجات السلم. الدي أن إيه هو العماد الأساسي للكائنات الحية ووجود الحياة على الأرض. إذ أنه يمكن أن يكرر نفسه، أي يصنع مثيلا له. وهو الذي يحتوي على التعليمات الجينية التي تصف التطور البيولوجي للكائنات الحية ومعظم الفيروسات؛ كما أنه يحوي التعليمات الوراثية اللازمة لتكوين أعضاء الجنين سواء في الرحم أو البيضة أو النبات، أي لكل الكائنات الحية.
يعتبر وسيلة التخزين الطويل الأجل للمعلومات الوراثية وهي الوظيفة الأساسية لجزيئات الدي أن إيه بالإضافة إلى أنه يمكن من خلال هذه الجزيئات الحصول على المعلومات اللازمة لبناء البروتينات والحمض الريبي النووي (بالإنجليزية: RNA). تسمى قطع الدي أن إيه (DNA) التي تحمل معلومات وراثية يمكن ترجمتها لبروتينات بالمورثات أو الجينات. تتواجد بعض قطع الدي أن إيه لأغراض تركيبية وتنظيمية.
كيميائياً؛ يتكون الدي أن إيه من سلسلتين من الجزيئات مرتبطتين ببعضهما البعض وتشكل اللولب المزدوج. وهذه السلسلتان تمثلان ضلعي "سلم"، وحداته البنائية تسمى النيوكليوتيدات. وتتكون السلسلتان من سكر خماسي الكربون ريبوزي منقوص الأكسجين ومجموعة فوسفات. وتربط القواعد النتروجينية - وهي تمثل درجات السلم - بين السلسلتين؛ وهذه القواعد النتروجينة هي: غوانين (G) وأدينين (A) وثيمين (T) وسيتوزين (C). وكل قاعدتين تشكل درجة من درجات "السلم" تربط الضلعين ببعضهما البعض. وكل اثنين من تلك النيوكليوتيدات (القواعد النتروجينية) ترتبط مع بعضها البعض برابطة تساهمية، ويتم الإرتباط بين جزيئات السكر والفوسفات بشكل متتابع لتكوين ما يعرف بهيكل سكر الفوسفات (الضلعين). وبناء على قواعد الإرتباط، فإن كل سلسلة دي أن إيه تحتوي على قواعد نيتروجينية ترتبط ببعضها (الأدنين مع الثيامين والجوانين مع السايتوسين) برابطة هيدروجينية مكونة بذلك الروابط العرضية للحلزون المزدوج (السلم).
لكل من غوانين (G) وأدينين (A) وثيمين (T) وسيتوزين (C) شكله الخاص. فشكل الأدينين (A) يرتبط ب ثيمين (T)؛ والسيتوزين (C) يمكن أن يرتبط مباشرة بالغوانين (G). وتسمى هذه "أزواج قواعد" Base pairs. ويمكن بناءا على ذلك تخيل أن جزيء الدي أن إيه عبارة عن سلم حلزوني تتكون فيه كل درجة من زوج قواعد واحد. وعلى هذا الأساس تكون هناك أربعة احتمالات للترابط وتكوين درجة للسلم T-A , A-T : C-G , G-C : فإذا حدث وأن أصاب أحد القواعد تلفا أو ضاع، فإن تعويضه يمكن أن يتم بسهولة عن طريق نصف الدرجة الباقي فلا يتم تعويض ثيمين T مثلا إلا بثيمين T. أي أن الحلزون المزدوج في استطاعته تكوين نسخة منه، حيث أن كلا الضلعين يمكن أن يكون قالبا لصناعة نسخة منه. فإذا قمت بقسم السلم إلى ضلعيه عبر الروابط بين أزواج القواعد بطول الدي أن إيه ، فإن كل من الضلعين يحوي المعلومات الكاملة لإعادة بناء نسخة من الأصل.
بالتالي يمكن تصور أن الدي أن إيه عبارة عن مخطوطة، أو برمجة سوفتوير، موجودة في نواة خلية. واللغة المكتوبة بها تتكون من أربعة حروف. والجملة المكونة من عدة كلمات منها تعرف بأنها جين. وكل جين يتكون من مئات أو آلاف الحروف. وجميع الوظائف التي تؤديها الخلية - حتى لو كانت خلية بشرية معقدة مثلنا - فهي تنظم عملها وفقا لترتيب الشفرة المكتوبة بالحروف الأربعة في هذا المخطوط.
يعطي تتابع القواعد النيتروجينية على طول هيكل سكر الفوسفات في جزيء الدي أن إيه شفرات codes يمكن من خلالها تحديد تتابع الأحماض الأمينية التي تكون البروتين. ويتم ذلك كما يلي: يتم نسخ جزيء آر أن إيه مقابلا لجزيء الدي أن إيه المحتوي على كود البروتين في عملية تسمي بعملية النسخ. ويتم ترجمة الرموز إلى أحماض أمينية مقابلة خلال عملية الترجمة لتعطي البروتين المقابل. وليس بالضرورة أن تترجم كامل الشفرة إلى بروتين إذ أن بعض جزيئات الآر أن إيه تقوم بوظائف تركيبية أخرى مثل الريبوسومات وجسيمات التضفير.
حجم الدي أن إيه داخل كل خلية ضخم فلذلك يرتبط ببروتين يسمى الهستون وهو مشحون بشحنة موجبة فيستطيع الإرتباط بالدي أن إيه ذو الشحنة السالبة فيكون تركيبات تسمى الكروموسومات، والكروموسومات في مجموعها تكون ما يعرف بالجينوم (المحتوى الجيني أو الصبغي للخلية). وقبل أنقسام الخلية تتضاعف الصبغيات فيما يعرف بتضاعف الدي أن إيه ويتم ذلك في كل من بدائيات النوى وفي حقيقيات النواة.
لمحة تاريخية
تعود أول ملاحظة للدي أن إيه في العلم الحديث للطبيب السويسري فريدريك ميسشر في سنة 1869 عندما استطاع استخلاص مادة مجهرية من القيح واسمها نووين (نيوكلين) بسبب وجودها داخل النواة. وفي سنة 1929 استطاع فيبي ليفني من اكتشاف مكونات الوحدة الأساسية للدي أن إيه وهي النوويدات وبين أن الدي أن إيه ما هو إلا تكرار لهذه الوحدة.
في سنة 1943 أجرى أوزوالد آفري تجربة بمزج بكتيريا نيموكوكس (الاسم العلمي: Pneumococcus) ميتة وتحمل خاصية السطح الناعم مع بكتيريا حية من نفس النوع ولكنها ذات سطح خشن. نتائج التجربة كانت انتقال خاصية السطح الخشن إلى البكتيريا ذات السطح الناعم. وسمي الدي أن إيه بالعامل الناقل.
و في سنة 1953 وبالاعتماد على الصور السينية المأخوذة بواسطة روزاليند فرانكلين والمعلومات المتوفرة عن القواعد وطريقة ارتباطها ببعضها، طرح كل من جيمس واتسون وفرانسيس كريك نموذجهما (اللولبي المزدوج)و نشروا تجاربهم في مجلة الطبيعة. وفي سنة 1957 وضح كريك العقيدة الأساسية لعلم الأحياء الجزيئي ووضح العلاقة ما بين الدي أن إيه والآر أن إيه(RNA) والبروتينات. وبين كريك لاحقا أن الكودونات تتكون من 3 قواعد مما ساعد علماء آخرين على فك الشيفرة الوراثية وتحديد الكودونات المشفرة للأحماض الأمينية. وفي سنة 1958 أوضح العالمان ميليسون وستال طريقة تناسخ الدي أن إيه ووصفاها بالشبه محافظة. حصل واتسون وكريك وموريس على جائزة نوبل في الطب لاكتشافاتهم في هذا الحقل في سنة 1962.
الخصائص
الدنا عبارة عن بوليمر طويل مكون من وحدات متكررة تسمى نوكليوتيدات [2][3]، بُنية الدنا ديناميكية على طول امتدادها، كونها قادرة على الالتفاف إلى حلقات ضيقة وأشكال أخرى [4]. في كل الأصناف يتكون الدنا من سلسلتين لولبيتين مربوطتين إلى بعضهما البعض بواسطة روابط هيدروجينية، كلا السلسلتين ملتفتان حول نفس المحور ولهما نفس طول السن الولبي 34 أنغستروم (3.4 نانومتر) والقطر 10 أنغستروم (1 نانومتر). [5] تبعا لدراسة أخرى تم فيها القياس في محلول مختلف، كان عرض سلسلة الدنا من 22 إلى 26 أنغستروم (2.2-2.6 نانومتر) وطول نوكليوتيدة واحدة 3.3 أنغستروم (0.33 نانومتر) [6]، رغم أن وحدة النوكليوتيد المتكررة صغيرة جدا إلا أن بوليمرات الدنـا يمكن أن تكون كبيرة جدا وتحوي ملايين أو مئات الملايين من النوكليوتيدات، مثلا: الدنا في أكبر كروموسوم بشري الصبغي 1 يتكون مما يقارب 220 مليون زوج قاعدي [7] وسيبلغ طوله 85 ملم لو تمت إطالته.
لا يتواجد الدنا عـادة في الكائنات الحية على شكل جزيء واحد، وإنما زوج من الجزيئات مشدود لبعضه بشدة [5][8]، يلتف هذان الجزيئان (الشريطان) حول بعضهما البعض على شكل لولب مزدوج، تحوي النوكليوتيد على كل من الوحدة الأساسية للجزيء (التي تضمن تماسك السلسلة) وقاعدة نووية (التي تتفاعل مع الشريط الآخر في اللولب). القاعدة النووية المرتبطة بسكر تسمى نيوكليوسيد والقاعدة المرتبطة بسكر ومجموعة من الفوسفات أو أكثر تسمى نوكليوتيد. البوليمر المتكون من عدة نوكليوتيدات مترابطة يسمى عَدِيْدُ النوكليوتيد. [9]
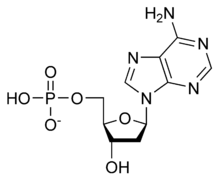
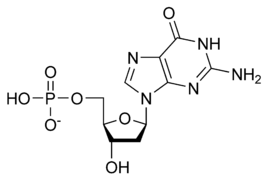
الوحدة الأساسية لسلسة الدنـا تتكون من سكر وفوسفات [10]، السكر في الدنا هو ريبوز منقوص الأكسجين وهو بنتوز (سكر يحتوي على خمس ذرات كربون)، ترتبط جزيئات السكر ببعضها بواسطة مجموعات فوسفات والتي تشكل روابط فوسفات ثنائية الأستر بين الذرة الثالثة والخامسة لحلقتي سكر متجاورتين. هذه الروابط اللامتناظرة تعني أن لسلسلة الدنا اتجاه، وفي اللولب المزدوج اتجاه النوكليوتيدات في أحد السلسلتين مضاد للاتجاه في السلسلة الأخرى وهذا يعني أن السلسلتين عكسيتا التوازي، نهايتا سلسلتا الدنا اللامتناظرتين يقال بأن لها اتجاهية خمسة فتحة (5') و ثلاثة فتحة (3') حيث تحتوي نهاية 5' على مجموعة فوسفات طرفية والنهاية 3' على مجموعة هيدروكسيل طرفية، أحد الفروق الكبيرة بين الدنا والرنا هو السكر ففي الرنا يحل مكان الريبوز منقوص الأكسجين بنتوز وهو الريبوز. [8]
يستقر اللولب المزدوج للدنا أساسا بواسطة قوتين: الروابط الهيدروجينية بين النوكليوتيدات وتفاعلات التراص بين القواعد النووية العطرية. [11]، في الوسط المائي للخلية روابط باي (π) المترافقة لقواعد النوكليوتيدات تتراص عموديا مع محور جزيء الدنا مقللة تفاعلاتها مع الصدفة المائية. القواعد الأربعة المكونة للدنا هي أدينين (A)، سايتوسين (C)، غوانين (G) والثايمين (T)، وترتبط هذه القواعد بـ سكر-فوسفات لتشكل نوكليوتيدات كاملة (الصور بالأسفل)، يرتبط الأدينين مع الثايمين والغوانين مع سايتوسين ويمثلان بالزوج القاعدي A-T والزوج القاعدي G-C. [12][13]
تصنيف وترابط القواعد النووية
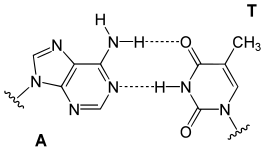
تنقسم قواعد الدنا النووية الأساسية إلى قسمين: البيورينات ويندرج ضمنها الأدنين والغوانين وهما جزيئان ثنائيي الحلقة يحويان حلقتان متغايرتان مندمجتان إحدهما سداسية والأخرى خماسية، والبريميدينات ويندرج ضمنها السايتوسين والثايمين وهما جزيئان أحاديي الحلقة عبارة عن حلقة سداسية متغايرة[8]. تتشكل الأزواج القاعدية للولب المزدوج للدنا بترابط بيورين في إحدى السلسلتين مع بيريميدين في السلسلة الأخرى بواسطة اثنتين أو ثلاثة من الروابط الهيدروجينية:
- يرتبط الأدينين مع الثايمين بواسطة رابطتي هيدروجين ليشكل الرابطة A=T.
- يرتبط الغوانين مع السايتوسين بواسطة ثلاث روابط هيدروجينية ليشكل الرابطة G≡C.
يسمى هذا الترابط لقاعدتين نوويتين من سلسلتي اللولب المزدوج برابطة واتسون-كريك، يوجد نوع آخر من الترابط يسمى ترابط هوغستين يتم فيه ترابط قاعدتي الغوانين والسايتوسين بواسطة رابطتي هيدروجين. [14]، كون الروابط الهيدروجينية غير تساهمية يسمح بكسرها وإعادة ربطها بسهولة معتبرة ومنه يمكن فصل سلسلتي اللولب المزدوج للدنا كالسحاب سواء بقوة ميكانيكية أو بدرجة حرارة مرتفعة. [15] ونتيجة لهذا التكامل في ترابط القواعد فإن جميع المعلومات التي تحويها إحدى سلسلتي اللولب المزدوج منسوخة في السلسلة الأخرى وهو أمر أساسي في عملية تضاعف الدنا ومختلف وظائفه الأخرى لدى الكائنات الحية.[3]
توجد قاعدة نووية خامسة وهي بيريميدين يسمى اليوراسيل (U) يأخذ مكان الثايمين في الرنا (RNA) ويختلف عنه بأنه لا يملك مجموعة ميثيل في حلقته، بالإضافة إلى الدنا والرنا تم إنتاج العديد من نظائر الأحماض النووية الاصطناعية لدراسة خصائصها أو لاستعمالها في التقنية الحيوية.[16]
الاتجاه وضد الاتجاه

لإنتاج رنـا وظيفي لا يتم سوى نسخ جزء معين من إحدى سلسلتي الدنا التي تحوي على الجين وذلك لأن السلسلتين ليستا متماثلتين، ويقال لتسلسل الدنا بأنه "اتجاه" إذا كان مماثلا للتسلسل على نسخة الرنا الرسول التي تُرجمت إلى بروتين [17] ويكون ذلك في السلسلة التي لم يتم نسخها (انظر الشكل)، أما تسلسل السلسلة القالب (التي تم نسخها) فيسمى "ضد الاتجاه" وذلك لأنه مكمل لتسلسل الرنا الرسول. تسمى أحيانا السلسلة التي يتم نسخها "سلسلة التشفير" والمقابلة لها "سلسلة اللاتشفير" إلا أن هذه الدلالة صالحة فقط بالنسبة لجين معين وذلك لأن سلسلتي نفس اللولب المزدوج من الدنا يمكن أن تشفرا بروتينات مختلفة. يمكن أن يتواجد كلا التسلسُلَين "الاتجاه" و"ضد الاتجاه" على أجزاء مختلفة من نفس سلسلة الدنا (أي يمكن لكلا السلسلتين أن تحويا كلا من الاتجاه وضد الاتجاه).
يتم إنتاج تسلسلات رنـا ضد الاتجاه في كل من حقيقيات وبدائيات النوى، إلا أن وظائفها غير واضحة بالكامل [18]، ويشير أحد الإقتراحات إلى أن سلاسل الرنا ضد الاتجاه تساهم في ضبط التعبير الجيني عبر ترابط قواعد رنا-رنا. [19]
بعض تسلسلات الدنا في بدائيات وحقيقيات النوى وبنسبة أكثر في البلازميدات والفيروسات يتعسر فيها التمييز بين سلسلتي الاتجاه وضد الاتجاه لوجود جينات متداخلة [20]. في هذه الحالات تقوم تسلسلات الدنا بوظيفة مضاعفة، تشفير بروتين معين حين تتم قراءتها على طول إحدى السلسلتين، وبروتين آخر حين تقرأ في الاتجاه المعاكس على طول السلسلة الأخرى. في البكتيريا قد يساهم هذا التداخل في ضبط نسخ الجينات [21]، أما لدى الفيروسات فيزيد في مقدار المعلومة التي يمكن تشفيرها داخل جينوم فيروسي صغير. [22]
دنا فائق الالتفاف
يكون الدنا خلال معظم عمر الخلية ملفوفا بخفة حول الهستونات ولا يكون مركزا على هيئة كروموسوم، ولا يظهر اللف الفائق للدنا على شكل كروموسومات إلا خلال مرحلة انقسام الخلية [23]. يمكن لف الدنا مثل الحبل خلال عملية تسمى لف الدنا الفائق، وفي حالة الراحة تلتف سلسلة الدنا حول محور اللولب المزدوج مرة كل 10.4 زوج قاعدي، أما إن كان الدنا ملفوفا فإن سلسلتيه تصبحان أشد أو أخف التفافا [24]. حيث إن كان ملفوفا في اتجاه اللولب المزدوج فإن القواعد تصبح متراصة أكثر ويسمى ذلك الالتفاف الفائق الموجب إما إن كان ملفوفا عكس اتجاه اللولب المزدوج فإن القواعد تصبح أقل تراصا ويسمى ذلك بالالتفاف الفائق السالب. لِمعظمِ الدنا في الطبيعة التفافٌ فائق سلبي تُحدِثـه إنزيمات التوبوايزوميراز [25] ، هذه الانزيمات مطلوبة لتزيل التفاف سلسلتي الدنا أثناء عمليتي نسخ وتضاعف الدنا. [26]
أشكال الدنا

يتواجد الدنا على عدة أشكال منها الدنا أ، الدنا ب والدنا ز، رغم أنه لم يتم سوى ملاحظة الشكلين دنا أ ودنا ب في كائناتٍ وظيفيةٍ [10]. البنية التي يتخذها الدنا تعتمد على مستوى التميؤ، تسلسل الدنا، كمية واتجاه اللف الفائق، التغيرات الكيميائية للقواعد، نوع وتركيز الآيونات المعدنية ووجود متعددات الأمين في المحلول. [27]
لمعرفة بنية الدنا قام العلماء باستخدام تقنية دراسة البلورات بالأشعة السينية وكانت التقارير المنشورة الأولى حول أنماط حيود الأشعة السينية للدنا أ وب قد استخدمت دراسات مبنية على تحول باتيرسون التي أعطت معلومات محدودة عن هيئة سلال الدنا الموجهة [28][29]. وسنة 1953 تم اقتراح دراسات أخرى بواسطة ويلكنز وآل لأنماط حيود وانتشار الأشعة السينية للدنا ب العالي التميؤ في الكائنات الحية وكانت عبارة عن مربعات دوال بيسل [30]. وفي نفس الصحيفة قدم جيمس واتسون وفرنسيس كريك دراساتهما حول النموذج الجزيئي لأنماط حيود الأشعة السينية للدنا مقترحين أن الهيئة كانت لولبا مزدوجا. [5]
رغم أن الهيئة ب هي الأكثر شيوعا في الظروف الموجودة داخل الخلايا [31] إلا أنها ليست هيئة محددة بدقة وإنما عائلة متقاربة من هيئات الدنا [32] التي تظهر في حالات التميؤ العالية الموجودة داخل الخلايا الحية، وأنماط حيود وانتشار الأشعة السينية الخاصة بها هي سمة تميز البلورات الناقِصَة (paracrystals) مع درجة معتبرة من عدم الانتظام. [33][34]
مقارنة بالدنا ب فإن الدنا أ له قطر أكبر ويميني الإتجاه كذلك وله ثلم صغير سطحي وعريض وثلم كبير أضيق وأعمق، تظهر هذه الهيئة في الظروف غير الفيسيولوجية في عينات الدنا المجففة جزئيا، أما في الخلايا الحية فيمكن أن يتم إنتاجه في تزواج هجين لسلاسل الدنا والرنا وفي معقدات إنزيم-دنا. [35][36]، قِطعُ الدنا التي عُدِلت فيها القواعد كيميائيا بواسطة المثيلة يمكن أن تخضع لتحول كبير في الهيئة وتتخذ البنية ز التي تلتف فيها القواعد على يسار محور اللولب عكس البنية ب الأكثر شيوعا [37] هذا الشكل غير الاعتيادي يمكن التعرف عليه بواسطة بروتينات ترتبط بشكل خاص مع الدنا ز ويمكن أن يكون له دور في ضبط النسخ. [38]

| خصائص | دنا أ | دنا ب | دنا ز |
|---|---|---|---|
| اتجاه اللولب المزدوج | يمين | يمين | يسار |
| تكرار الوحدة | 1 bp | 1 bp | 2 bp |
| زاوية دوران اللولب المزدوج لكل زوج قاعدي | 32,7° | 34,3° | 60°/2 |
| عدد الأزواج القاعدية لكل دورة للولب المزدوج | 11 | 10,5 | 12 |
| السن اللولبي للولب المزدوج لكل دورة | 2.82 نانومتر | 3.32 نانومتر | 4.56 نانومتر |
| البعد بين القواعد داخل اللولب المزدوج | 0.26 نانومتر | 0.34 نانومتر | 0.37 نانومتر |
| القطر | 2.3 نانومتر | 2.0 نانومتر | 1.8 نانومتر |
| انحناء الأزواج القاعدية بالنسبة لمحور اللولب المزدوج | +19° | −1,2° | −9° |
| متوسط الالتواء (propeller twist) | +18° | +16° | 0° |
| اتجاه القواعد بالنسبة للسكر | عكس | عكس | بيريميدين : عكس بيورين : مع |
| انحناء روابط ذرات السكر (Sugar pucker) |
'C3-إندو | 'C2 - إندو | سايتوسين : 'C2 - إندو غوانين : 'C2 - إكسو |
أشكال خاصة

- موصل هوليداي: يتم تكوين موصل هوليداي خلال التأشيب المتماثل بين جزيئي دنا يحملان نفس المعلومة الوراثية (صبغيات متماثلة، كروماتيد شقيق)، لدى هذا الموصل هيئة على شكل صليب مع تسلسلات متماثلة تسمح له بالتحرك نحو اتجاه واحد أو الآخر. يتم إنشاؤه بواسطة مركب إنزيمي يسمى ريزولفاز (رتإ 3.1.22.4) ويمكن أن يقود إلى تعابر بين الجزيئين ينتج عنه تبادلٌ للمعلومات الوراثية. [43].
- دنا دبوس الشعر: يمكن لتسلسلات الدنا المتناظرة الالتفاف وتشكيل بنية تسمى الحلقة الجذعية [44]. بعض التسلسلات وخاصة التسلسلات ثلاثية النوكليوتيد (CAG)n أو (CTG)n يمكن أن تشكل دبابيس شعر غير تامة تكون فيها بقايا الغوانين والسايتوسين مترابطة وبقايا الأدينين والثايمين غير مترابطة. [45].
- الدنا الثلاثي: هي هيئة دنا تقوم فيها ثلاث جزيئات قليل النوكليوتيد بالالتفاف حول بعضها لتشكيل لولب ثلاثي، في هذه البنية تقوم تقوم سلسة دنا منفردة بالارتباط بلولب دنا مزدوج من البنية ب بواسطة الروابط الهيدروجينية العادية أو المعكوسة لهوغستين، ويمكن أن تلعب هذه الهيئة دورا في الضبط الوظيفي للتعبير الجيني عن طريق تعديل نسخها لجزيئات رنا.
- الدنا الرباعي: تحتوي نهاية الصبغي الخطي على مناطق خاصة تدعى قسيمات طرفية وظيفتها السماح للخلية بمضاعفة نهايات الصبغي باستخدام إنزيم تيلوميراز وذلك لأن الإنزيمات التي تُضاعِف الدنا عادة لا يمكنها نسخ النهايات 3' للصبغيات [46]. كما تساعد هذه المناطق في حماية نهايات الدنا وإيقاف أنظمة الترميم في الخلية من اعتبارها تلفا يجب إصلاحه [47]. في الخلايا البشرية القسيمات الطرفية عبارة سلسلة منفردة من الدنا تحوي الآلاف من الوحدات النوكليوتدية البسيطة TTAGGG المتكررة. [48]
هذه التسلسلات الغنية بالغوانين يمكن أن تجعل نهايات الصبغي مستقرة بتشكيل هياكل مرصوصة بوحدات رباعية القواعد بدل ثنائية القواعد المعتادة الموجودة في هياكل الدنا الأخرى، حيث تقوم أربع قواعد غوانين بتشكيل وحدة رباعية مسطحة وبعدها تتراص هذه الوحدات الرباعية فوق بعضها لتشكيل بنية رباعي-غ مستقرة [49]. تستقر هذه الهياكل الرباعية بواسطة روابط هيروجينية بين نهايات هذه القواعد وتمخلب أيون معدني في مركز كل وحدة رباعية [50].
بالإضافة إلى هذه الهياكل المرصوصة، تشكل القسيمات الطرفية كذلك هياكل تسمى حلقات القسيم الطرفي أو حلقات ت تقوم فيها سلسلة دنا منفردة بالالتواء في حلقة طويلة تستقر بواسطة إنزيمات ترتبط بالقسيمات الطرفية [51]. في نهاية الحلقة ت يتم ضم السلسلة المنفردة للقسيم الطرفي إلى منطقة لدنًا مضاعفِ السلسلة وهذا يتسبب في إخلال التزاوج القاعدي لإحدى سلسلتي هذا اللولب المزدوج وتشكيل بنية ثلاثية السلاسل تسمى حلقة الإزاحة أو الحلقة د. [49]
- الدنا المتفرع: يحدث انسلال الدنا في إحدى نهايتي اللولب المزدوج حين تتوقف تسلسلات سلسلتَيْهِ عن كونها متكاملة حيث تفترق السلسلتان عن بعضهما وتتخذان هيئة Y، ويمكن للدنا أن يتشعب إن وُجدت سلسلة دنا ثالثة تحوي تسلسلا مكملا لكلا تسلسلي السلسلتين المفترقتين، فتتشكل هيئة مزدوجة متكاملة على شكل Y. مع أن أبسط أمثلة الدنا المتفرع تحوي ثلاث سلاسل دنا فقط فإن تواجد مركبات متفرعة تحوي سلاسل إضافية وعدة تفرعات أخرى ممكن كذلك [52]. ويتم استخدام الدنا المتفرع في تقنية النانو للدنا لإنشاء أشكال هندسية.
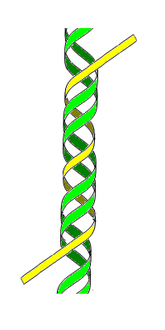
-
دنا ثلاثي، السلسلة
الثالثة بالأصفر.
التغيرات الكيميائية وتحزيم الدنا المعدل
تغير القواعد وتحزيم الدنا

|

|

|
| سايتوسين | 5-ميثيل سايتوسين | ثايمين |
يتأثر التعبير الجيني بطريقة تحزيم الدنا في الصبغيات على هيئة تسمى كروماتين، يمكن لبعض القواعد أن تتغير حين يتم تكوين الكروماتينات في المناطق ضعيفة أو عديمة التعبير الجيني والغنية بقواعد السايتوسين عن طريق المثيلة خاصة في المناطق CpG، يمكن للهستونات التي يلتف حولها الدنا في الكروماتين أن تتغير بطريقة تساهمية ويمكن للكروماتين بحد ذاته أن يتغير بواسطة مركبات إعادة تشكيل الكروماتين، علاوة على ذلك فإن مثيلة الدنا والتعديل التساهمي للهستونات يساهمان معا في التأثير على الكروماتين والتعبير الجيني. [54]
على سبيل المثال تُنتج مثيلة السايتوسين 5-ميثيل سايتوسين وهو ضروري في تعطيل الصبغي X [55]، يختلف متوسط معدلات المثيلة بين الكائنات فالدودة ربداء رشيقة تعوز مثيلة السايتوسين في حين أن الفقاريات لديها معدل مرتفع يصل حتى 1% من الدنا الخاص بها يحوي 5-ميثيل سايتوسين [56]، رغم أهمية الـ5-ميثيل سايتوسين إلا أنه قد يتعرض إلى نزع أمين ويصبح ثايمين وكذلك السايتوسين الذي يصبح يوراسيل، قواعد السايتوسين المُمَثْيَلة عرضة للطفرات [57]. من التغييرات الأخرى للقواعد مثيلة الأدنين عند البكتيريا ووجود 5-هيدروكسي ميثيل سايتوسين في الدماغ. [58] وغلكزة اليوراسيل لإنتاج القاعدة ج لدى ذوات منشأ الحركة. [59][60] التي تعمل كإشارة إنهاء النسخ للأنزيم بوليميرايز الرنا 2. [61] [62]
تضرر
هيموجلوبين الجنين
كان عالم الجينات فرانسيس كولينز مهتما في الثمانينيات من القرن الماضي بدراسة انتاج بروتين معين يوجد في خلايا الدم الحمراء في الجنين البشري. وكان من المعروف ان هذا البروتين يختفي تدريجيا بعد الولادة عندما يبدأ الطفل تنفس الهواء. هذا البروتين يسمى هيموجلوبين الجنين . والهيموجلوبين هو البروتين الذي يلتقط الاكسجين من الهواء في خلايا الدم ويوزعه على جميع أعضاء الجسم . في الانسان وفي بعض القرود لهم نوع من الهيموجلوبين في الجنين . وبعد الولادة يختفي هذا النوع من الهيموجلوبين الجنيني خلال العام الأول من حياة الطفل ، ويبدأ الهيموجلوبين العادي في الظهور . وكان فرانسيس كولينز يدرس عائلة من جاميكا كان الهيموجلوبين الجنيني لا يزال يظهر على الكبار منهم ، ويسبب لهم مرض فقر الدم المنجلي. وكان هدف فرانسيس كولينز خفض نسبة خلايا الدم المصابة بهذا البروتين الجنيني لكي ينعم المصاب منهم بصحة جيدة.
ويقص فرانسيس كولينز أنه لا ينسى يوم أن كان يقوم بتحليل لأحد الجينات التي تنتج بروتين الهيموجلوبين ، ووجد فيه أن القاعدة النتروجينية G قد استبدلت ب C ، وكان هذا الجين هو الذي ينتج هيموجلوبين الجنين. ووجد فرانسيس أن مجرد تغيير "حرف" واحد على الجنين يجعل انتاج الهيموجلوبين الجنيني مستمرا في الكبار المصابين.
بعد هذا الاكتشاف بثلاثة سنوات سمع كولينز عن مجموعة من الخبراء يبحثون مسألة تعيين الدي أن إيه بالكامل للإنسان . وهو عمل مضني لأنه متعلق بتحديد متوالية sequence أزواج القواعد التي تكون الدي أن إيه DNA البشري وعـددها 3و3 مليارات من أزواج القواعد الموجودة على 23 زوج من الكروموسومات ؛ هذا بالنسبة للبشر . فالكروموسومات هي التي تحوي الدي أن إيه الكامل للإنسان وهي موجودة في كل خلية من خلاياه الجسمية. وبذلك بدأ مشروع الجينوم البشري Human genome project.
التليف الكيسي
انظر أيضا
معلومات إضافية
- DNA على مشروع الدليل المفتوح
- DNA binding site prediction on protein
- DNA coiling to form chromosomes
- DNA from the Beginning Another DNA Learning Center site on DNA, genes, and heredity from Mendel to the human genome project.
- DNA Lab, demonstrates how to extract DNA from wheat using readily available equipment and supplies.
- DNA the Double Helix Game From the official Nobel Prize web site
- DNA under electron microscope
- Dolan DNA Learning Center
- Double Helix: 50 years of DNA, نيتشر
- Double Helix 1953–2003 National Centre for Biotechnology Education
- Francis Crick and James Watson talking on the BBC in 1962, 1972, and 1974
- Genetic Education Modules for Teachers — DNA from the Beginning Study Guide
- Guide to DNA cloning
المراجع
- ^ القاموس الطبي الموحد Deoxyribonucleic acid تاريخ الولوج 14 كانون الثاني 2014
- ^ Saenger، Wolfram (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN:0-387-90762-9.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ أ ب Alberts، Bruce؛ Johnson، Alexander؛ Lewis، Julian؛ Raff، Martin؛ Roberts، Keith؛ Peter، Walters (2002). Molecular Biology of the Cell (ط. Fourth). New York and London: Garland Science. ISBN:0-8153-3218-1. OCLC:145080076.
{{استشهاد بكتاب}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) والوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Irobalieva RN، Fogg JM، Catanese DJ، Catanese DJ، Sutthibutpong T، Chen M، Barker AK، Ludtke SJ، Harris SA، Schmid MF، Chiu W، Zechiedrich L (أكتوبر 2015). "Structural diversity of supercoiled DNA". Nature Communications. ج. 6: 8440. Bibcode:2015NatCo...6E8440I. DOI:10.1038/ncomms9440. PMC:4608029. PMID:26455586.
- ^ أ ب ت Watson JD، Crick FH (أبريل 1953). "Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid" (PDF). Nature. ج. 171 ع. 4356: 737–8. Bibcode:1953Natur.171..737W. DOI:10.1038/171737a0. PMID:13054692. مؤرشف من الأصل (PDF) في 4 فبراير 2007.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Mandelkern M، Elias JG، Eden D، Crothers DM (أكتوبر 1981). "The dimensions of DNA in solution". Journal of Molecular Biology. ج. 152 ع. 1: 153–61. DOI:10.1016/0022-2836(81)90099-1. PMID:7338906.
- ^ Gregory SG, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, et al. (May 2006). "The DNA sequence and biological annotation of human chromosome 1". Nature. 441 (7091): 315–21. Bibcode:2006Natur.441..315G. doi:10.1038/nature04727. PMID 16710414.
- ^ أ ب ت Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company (ردمك 0-7167-4955-6)
- ^ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents نسخة محفوظة 5 February 2007 على موقع واي باك مشين. IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Retrieved 3 January 2006.
- ^ أ ب Ghosh A، Bansal M (أبريل 2003). "A glossary of DNA structures from A to Z". Acta Crystallographica Section D. ج. 59 ع. Pt 4: 620–6. DOI:10.1107/S0907444903003251. PMID:12657780.
- ^ Yakovchuk P، Protozanova E، Frank-Kamenetskii MD (2006). "Base-stacking and base-pairing contributions into thermal stability of the DNA double helix". Nucleic Acids Research. ج. 34 ع. 2: 564–74. DOI:10.1093/nar/gkj454. PMC:1360284. PMID:16449200.
- ^ Burton E. Tropp – "Molecular Biology"- Jones and Barlett Learning, (ردمك 978-0-7637-8663-2)
- ^ "Watson-Crick Structure of DNA – 1953". Steven Carr. Memorial University of Newfoundland. مؤرشف من الأصل في 19 يوليو 2016. اطلع عليه بتاريخ 13 يوليو 2016.
{{استشهاد ويب}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Nikolova EN، Zhou H، Gottardo FL، Alvey HS، Kimsey IJ، Al-Hashimi HM (2013). "A historical account of Hoogsteen base-pairs in duplex DNA". Biopolymers. ج. 99 ع. 12: 955–68. DOI:10.1002/bip.22334. PMC:3844552. PMID:23818176.
- ^ Clausen-Schaumann H، Rief M، Tolksdorf C، Gaub HE (أبريل 2000). "Mechanical stability of single DNA molecules". Biophysical Journal. ج. 78 ع. 4: 1997–2007. Bibcode:2000BpJ....78.1997C. DOI:10.1016/S0006-3495(00)76747-6. PMC:1300792. PMID:10733978.
- ^ Verma S، Eckstein F (1998). "Modified oligonucleotides: synthesis and strategy for users". Annual Review of Biochemistry. ج. 67: 99–134. DOI:10.1146/annurev.biochem.67.1.99. PMID:9759484.
- ^ Designation of the two strands of DNA نسخة محفوظة 24 April 2008 على موقع واي باك مشين. JCBN/NC-IUB Newsletter 1989. Retrieved 7 May 2008
- ^ Hüttenhofer A، Schattner P، Polacek N (مايو 2005). "Non-coding RNAs: hope or hype?". Trends in Genetics. ج. 21 ع. 5: 289–97. DOI:10.1016/j.tig.2005.03.007. PMID:15851066.
- ^ Munroe SH (نوفمبر 2004). "Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns". Journal of Cellular Biochemistry. ج. 93 ع. 4: 664–71. DOI:10.1002/jcb.20252. PMID:15389973.
- ^ Makalowska I، Lin CF، Makalowski W (فبراير 2005). "Overlapping genes in vertebrate genomes". Computational Biology and Chemistry. ج. 29 ع. 1: 1–12. DOI:10.1016/j.compbiolchem.2004.12.006. PMID:15680581.
- ^ Johnson ZI، Chisholm SW (نوفمبر 2004). "Properties of overlapping genes are conserved across microbial genomes". Genome Research. ج. 14 ع. 11: 2268–72. DOI:10.1101/gr.2433104. PMC:525685. PMID:15520290.
- ^ Lamb RA، Horvath CM (أغسطس 1991). "Diversity of coding strategies in influenza viruses". Trends in Genetics. ج. 7 ع. 8: 261–6. DOI:10.1016/0168-9525(91)90326-L. PMID:1771674.
- ^ What Is the Advantage of Having the DNA Tightly Wrapped Into the Chromosomes?.
- ^ Benham CJ، Mielke SP (2005). "DNA mechanics". Annual Review of Biomedical Engineering. ج. 7: 21–53. DOI:10.1146/annurev.bioeng.6.062403.132016. PMID:16004565.
- ^ Champoux JJ (2001). "DNA topoisomerases: structure, function, and mechanism". Annual Review of Biochemistry. ج. 70: 369–413. DOI:10.1146/annurev.biochem.70.1.369. PMID:11395412.
- ^ Wang JC (يونيو 2002). "Cellular roles of DNA topoisomerases: a molecular perspective". Nature Reviews. Molecular Cell Biology. ج. 3 ع. 6: 430–40. DOI:10.1038/nrm831. PMID:12042765.
- ^ Basu HS، Feuerstein BG، Zarling DA، Shafer RH، Marton LJ (أكتوبر 1988). "Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies". Journal of Biomolecular Structure & Dynamics. ج. 6 ع. 2: 299–309. DOI:10.1080/07391102.1988.10507714. PMID:2482766.
- ^ Franklin RE، Gosling RG (6 مارس 1953). "The Structure of Sodium Thymonucleate Fibres I. The Influence of Water Content" (PDF). Acta Crystallogr. ج. 6 ع. 8–9: 673–7. DOI:10.1107/S0365110X53001939. مؤرشف من الأصل (PDF) في 9 يناير 2016.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة)
Franklin RE، Gosling RG (1953). "The structure of sodium thymonucleate fibres. II. The cylindrically symmetrical Patterson function". Acta Crystallogr. ج. 6 ع. 8–9: 678–85. DOI:10.1107/S0365110X53001940. - ^ Franklin RE، Gosling RG (أبريل 1953). "Molecular configuration in sodium thymonucleate" (PDF). Nature. ج. 171 ع. 4356: 740–1. Bibcode:1953Natur.171..740F. DOI:10.1038/171740a0. PMID:13054694. مؤرشف من الأصل (PDF) في 3 يناير 2011.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Wilkins MH، Stokes AR، Wilson HR (أبريل 1953). "Molecular structure of deoxypentose nucleic acids" (PDF). Nature. ج. 171 ع. 4356: 738–40. Bibcode:1953Natur.171..738W. DOI:10.1038/171738a0. PMID:13054693. مؤرشف من الأصل (PDF) في 13 مايو 2011.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Leslie AG، Arnott S، Chandrasekaran R، Ratliff RL (أكتوبر 1980). "Polymorphism of DNA double helices". Journal of Molecular Biology. ج. 143 ع. 1: 49–72. DOI:10.1016/0022-2836(80)90124-2. PMID:7441761.
- ^ Baianu, I.C. (1980). "Structural Order and Partial Disorder in Biological systems". Bull. Math. Biol. ج. 42 ع. 4: 137–141. DOI:10.1007/BF02462372. "Archived copy". مؤرشف من الأصل في 25 يوليو 2009. اطلع عليه بتاريخ 6 مايو 2009.
{{استشهاد ويب}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة)صيانة الاستشهاد: الأرشيف كعنوان (link) - ^ Hosemann R., Bagchi R.N., Direct analysis of diffraction by matter, North-Holland Publs., Amsterdam – New York, 1962.
- ^ Baianu, I.C. (1978). "X-ray scattering by partially disordered membrane systems". Acta Crystallogr A. ج. 34 ع. 5: 751–753. Bibcode:1978AcCrA..34..751B. DOI:10.1107/S0567739478001540.
- ^ Wahl MC، Sundaralingam M (1997). "Crystal structures of A-DNA duplexes". Biopolymers. ج. 44 ع. 1: 45–63. DOI:10.1002/(SICI)1097-0282(1997)44:1<45::AID-BIP4>3.0.CO;2-#. PMID:9097733.
- ^ Lu XJ، Shakked Z، Olson WK (يوليو 2000). "A-form conformational motifs in ligand-bound DNA structures". Journal of Molecular Biology. ج. 300 ع. 4: 819–40. DOI:10.1006/jmbi.2000.3690. PMID:10891271.
- ^ Rothenburg S، Koch-Nolte F، Haag F (ديسمبر 2001). "DNA methylation and Z-DNA formation as mediators of quantitative differences in the expression of alleles". Immunological Reviews. ج. 184: 286–98. DOI:10.1034/j.1600-065x.2001.1840125.x. PMID:12086319.
- ^ Oh DB، Kim YG، Rich A (ديسمبر 2002). "Z-DNA-binding proteins can act as potent effectors of gene expression in vivo". Proceedings of the National Academy of Sciences of the United States of America. ج. 99 ع. 26: 16666–71. Bibcode:2002PNAS...9916666O. DOI:10.1073/pnas.262672699. PMC:139201. PMID:12486233.
- ^
Richard R، Sinden (15 يناير 1994). DNA structure and function. Academic Press. ص. 398. ISBN:0-12-645750-6.
{{استشهاد بكتاب}}: الوسيط غير المعروف|édition=تم تجاهله (مساعدة) - ^
Rich A, Norheim A, Wang AHJ. "The chemistry and biology of left-handed Z-DNA". Annual Review of Biochemistry. ج. 53: 791–846. DOI:10.1146/annurev.bi.53.070184.004043. PMID:6383204.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|année=تم تجاهله يقترح استخدام|date=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Ho PS (27 سبتمبر 1994). "The non-B-DNA structure of d(CA/TG)n does not differ from that of Z-DNA". Proc Natl Acad Sci USA. ج. 91 ع. 20: 9549–9553. Bibcode:1994PNAS...91.9549H. DOI:10.1073/pnas.91.20.9549. PMC:44850. PMID:7937803.
- ^ Created from نسخة محفوظة 17 October 2016 على موقع واي باك مشين.
- ^ Frédéric Pâques et James E. Haber, « Multiple Pathways of Recombination Induced by Double-Strand Breaks in Saccharomyces cerevisiae », في Microbiology and Molecular Biology Reviews, vol. 63, no 2, juin 1999, ص. 349-404 [النص الكامل, lien PMID (pages consultées le 19-02-2018)]
- ^ Irina Voineagu, Vidhya Narayanan, Kirill S. Lobachev et Sergei M. Mirkin, « Replication stalling at unstable inverted repeats: Interplay between DNA hairpins and fork stabilizing proteins », في Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 29, 22 juillet 2008, ص. 9936-9941 [النص الكامل, lien PMID, lien DOI (pages consultées le 14 mars 2015)]
- ^ Guy-Franck Richard, Alix Kerrest et Bernard Dujon, « Comparative Genomics and Molecular Dynamics of DNA Repeats in Eukaryotes », في Microbiology and Molecular Biology Reviews, vol. 72, no 4, décembre 2008, ص. 686–727 [النص الكامل, lien PMID, lien DOI (pages consultées le 14 mars 2015)]
- ^ Greider CW، Blackburn EH (ديسمبر 1985). "Identification of a specific telomere terminal transferase activity in Tetrahymena extracts". Cell. ج. 43 ع. 2 Pt 1: 405–13. DOI:10.1016/0092-8674(85)90170-9. PMID:3907856.
- ^ Nugent CI، Lundblad V (أبريل 1998). "The telomerase reverse transcriptase: components and regulation". Genes & Development. ج. 12 ع. 8: 1073–85. DOI:10.1101/gad.12.8.1073. PMID:9553037.
- ^ Wright WE، Tesmer VM، Huffman KE، Levene SD، Shay JW (نوفمبر 1997). "Normal human chromosomes have long G-rich telomeric overhangs at one end". Genes & Development. ج. 11 ع. 21: 2801–9. DOI:10.1101/gad.11.21.2801. PMC:316649. PMID:9353250.
- ^ أ ب Burge S، Parkinson GN، Hazel P، Todd AK، Neidle S (2006). "Quadruplex DNA: sequence, topology and structure". Nucleic Acids Research. ج. 34 ع. 19: 5402–15. DOI:10.1093/nar/gkl655. PMC:1636468. PMID:17012276.
- ^ Parkinson GN، Lee MP، Neidle S (يونيو 2002). "Crystal structure of parallel quadruplexes from human telomeric DNA". Nature. ج. 417 ع. 6891: 876–80. Bibcode:2002Natur.417..876P. DOI:10.1038/nature755. PMID:12050675.
- ^ Griffith JD، Comeau L، Rosenfield S، Stansel RM، Bianchi A، Moss H، de Lange T (مايو 1999). "Mammalian telomeres end in a large duplex loop". Cell. ج. 97 ع. 4: 503–14. DOI:10.1016/S0092-8674(00)80760-6. PMID:10338214.
- ^ Seeman NC (نوفمبر 2005). "DNA enables nanoscale control of the structure of matter". Quarterly Reviews of Biophysics. ج. 38 ع. 4: 363–71. DOI:10.1017/S0033583505004087. PMC:3478329. PMID:16515737.
- ^ Deshmukh N. Gopaul, Feng Guo et Gregory D. Van Duyne, « Structure of the Holliday junction intermediate in Cre–loxP site‐specific recombination », في The EMBO Journal, vol. 17, no 14, 15 juillet 1998, ص. 4175-4187 [النص الكامل, lien PMID, lien DOI (pages consultées le 14 mars 2015)]
- ^ Hu Q، Rosenfeld MG (2012). "Epigenetic regulation of human embryonic stem cells". Frontiers in Genetics. ج. 3: 238. DOI:10.3389/fgene.2012.00238. PMC:3488762. PMID:23133442.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Klose RJ، Bird AP (فبراير 2006). "Genomic DNA methylation: the mark and its mediators". Trends in Biochemical Sciences. ج. 31 ع. 2: 89–97. DOI:10.1016/j.tibs.2005.12.008. PMID:16403636.
- ^ Bird A (يناير 2002). "DNA methylation patterns and epigenetic memory". Genes & Development. ج. 16 ع. 1: 6–21. DOI:10.1101/gad.947102. PMID:11782440.
- ^ Walsh CP، Xu GL (2006). "Cytosine methylation and DNA repair". Current Topics in Microbiology and Immunology. Current Topics in Microbiology and Immunology. ج. 301: 283–315. DOI:10.1007/3-540-31390-7_11. ISBN:3-540-29114-8. PMID:16570853.
- ^ Kriaucionis S، Heintz N (مايو 2009). "The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain". Science. ج. 324 ع. 5929: 929–30. Bibcode:2009Sci...324..929K. DOI:10.1126/science.1169786. PMC:3263819. PMID:19372393.
- ^ Ratel D، Ravanat JL، Berger F، Wion D (مارس 2006). "N6-methyladenine: the other methylated base of DNA". BioEssays. ج. 28 ع. 3: 309–15. DOI:10.1002/bies.20342. PMC:2754416. PMID:16479578.
- ^ Gommers-Ampt JH، Van Leeuwen F، de Beer AL، Vliegenthart JF، Dizdaroglu M، Kowalak JA، Crain PF، Borst P (ديسمبر 1993). "beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei". Cell. ج. 75 ع. 6: 1129–36. DOI:10.1016/0092-8674(93)90322-H. PMID:8261512.
- ^ Henri G.A.M. van Luenen, Carol Farris, Sabrina Jan, Paul-Andre Genest, Pankaj Tripathi, Arno Velds, Ron M. Kerkhoven, Marja Nieuwland, Andrew Haydock, Gowthaman Ramasamy, Saara Vainio, Tatjana Heidebrecht, Anastassis Perrakis, Ludo Pagie, Bas van Steensel, Peter J. Myler et Piet Borst, « Glucosylated Hydroxymethyluracil, DNA Base J, Prevents Transcriptional Readthrough in Leishmania », في Cellvolume = 150, no 5, 31 août 2012, ص. 909-921 [النص الكامل, lien PMID, lien DOI (pages consultées le 12 mars 2015)]
- ^ Dane Z. Hazelbaker et Stephen Buratowski, « Transcription: Base J Blocks the Way », في Current Biology, vol. 22, no 22, 2012, ص. R960-R962 [النص الكامل, lien PMID, lien DOI (pages consultées le 12 mars 2015)]
| في كومنز صور وملفات عن: حمض نووي ريبوزي منقوص الأكسجين |









![تفرع هوليداي (ببب 3CRX[53]).](http://upload.wikimedia.org/wikipedia/commons/thumb/9/92/Holliday_junction_coloured.png/330px-Holliday_junction_coloured.png)