كيمياء خلوية مناعية
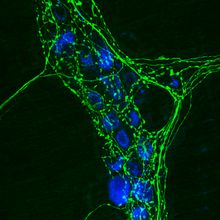
الكيمياء الخلوية المناعية هي تقنية معملية شائعة تستخدم لتصور تشريحيًا توطين بروتين أو مستضد معين في الخلايا باستخدام جسم مضاد أولي محدد يرتبط به. يسمح الجسم المضاد الأساسي بتصور البروتين تحت مجهر فلوري عندما يكون مرتبطًا بجسم مضاد ثانوي يحتوي على فلوروفور مترافق. تسمح الكيمياء الخوية المناعية للباحثين بتقييم ما إذا كانت الخلايا في عينة معينة تعبرعن المستضد[1] المعني أم لا. في الحالات التي يتم فيها العثور على إشارة إيجابية مناعية، تسمح الكيمياء الخلوية المناعية أيضًا للباحثين بتحديد المقصورات الخلوية الفرعية التي تعبر عن المستضد.
كيمياء خلوية مناعية مقابل كيمياء نسيجية مناعية[عدل]
تختلف الكيمياء الخلوية المناعية عن الكيمياء النسيجية المناعية[2] في أن الأولى تُجرى على عينات من الخلايا السليمة التي أُزيلت معظم، إن لم يكن كل، النسيج البيني خارج الخلية المحيط بها. [بحاجة لمصدر] وهذا يشمل الخلايا الفردية التي عُزِلت من كتلة من الأنسجة الصلبة، أو الخلايا المزروعة داخل مزرعة، أو الخلايا المترسبة من التعليق، أو الخلايا المأخوذة من اللطاخة. في المقابل، العينات المناعية الكيميائية هي أقسام من الأنسجة الحيوية، حيث تكون كل خلية محاطة ببنية الأنسجة والخلايا الأخرى الموجودة عادةً في الأنسجة السليمة. الكيمياء الخلوية المناعية هي تقنية تستخدم لتقييم وجود بروتين أو مستضد معين في الخلايا (الخلايا المستزرعة، معلقات الخلايا) باستخدام جسم مضاد معين، والذي يرتبط به، مما يسمح بالتصور والفحص تحت المجهر. إنها أداة قيمة لتحديد المحتويات الخلوية من الخلايا الفردية. تشمل العينات التي يمكن تحليلها مسحات الدم، والشفط، والمسحات، والخلايا المستزرعة، وتعليق الخلايا.
هناك العديد من الطرق لإعداد عينات الخلايا للتحليل الكيميائي المناعي. كل طريقة لها نقاط قوتها وخصائصها الفريدة بحيث يمكن اختيار الطريقة الصحيحة للعينة والنتيجة المطلوبة.
يمكن ربط الخلايا المراد تلطيخها بدعامة صلبة للسماح بسهولة التعامل معها في الإجراءات اللاحقة. يمكن تحقيق ذلك بعدة طرق: يمكن زراعة الخلايا الملتصقة على شرائح مجهرية أو أغطية أو دعامة بلاستيكية مناسبة بصريًا. يمكن طرد خلايا التعليق بالطرد المركزي على شرائح زجاجية (سايتوسبين)، أو ربطها بدعم صلب باستخدام روابط كيميائية، أو في بعض الحالات تُعامَل في التعليق.
المعلقات الخلوية المركزة الموجودة في وسط منخفض اللزوجة تجعل المرشحين جيدين لتحضير اللطاخة. تعتبر معلقات الخلايا المخففة الموجودة في وسط مخفف هي الأنسب لإعداد الخلايا الخلوية من خلال الطرد المركزي الخلوي. المعلقات الخلوية الموجودة في وسط عالي اللزوجة، هي الأنسب لتُختار كمستحضرات مسحة. الثابت بين هذه الاستعدادات هو أن الخلية بأكملها موجودة على سطح الشريحة. لكي يحدث أي تفاعل بين الخلايا، يجب أن يجتاز الغلوبولين المناعي أولًا غشاء الخلية السليم في هذه المستحضرات. يمكن أن تكون التفاعلات التي تحدث في النواة أكثر صعوبة، ويمكن أن تخلق السوائل خارج الخلية عقبات فريدة في أداء الكيمياء الخلوية المناعية. في هذه الحالة، يصبح من الضروري اختراق الخلايا باستخدام المنظفات (تريتون X-100 أو توين -20) أو اختيار المثبتات العضوية (الأسيتون أو الميثانول أو الإيثانول).
الأجسام المضادة هي أداة مهمة لإثبات وجود وتوطين مستضد تحت الخلوي. تلطيخ الخلايا هو تقنية متعددة الاستخدامات للغاية، وإذا كان المستضد موضعيًا بدرجة عالية، فيمكنه اكتشاف ما لا يقل عن ألف جزيء مستضد في الخلية. في بعض الحالات، يمكن أيضًا استخدام تلطيخ الخلايا لتحديد التركيز التقريبي للمستضد، خاصة بواسطة محلل الصور.
أساليب[عدل]
هناك العديد من الطرق للحصول على الكشف المناعي على الأنسجة، بما في ذلك تلك المرتبطة مباشرة بالأجسام المضادة الأولية أو الأمصال المضادة. تتضمن الطريقة المباشرة استخدام علامة قابلة للكشف (على سبيل المثال، جزيء الفلورسنت، جزيئات الذهب، إلخ) مباشرة إلى الجسم المضاد[3] الذي يسمح له بعد ذلك بالارتباط بالمستضد (مثل البروتين) في الخلية.
بدلًا من ذلك، هناك العديد من الطرق غير المباشرة. في إحدى هذه الطرق، يرتبط مولد الضد بجسم مضاد أولي يتم تضخيمه بعد ذلك باستخدام جسم مضاد ثانوي يرتبط بالجسم المضاد الأساسي. بعد ذلك، يتم تطبيق كاشف ثلاثي يحتوي على جزء إنزيمي ويرتبط بالجسم المضاد الثانوي. عندما يُطبَّق الكاشف الرباعي، أو الركيزة، فإن الطرف الأنزيمي للكاشف الثلاثي يحول الركيزة إلى منتج تفاعل الصباغ، والذي ينتج لونًا (العديد من الألوان ممكنة؛ بني، أسود، أحمر، إلخ) في نفس الموقع الذي تعرف فيه الجسم المضاد الأولي الأصلي على هذا المستضد محل الاهتمام.
بعض الأمثلة على الركائز المستخدمة (المعروفة أيضًا باسم الكروموجينات) هي 3-أمينو-9-إيثيل كاربازول، أو 3،′3-ثنائي أمينو البنزيدين. ينتج عن استخدام أحد هذه الكواشف بعد التعرض للإنزيم الضروري (على سبيل المثال، بيروكسيديز الفجل المترافق مع كاشف الأجسام المضادة) منتج تفاعل مناعي إيجابي. يمكن استخدام التصور الكيميائي المناعي لمستضدات معينة ذات أهمية عندما لا يمكن استخدام بقعة أقل تحديدًا مثل الهيماتوكسيلين وايوزين لإجراء التشخيص أو لتوفير معلومات تنبؤية إضافية فيما يتعلق بالعلاج (في بعض أنواع السرطان، على سبيل المثال).
بدلًا من ذلك، قد يكون الجسم المضاد الثانوي مرتبطًا تساهميًا بالفلوروفور (إيزوثيوسيانات فلوريسين ورودامين هما الأكثر شيوعًا) والذي يُكتَشف في مجهر مضان أو متحد البؤر. سيختلف موقع التألق وفقًا للجزيء المستهدف، خارجيًا للبروتينات الغشائية، وداخليًا للبروتينات السيتوبلازمية. وبهذه الطريقة، يعد التألق المناعي تقنية قوية عند دمجه مع الفحص المجهري متحد البؤر لدراسة موقع البروتينات والعمليات الديناميكية (الإخراج الخلوي، الادخال الخلوي، إلخ).
مراجع[عدل]
- ^ W. Burry، Richard (2010). Immunocytochemistry. Springer, New York, NY. ص. 7–16. ISBN:978-1-4419-1304-3. مؤرشف من الأصل في 2022-04-05.
- ^ Renshaw، Simon (2017). Immunohistochemistry and Immunocytochemistry: Essential Methods, Second Edition. John Wiley & Sons, Ltd. ص. 35–102.
- ^ Cooper, Mark؛ Lummas, Sheriden (2016). Immunohistochemistry and Immunocytochemistry: Essential Methods, Second Edition. John Wiley & Sons, Ltd. ص. 21–23.
روابط خارجية[عدل]
- بروتوكول تلطيخ الكيمياء الخلوية المناعية.
- الكيمياء الهيستولوجية المناعية لأجنة الفئران الكاملة.
