تحليل فيديل
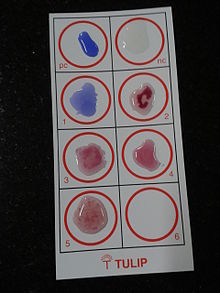
تحليل فيديل، الّذي طوره في عام 1896 وسماه باسمه مخترعُه جورج فرناند فيديل؛ هو تحليل تراصِّ (agglutination) غير مباشر لِلحمّى المعويّة (حمّى التيفوئيد) أو الحمّى المتموجة حيثُ تُخلط البكتيريا المسببة للحمّى التيفوئيدية مع مصل يحتوي أجساماً مضادة محددة مأخوذة من فرد مصاب. في حالات الإصابة بِبكتيريا السلمونيلا اللاتيفية سيظهر المستضد الجسمي O المشابه لذلك الموجود على السلمونيلا التيفية بالتالي ستكون النتيجة إيجابية كاذبة. يجب تفسير نتائج التحليل بعناية لِدراسة تاريخ الحمى المعوية ولقاح التيفوئيد والمستوى العام للأجسام المضادة في السكان القاطنين في المناطق الموبوءة حول العالم. وكما هو الحال في جميع التحاليل المصليّة، الارتفاع في مستوى الأجسام المضادة اللازمة لإجراء التحليل تستغرق 7-14 يوماً، مما يحد من إمكانية تطبيقه في التشخيص المبكر. تتضمّن الوسائل الأخرى لتشخيص السلمونيلا التّيفية (والنظيرة التّيفية) مُستَنبَتات (cultures) الدم، والبول، والبراز. هذه الكائنات تنتج كبريتيد الهيدروجين (H2S) من الثيوكبريتات ويمكن بسهولة التعرف عليها عبر أوساط تفريقيّة مثل أغار كبريتيت البزمات (bismuth sulfite agar).[1][2][3] التيفيدوت؛ وهو التحليل الآخر المستخدم للتأكد من تشخيص حمى التيفوئيد. هناك تحليل مصليّ جديد يسمّى تحليل توبيكس (Tubex test) لكنه ليس أكثر جودةً، ولا أفضل أداءً من تحليل فيديل. لذلك؛ لا يوصى بتحليل توبيكس في تشخيص حمى التيفوئيد.[4]
غالباً تضاف مادة ميركابتويثانول-2 (2-Mercaptoethanol) إلى تحليل فيديل. فهذا العامل يَمْسَخ بسهولة فئة الغلوبيولين المناعي م (IgM) من الأجسام المضادة. لذلك؛ إذا لوحظَ الانخفاض في التركيز (عيار) بعد استخدام هذا العامل فهذا يعني إزالة مساهمة الغلوبيولين المناعي م (IgM)، وإبقاء الغلوبيولين المناعي ج (IgG). وهذا التفريق بين فئات الأجسام المضادة مهم؛ لأنه يسمح بالتمييز بين الإصابة الحديثة (IgM)، والإصابة القديمة (IgG).
يكون تحليل فيديل إيجابياً إذا كان تركيز (عيار حجمي) المستضدّ (TO antigen) أكبر من 1\160 في عدوىً نشطة، أو إذا كان تركيز المستضدّ (TH antigen) أكبر من 1\160 في عدوى سابقة أو في الأشخاص المُطعّميين. اختبار فيديل واحد يعد قليل الأهمية من الناحية السريرية خاصة في المناطق الموبوءة مثل شبه الجزيرة الهندية، وأفريقيا، وجنوب شرق آسيا. ويرجع ذلك إلى التعرّض المتكرّر للبكتيريا المسببة للتيفوئيد والتطعيم والفرص العالية لإمكانية التفاعل المتبادل من قبل الإخماج (إصابات)، كما في الملاريا والسلمونيلا غير التيفية.
في حال عدم توفّر تحاليل أخرى (إما مُستَنبتات باكتريولوجيّة أو مصلية نوعية)؛ فإن زيادة أربع أضعاف العيار (مثال: من 1\40 إلى 1\640) في مسار العدوى، أو على الأقل التحويل من مُفاعلة IgM إلى مُفاعلة IgG من نفس العيار، سيكون أكثر انسجاماً مع عدوى التيفوئيد.
المراجع[عدل]
- ^ PREVENTION. (CDC), CENTERS FOR DISEASE CONTROL AND (11 Jun 2019). CDC Yellow Book 2020: Health Information for International Travel (بالإنجليزية). Oxford University Press. ISBN:978-0-19-006597-3. Archived from the original on 2023-03-02.
- ^ Cheesbrough, Monica (2005). District Laboratory Practice in Tropical Countries, Part 2 (بالإنجليزية). Cambridge University Press. ISBN:978-0-521-67631-1. Archived from the original on 2023-03-02.
- ^ Olopoenia, Lateef A.; King, Aprileona L. (1 Feb 2000). "Widal agglutination test − 100 years later: still plagued by controversy". Postgraduate Medical Journal (بالإنجليزية). 76 (892): 80–84. DOI:10.1136/pmj.76.892.80. ISSN:0032-5473. PMID:10644383. Archived from the original on 2023-02-22.
- ^ "TUBEX Test Versus Widal Test In The Diagnosis Of Typhoid Fever In Kafr El -Shekh, Egypt". مؤرشف من الأصل في 2023-03-02.
