فيروس التهاب الفم الحويصلي
فيروس التهاب الفم الحويصلي | |
|---|---|
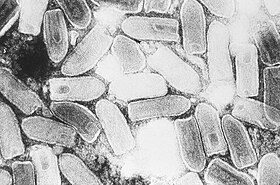
مجهر إلكتروني نافذ صورة مجهرية of VSIV particles.
| |
| المرتبة التصنيفية | نوع[1][2] |
| تصنيف الفيروسات | |
| المجموعة: | ((-)ssRNA) V مجموعة
|
| الرتبة: | فيروسات سلبية أحادية |
| الفصيلة: | فيروسات ربدية |
| الجنس: | Vesiculovirus |
| النوع: | Indiana vesiculovirus |
| الاسم العلمي | |
| Vesicular stomatitis Indiana virus[1][2] | |
| تعديل مصدري - تعديل | |
فيروس التهاب الفم الحويصلي إنديانا(بالإنجليزية: Vesicular stomatitis Indiana virus) (غالباً ما يشار إليها بالاختصار ف.س.ف) هو فيروس من عائلة فيروسات ربدية. حيث ينتمي فيروس داء الكلب المعروف إلى نفس العائلة. ف س ف يمكن أن يصيب الحشرات والماشية والخيول والخنازير. وله أهمية خاصة بالنسبة للمزارعين في مناطق معينة من العالم حيث يمكن أن تصيب الماشية. وذلك لأن عرضه السريري مطابق لفيروس الحمى القلاعية الهام جدا.[7]
الفيروس حيواني المنشأ ويؤدي إلى مرض شبيه الإنفلونزا في البشر المصابين.
هو أيضا فيروس مختبري شهير يستخدم لدراسة خصائص الفيروسات من عائلة الفيروسات الربدية، وكذلك لدراسة تطور الفيروسات.[8]
الخصائص[عدل]
فيروس التهاب الفم الحويصلي إنديانا (ف س ف) هو العضو النموذجي من جنس فيسيكولوفيروس من عائلة الفيروسات الربدية. ف س ف هو أربوفيروس، وتضاعفه يحدث في السيتوبلازم. وتشمل الإصابات الطبيعية لفيروس التهاب الفم الحويصلي خطوتين، العدوى الخلوية في المضيف الثديي والنقل بواسطة الحشرات. في الحشرات، العدوى غير دائمة الإحلال الخلوي. واحدة من الناقلات المؤكدة للفيروس هي فواصد لوتزوميا شانوني.[9] جينوم فيروس التهاب الفم الحويصلي يوجد على جزيء واحد من الحمض النووي الريبي السلبي الذي لديه 11و 161 من أطوال النيوكليوتيدات،[10] والذي يشفر خمسة بروتينات رئيسية: G بروتين (G)، وبروتين كبير (L)، وفوسفوبروتين، وبروتين المصفوفة (M) والبروتين النووي:
بروتين فيروس التهاب الفم الحويصلي G ، ويعرف أيضا باسم ف س ف ج، يُمكّن دخول الفيروس. وهو يتوسط في تعلق الفيروس بمستقبلات البروتين الدهني منخفض الكثافة (LDLR) أو أحد أعضاء عائلة مستقبلات البروتين الدهني منخفض الكثافة الموجود على الخلية المضيفة.[11] بعد ارتباط مركب الفيروس ف س ف بمستقبلات البروتين الدهني منخفض الكثافة يُبتلع بسرعة ومن ثم يتوسط الاندماج بين المغلف الفيروسي وغشاء الجسيم الداخلي. يدخل فيروس ف س ف الخلية من خلال الحويصلات المغلفة جزئيا بالكلاثرين. تحتوي الحويصلات حاملة الفيروس على المزيد من الكلاثرين والكلاثرين المحول أكثر من الحويصلات التقليدية. الحويصلات التي تحتوي على الفيروسات توظف مكونات آلات الأكتين لتفاعلها، مما يزيد من استعابها. بروتين ف س ف G لا يتبع نفس مسار معظم الحويصلات لأن نقل البروتين G من الشبكة الإندوبلازمية إلى غشاء البلازما يتوقف بواسطة الحضانة عند 15 درجة مئوية. في هذه الحالة، تتراكم الجزيئات في كل من الشبكة الإندوبلازمية وجزء من حويصلة تحت الخلية ذات كثافة منخفضة تسمى جزء حويصلة الغنية بالدهون. ويبدو أن المادة الموجودة في جزء الحويصلة الغنية بالدهون هي مادة وسيطة ما بعد الشبكة الإندوبلازمية في عملية النقل إلى غشاء البلازما. بعد العدوى، يتم التعبير عن جين ف س ف G وتتم دراسته عادة كنموذج لغليكوسيلاتيون المرتبط ب N في الشبكة الإندوبلازمية. يتم ترجمته إلى الشبكة الإندوبلازمية الخام حيث يتم إضافة أوليجوسكريد جلوكوز3-مانوز9-إن-أسيتيل غلوكوز أمين2 بواسطة البروتين الذي يحتوي على دوليكول، إلى بذرة NXS على ف س ف G. تتم إزالة السكريات تدريجيا أثناء انتقال البروتين إلى جهاز جولجي، ويصبح مقاوما لـ إندوغليكوسيداز H.[12] عند تصنيعه في الخلايا الظهارية المستقطبة، يستهدف مغلف البروتين السكري لف س ف G الجزء القاعدي الوحشي من غشاء البلازما. ف س ف G هو أيضا غلاف بروتيني مشترك لنظم التعبير عن ناقلات فيروسات لنتي يُستخدم لإدخال المواد الوراثية في النظم المختبرية أو النماذج الحيوانية، وذلك أساسا بسبب توجهه الواسع للغاية.
يتم ترميز البروتين ف س ف بنصف الجينوم، ويقترن بالفوسفوبروتين لتحفيز النسخ المتماثل من الحمض النووي الريبي الرسول.
يتم ترميز البروتين ف س ف M بواسطة الحمض النووي الريبي الرسول يتكون من 831 النيوكليوتيدات طويلة ويترجم إلى 229 من الأحماض الأمينية البروتينية. تسلسل البروتين M المتوقع لا يحتوي على أي مجالات طويلة كارهة للماء أو غير قطبية التي قد تعزز اتصال الغشاء. البروتين غني بالأحماض الأمينية الأساسية ويحتوي على نطاق نهائي كثيف من الأحماض الأمينية الأساسية.
التهاب الفم الحويصلي[عدل]
العلامات السريرية والتشخيص[عدل]
العلامة الرئيسية في الحيوانات هو مرض الفم الذي تظهر كحويصلات مخاطية وقرح في الفم، ولكن قد تظهر أيضا على الضرع وحول الفرقة التاجية. قد تظهر علامات نظامية على الحيوانات مثل فقدان الشهية والخمول والحمى. عادة ما يشفى المرض في غضون أسبوعين، وعادة ما تتعافى الحيوانات تماما.[7]
الاختبار المصلي الأكثر شيوعا يكون مع إلايزا أو تثبيت المكمل، ويمكن أيضا محاولة العزل الفيروسي.[7]
العلاج والتحكم[عدل]
لا يوجد علاج محدد، ولكن بعض الحيوانات قد تتطلب الدعم بالسوائل أو مضادات حيوية للعدوى الثانوية.[7] تعتمد السيطرة على بروتوكولات الأمن الحيوي والحجر الصحي والعزل والتطهير لضمان عدم دخول المرض الفيروسي إلى بلد أو قطيع.[7]
التطبيقات الطبية[عدل]
علاج محلل للورم[عدل]
في الخلايا البشرية السليمة لا يمكن للفيروس أن يتكاثر، ربما بسبب استجابة الإنترفيرون. العديد من الخلايا السرطانية لديها استجابة إنترفيرون منخفضة، مما يسمح على الأرجح لفيروس التهاب الفم الحويصلي أن ينمو، وبالتالي يحلل الخلايا الورمية بشكل تفضيلي.[13]
في الآونة الأخيرة، تم الوصول إلى أن «ف س ف» الموهن مع طفرة في البروتين M له خصائص محللة للورم. الأبحاث مستمرة، وأظهرت أن «ف س ف» له قدرة الحد من حجم الورم وانتشاره في سرطان الجلد وسرطان الرئة وسرطان القولون وبعض أورام المخ في النماذج المختبرية للسرطان.[14]
علاج مكافح لفيروس نقص المناعة البشرية[عدل]
تم تعديل «ف س ف» لمهاجمة الخلايا T المصابة بفيروس نقص المناعة البشرية. سُمي الفيروس المعدل بفيروس «حصان طروادة»
العلاجات قيد التطوير[عدل]
خضع هذا الفيروس لتجارب المرحلة الأولى كلقاح لفيروس الإيبولا.[15]
أجريت على «ف س ف» المؤتلف الذي يعبر عن بروتين فيروس إيبولا السكري تجارب المرحلة الثالثة في أفريقيا كلقاح لمرض فيروس إيبولا. وقد تبين أن اللقاح فعال بنسبة 76-100٪ في الوقاية من مرض فيروس إيبولا.[16][17]
كما تم إنشاء نسخ متماثلة من rVSV المختص معبرة عن بروتينات حمى لاسا وفيروس ماربورغ.[18]
تطبيقات أخرى[عدل]
يستخدم بروتين الفيروس ف س ف G عادة في الأبحاث الطبية الحيوية لنمط كاذب من فيروسات النسخ الرجعية وفيروس لنتي، ونقل القدرة على إنتاج مجموعة واسعة من أنواع خلايا الثدييات مع الجينات محل الاهتمام.[19]
كما تم استخدام بروتين ف س ف G في الدراسات الخلوية لتنظيم المرور في جهاز الغشاء الداخلي. يقترح المجهر المناعي أن البروتين G يتحرك من سيسترون إلى أجسام عبر جولجي دون نقلها فيما بينها في حويصلات، ودعم نموذج النضج السيستروني لتنظيم العبور في جهاز جولجي.[20]
انظر أيضا[عدل]
مراجع[عدل]
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (12 Jun 2015), ICTV Master Species List 2014 v4 (بالإنجليزية), QID:Q24716610
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (30 Jun 2014), ICTV Master Species List 2013 v2 (بالإنجليزية), QID:Q18810383
- ^ ICTV Master Species List 2005 (بالإنجليزية), 2005, QID:Q69579583
- ^ ICTV Master Species List 2009 (بالإنجليزية), 2009, QID:Q69578243
- ^ ICTV Master Species List 2011 (بالإنجليزية), 2011, QID:Q69577927
- ^ ICTV Master Species List 2012 (بالإنجليزية), 2013, QID:Q69577800
- ^ أ ب ت ث ج Vesicular Stomatitis Virus reviewed and published by ويكي فيت, accessed 12 October 2011. نسخة محفوظة 09 أغسطس 2018 على موقع واي باك مشين.
- ^ Norkin L.C. (2010.) Virology: Molecular Biology and Pathogenesis American Society for Microbiology, Canada.
- ^ Mann, R. S., et al. A Sand Fly, Lutzomyia shannoni Dyar (Insecta: Diptera: Psychodidae: Phlebotomine). EENY-421. Entomology and Nematology. Florida Cooperative Extension Service. University of Florida IFAS. 2009. نسخة محفوظة 12 سبتمبر 2016 على موقع واي باك مشين.
- ^ "VSV complete genome". مؤرشف من الأصل في 2018-08-21. اطلع عليه بتاريخ 2013-05-30.
- ^ Finkelshtein D, Werman A, Novick D, Barak S, Rubinstein M. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus. Proc Natl Acad Sci U S A. 2013 Apr 30;110(18):7306–11.
- ^ Alberts, et al. Molecular Biology of the Cell, 4th ed. 2002.
- ^ David F. Stojdl, Brian Lichty, Shane Knowles, Ricardo Marius, Harold Atkins, Nahum Sonenberg and John C. Bell (2000). "Exploiting tumor-specific defects in the interferon pathway with a previously unknown oncolytic virus". Nature Medicine. ج. 6 ع. 7: 782–89. DOI:10.1038/77558. PMID:10888934.
- ^ Koray Özduman, Guido Wollmann, Joseph M. Piepmeier, and Anthony N. van den Pol (2008). "Systemic vesicular stomatitis virus selectively destroys multifocal glioma and metastatic carcinoma in brain". The Journal of Neuroscience. ج. 28 ع. 8: 1882–93. DOI:10.1523/JNEUROSCI.4905-07.2008. PMID:18287505. مؤرشف من الأصل في 2019-03-28.
- ^ Phase 1 Trials of rVSV Ebola Vaccine in Africa and Europe - Preliminary Report.
- ^ Henao-Restrepo، Ana Maria (31 يوليو 2015). "Efficacy and effectiveness of an rVSV-vectored vaccine expressing Ebola surface glycoprotein: interim results from the Guinea ring vaccination cluster-randomised trial". The Lancet. ج. 386: 857–866. DOI:10.1016/S0140-6736(15)61117-5. PMID:26248676.
- ^ Henao-Restrepo، Ana Maria (2016). "Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit!)". The Lancet. DOI:10.1016/S0140-6736(16)32621-6. PMID:28017403.
- ^ Properties of replication-competent vesicular stomatitis virus vectors expressing glycoproteins of filoviruses and arenaviruses.
- ^ Cronin، J.؛ وآخرون (2005). "Altering the tropism of lentiviral vectors through pseudotyping". Curr Gene Ther. ج. 5 ع. 4: 387–98. DOI:10.2174/1566523054546224. PMC:1368960. PMID:16101513.
- ^ Mironov، A. A.؛ وآخرون (2001). "Small cargo proteins and large aggregates can traverse the Golgi by a common mechanism without leaving the lumen of cisternae". J Cell Biol. ج. 155 ع. 7: 1225–38. DOI:10.1083/jcb.200108073. PMC:2199327. PMID:11756473.
| فيروس التهاب الفم الحويصلي في المشاريع الشقيقة: | |
| |