مركب قصدير عضوي

مركب القصدير العضوي هو مركب عضوي فلزي يتكون عند ارتباط القصدير مع ذرة الكربون أو الهيدروكربونات بشكل عام برابطة تسساهمية.
يعد مركب ثنائي يوديد ثنائي ميثيل القصدير ((C2H5)2SnI2) المكتشف سنة 1849 من قبل إدوارد فرانكلاند من أوائل مركبات القصدير العضوية المحضّرة.[3] شاع بعد ذلم تحضير مركبات القصدير العضوية، خصوصاً بعد اكتشاف كواشف غرينيار. ولا يزال الكثير من مركبات القصدير العضوية يلقى اهتماماً وذلك لمجالات التطبيقات المهمة قي الصناعة ومختبرات الأبحاث الكيميائية.[4]
أنواع مركبات القصدير العضوية[عدل]
المشتقات العضوية للقصدير الرباعي[عدل]
تكون أغلب المشتقات العضوية للقصدير الرباعي ذات بنية رباعية السطوح، وتم التمكن من تحديد بنية مركبات لها الصيغة العامة 'SnRR'RR حتى مصاوغاتها الضوئية.[5]
إن الهاليدات العضوية للقصدير الرباعي معروفة، وأشهرها مشتقات الكلوريد التي لها الصيغة العامة R4−nSnCln؛ وتشكل الهاليدات الثنائية والثلاثية نواتج إضافة مع قواعد لويس القوية مثل البيريدين. للهاليدات العضوية للقصدير الرباعي سمية مرتفعة، وخاصة كلوريد ثلاثي بوتيل القصدير، سمية مرتفعة تقارب التي لمركب سيانيد الهيدروجين.[6]
أما الهيدريدات العضوية للقصدير الرباعي فلها الصيغة العامة R4−nSnHn، ويعد مركب ستانان SnH4 المركب الرائد في سلسلة هذه المركبات، والتي تزداد ثباتيتها واستقراها كلما زاد عدد المستبدلات، كما هو الحال مع مركب هيدريد ثلاثي بوتيل القصدير.
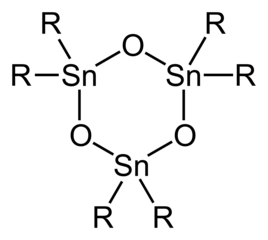
تسمى أكاسيد وهيدروكسيدات القصدير الرباعي العضوية باسم ستانوكسان Stannoxane، وهي النواتج المتشكلة عند حلمهة المركبات الهاليدية العضوية. يمكن لهذه المركبات أن توجد بحالة توازن مع تشكل للرابطة Sn-O-Sn كما هوالحال في المثال التالي:
وتكون البنية أسهل في حالة مركبات القصدير العضوية ثلاثية المستبدلات من الثنائية منها.[7]
-
بنية مثالية لمركب أكسيد عضوي للقصدير ثنائي المستبدلات
-
نموذج العصي والكرات لمركب (t-Bu2SnO)3
-
بنية أكسيد عضوي للقصدير ثنائي المستبدلات مع التركيز على الارتباط بين الجزيئي
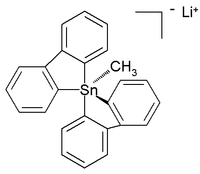
يمكن للقصدير الرباعي أن يشكل معقدات تساندية (أو تناسقية) يصل فيها عدد التناسق إلى 5 أو حتى 6 ذرات بشكل مفرط التكافؤ في مركبات تم تحضيرها وتحديد بنيتها،[8][9] وهي بذلك تشكل معقدات تتصرف كمستبدلات مرتفعة الكهرسلبية، كما هو الحال مع ملح الليثيوم مع المعقد القصديري الواضح في الصورة:
بالمقابل يمكن أن تشكل معقدات القصدير الرباعية، وخاصة الهيدريدات منها، كاتيونات وخاصة مع المستبدلات الكبيرة مثل 6,4,2-ثلاثي إيزوبروبيل فينيل.[10] كما يمكن أن تشكل أيضاً جذور حرة R3Sn وتسمى جذور الستانيل الحرة.[4] يعطي مركب هيدريد ثلاثي بوتيل القصدير مثلاً الحذور الحرة الموافقة بسبب ثباتية جذر ثلاثي بوتيل القصدير الحر.[11]
المشتقات العضوية للقصدير الثنائي[عدل]
تعد هذه الفئة من المركبات نادرة الوجود نسبياً؛ ولها الصيغة العامة SnR2، وهي ذات ثباتية منخفضة على هذا الشكل، إذ تميل إلى تشكيل مركبات بولي ستانان polystannanes (متعددات الستانان)، ذات الصيغة (SnR2)n
وقد وجد أن هذه المشتقات العضوية تكون في حالة توازن مع مركبات ثنائي الستانيلين distannylene:
وهي مشابهات بنيوية للكربينات.[12]
المشتقات العضوية للقصدير الأحادي[عدل]
تعد هذه المشتقات نادرة الوجود بشكل كبير، ولا يستحصل عليها إلا بالربيطات الضخمة فراغياً مثل المعقد Sn(C6H3-2,6-Et2)2]3]، والذي يأخذ بنية فراغية شبيهة ببنية الكوبان المكعبة والبريسمان الموشورية.[13]
التحضير[عدل]
تحضر مركبات القصدير العضوية بعدة طرق؛[14] أشهرها وفق تفاعل رباعي كلوريد القصدير مع كاشف غرينيار؛ كما هو الحال في تفاعل تحضير رباعي إيثيل القصدير:
- 4 EtMgBr + SnCl4 → Et4Sn + 4 MgClBr
الاستخدامات[عدل]
تستخدم مركبات القصدير العضوية في تحضير مثبتات بوليمير PVC (بولي فاينيل كلوريد)، حيث يعمل القصدير على التقاط وتجميع أيونات الكلوريد، مما يمنع من فقدان HCl من البنية البوليميرية.[16] كما تستخدم تلك المركبات عموماً في تحضير المبيدات على اختلاف أنواعها؛[16] ويستخدم أكسيد ثلاثي بوتيل القصدير في حفظ الخشب؛[17] وكانت تستخدم في صيانة السفن، قبل أن تمنع لكونها من الملوثات العضوية الثابتة ولتأثيرها السلبي على الأحياء المائية.[16][18]
طالع أيضاً[عدل]
المراجع[عدل]
- ^ مذكور في: Gene Ontology release 2019-11-16. تاريخ النشر: 16 نوفمبر 2019.
- ^ أ ب ت وصلة مرجع: http://www.cdc.gov/niosh/npg/npgd0614.html.
- ^ Caseri، Walter (2014). "Initial Organotin Chemistry". Journal of Organometallic Chemistry. ج. 751: 20–24. DOI:10.1016/j.jorganchem.2013.08.009.
- ^ أ ب Davies, Alwyn George. (2004) Organotin Chemistry, 2nd Edition Weinheim: Wiley-VCH. (ردمك 978-3-527-31023-4)
- ^ Gielen، Marcel (1973). "From kinetics to the synthesis of chiral tetraorganotin compounds". Acc. Chem. Res. ج. 6: 198–202. DOI:10.1021/ar50066a0.
- ^ G. G. Graf "Tin, Tin Alloys, and Tin Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim دُوِي:10.1002/14356007.a27_049
- ^ Chandrasekhar، Vadapalli؛ Nagendran، Selvarajan؛ Baskar، Viswanathan (2002). "Organotin assemblies containing Sn/O bonds". Coordination Chemistry Reviews. ج. 235: 1–52. DOI:10.1016/S0010-8545(02)00178-9.
- ^ Reich, Hans J.؛ Phillips، Nancy H. (1986). "Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes". J. Am. Chem. Soc. ج. 108: 2102. DOI:10.1021/ja00268a067.
- ^ V. G. Kumar Das؛ Lo Kong Mun؛ Chen Wei؛ Thomas C. W. Mak (1987). "Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound". Organometallics. ج. 6: 10. DOI:10.1021/om00144a003.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ T. V. RajanBabu, P. C. B. Page B. R. Buckley "Tri-n-butylstannane" in e-EROS Encyclopedia of Reagents for Organic Synthesis, 2004. دُوِي:10.1002/047084289X.rt181.pub2
- ^ Holleman، Arnold Frederik؛ Wiberg، Egon (2001)، Wiberg، Nils (المحرر)، Inorganic Chemistry، ترجمة: Eagleson، Mary؛ Brewer، William، San Diego/Berlin: Academic Press/De Gruyter، ISBN:0-12-352651-5
- ^ Sita، Lawrence R. (1994). "Heavy-Metal Organic Chemistry: Building with Tin". Acc. Chem. Res. ج. 27: 191–197. DOI:10.1021/ar00043a002.
- ^ Sander H.L. Thoonen؛ Berth-Jan Deelman؛ Gerard van Koten (2004). "Synthetic aspects of tetraorganotins and organotin(IV) halides" (PDF). Journal of Organometallic Chemistry ع. 689: 2145–2157. مؤرشف من الأصل (PDF) في 2006-02-22.
- ^ Der Kerk، G. J. M. Van؛ Luijten، J. G. A. (1956). "Tetraethyltin". Org. Synth. ج. 36: 86ff. DOI:10.15227/orgsyn.036.0086.
- ^ أ ب ت Atkins, Peter؛ Shriver, Duward F.؛ Overton, Tina؛ Rourke, Jonathan (2006). Inorganic chemistry (ط. 4th). W.H. Freeman. ص. 343, 345. ISBN:0-7167-4878-9.
{{استشهاد بكتاب}}: الوسيط غير المعروف|last-author-amp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)صيانة الاستشهاد: التاريخ والسنة (link) - ^ David N.-S. Hon؛ Nobuo Shiraishi، المحررون (2001). "Preservation of Wood". Wood and cellulosic chemistry. New York, NY: Dekker. ص. 799. ISBN:978-0-8247-0024-9. مؤرشف من الأصل في 2020-05-26.
- ^ Eisler، Ronald. "Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review" (PDF). U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. مؤرشف من الأصل (PDF) في 2012-10-07.
| في كومنز صور وملفات عن: مركب قصدير عضوي |