كلوريد الفسفوريل
| كلوريد الفوسفوريل | |
|---|---|
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Phosphoryl trichloride[1] |
|
| أسماء أخرى | |
Phosphorus oxychloride |
|
| المعرفات | |
| CAS | 10025-87-3 |
| بوب كيم | 24813 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | POCl3 |
| الكتلة المولية | 153.33 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.64 غ/سم3 |
| نقطة الانصهار | 1.25 °س |
| نقطة الغليان | 105.8 °س |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
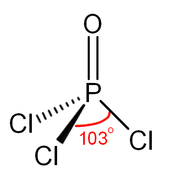
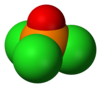
كلوريد الفوسفوريل (أو أوكسي كلوريد الفوسفور) هو مركب كيميائي من الكلور والأكسجين والفوسفور ينتمي إلى هاليدات الفوسفوريل، صيغته POCl3، ويوجد على شكل سائل عديم اللون.
التحضير
[عدل]يمكن أن يحضر المركب مخبرياً بعدة طرق، مثلاً من تفاعل خماسي كلوريد الفوسفور مع ثنائي أكسيد الكبريت:
كما يمكن أن يجرى تفاعل الأكسدة باستخدم مؤكسد قوي مثل كلورات البوتاسيوم:[4]
كما يمكن أن يحضر المركب بأسلوب آخر انطلاقاً من فوسفات ثلاثي الكالسيوم بتفاعله مع الكربون والكلور:[5]
الخواص
[عدل]يوجد المركب في الشروط القياسية على شكل سائل عديم اللون، وللمركب بنية رباعية السطوح مثل الفوسفات.[6]
يتفاعل كلوريد الفوسفوريل مع الماء ليعطي كلوريد الهيدروجين وحمض الفوسفوريك:
الاستخدامات
[عدل]يستخدم المركب في المختبرات الكيميائية لإنجاز تفاعلات بلمهة (نزع الماء)؛ مثل تحويل الأميدات إلى النتريلات.[7]
وكذلك في تفاعلات التحليق:
طالع أيضاً
[عدل]مراجع
[عدل]- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ص. 926. DOI:10.1039/9781849733069-FP001. ISBN:978-0-85404-182-4.
- ^ ا ب ج PHOSPHORUS OXYCHLORIDE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Pradyot، Patnaik (2003). Handbook of Inorganic Chemicals. New York: McGraw-Hill. ص. 709. ISBN:0070494398. مؤرشف من الأصل في 2020-03-26.
- ^ Lerner، Leonid (2011). Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling. Boca Raton, Florida: CRC Press. ص. 169–177. ISBN:9781439813126. مؤرشف من الأصل في 2020-03-26.
- ^ Greenwood، N. N.؛ Earnshaw، A. (1997). Chemistry of the Elements (ط. 2nd). Oxford: Butterworth-Heinemann.
- ^ March، J. (1992). Advanced Organic Chemistry (ط. 4th). New York, NY: Wiley. ص. 723.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة)
| كلوريد الفسفوريل في المشاريع الشقيقة: | |
| |