كلور
| ||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| غاز أصفر مخضر (سائل أصفر عندما يُسَيَّل)  الخطوط الطيفية للكلور | ||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | كلور، 17، Cl | |||||||||||||||||||||||||||
| تصنيف العنصر | هالوجين | |||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 17، 3، p | |||||||||||||||||||||||||||
| الكتلة الذرية | 35.453 غ·مول−1 | |||||||||||||||||||||||||||
| توزيع إلكتروني | Ne]; 3s2 3p5] | |||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 7 (صورة) | |||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||
| الطور | غاز | |||||||||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كيلوباسكال) 3.2 غ/ل | |||||||||||||||||||||||||||
| كثافة السائل عند نقطة الغليان | 1.5625[1] غ·سم−3 | |||||||||||||||||||||||||||
| نقطة الانصهار | 171.6 ك، -101.5 °س، -150.7 °ف | |||||||||||||||||||||||||||
| نقطة الغليان | 239.11 ك، -34.04 °س، -29.27 °ف | |||||||||||||||||||||||||||
| النقطة الحرجة | 416.9 ك، 7.991 ميغاباسكال | |||||||||||||||||||||||||||
| حرارة الانصهار | Cl2) 6.406) كيلوجول·مول−1 | |||||||||||||||||||||||||||
| حرارة التبخر | Cl2) 20.41) كيلوجول·مول−1 | |||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | (Cl2) 33.949 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||
| أرقام الأكسدة | 7, 6, 5, 4, 3, 2, 1, -1 (أكاسيده حمضية قوية) | |||||||||||||||||||||||||||
| الكهرسلبية | 3.16 (مقياس باولنغ) | |||||||||||||||||||||||||||
| طاقات التأين | الأول: 1251.2 كيلوجول·مول−1 | |||||||||||||||||||||||||||
| الثاني: 2298 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| الثالث: 3822 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±102 بيكومتر | |||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 175 بيكومتر | |||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري معيني قائم | |||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[2] | |||||||||||||||||||||||||||
| مقاومة كهربائية | > 10 أوم·متر (20 °س) | |||||||||||||||||||||||||||
| الناقلية الحرارية | 8.9x10-3 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||
| سرعة الصوت | (غاز، 0 °س) 206 متر/ثانية | |||||||||||||||||||||||||||
| رقم CAS | 7782-50-5 | |||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الكلور | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
الكلور هو عنصر كيميائي رمزه Cl وعدده الذرّي 17؛ ويقع في الجدول الدوري ضمن عناصر الدورة الثالثة وفي المرتبة الثانية في مجموعة الهالوجينات تحت الفلور وفوق البروم. يوجد الكلور في الشروط القياسية من الضغط ودرجة الحرارة على شكل غاز ثنائي الذرّة Cl2 ذي لونٍ أصفرٍ مخضَرّ، وهو ذو نشاطٍ كيميائي كبير ويتفاعل مع أغلب العناصر الأخرى ليشكّل مركّبات منها، إذ أنّه من المؤكسدات القويّة، وله ألفة إلكترونية كبيرة، ويحتلّ المرتبة الثالثة في ترتيب كهرسلبية العناصر، وذلك بعد الفلور والأكسجين.
حُضِّرَ عنصر الكلور من تفاعل كيميائي لأوّل مرة سنة 1630، ولكن لم يتمكّن العلماء من التعرّف عليه حينئذٍ؛ وكان كارل فلهلم شيله أوّل من وصف غاز الكلور، وذلك سنة 1774، لكنّه ظنّ حينها أنّه أكسيد لعنصر جديد، إلّا أنّ تجارب الكيميائيين فيما بعد بيّنت أنّه عنصرٌ نقي، وذاك ما أكّده همفري ديفي سنة 1810، وأطلق عليه اسم الكلور من الإغريقية «χλωρός» (خلوروس)، والتي تعني «الأخضر الشاحب» نظراً للونه.
يأتي ترتيب الكلور في المرتبة التاسعة عشرة من حيث وفرته في القشرة الأرضية؛ إلّا أنّه يوجد بشكل وافر على شكل أيون كلوريد منحلّ في ماء البحر (خاصّةً على شكل كلوريد الصوديوم)؛ كما يمكن الحصول على كافّة أشكال الكلوريدات الأخرى من حمض الهيدروكلوريك. يُستحصَل على الكلور تجارياً من الأجاج (محاليل ملحية مركّزة) بعملية تحليل كهربائي، وخاصّةً بواسطة عملية الكلور القلوي. ساهمت الخواص المؤكسدة القويّة للكلور في دخوله بتطبيقاتٍ تجارية شائعة الاستخدام، مثل عمليات تبييض الملابس (القَصْر) وفي صناعة المطهّرات؛ بالإضافة إلى دخوله ضمن المتفاعلات في الصناعة الكيميائية؛ فهو يدخل مثلاً في تركيب بوليمر كلوريد متعدد الفاينيل (PVC) واسع الانتشار.
عند تراكيز مرتفعة فإنّ غازَ الكلور خَطِرٌ وسامٌّ للغاية بالنسبة للكائنات الحية؛ وقد جرى استخدامه سلاحاً كيميائياً لأوّل مرّة في الحرب العالمية الأولى؛ بالمقابل فإنّ أيون الكلوريد ذو دورٍ حيويٍّ مهمّ. من جهةٍ أخرى، فإنّ مركّبات كلوروفلوروكربون ذات تأثيرٍ سلبي على البيئة، حيث تلعب دوراً كبيراً في نضوب طبقة الأوزون.
التاريخ
[عدل]
لم يُعرَف الكلور عنصراً كيميائياً مستقلّاً إلّا في مطلع العصور الحديثة، لكنّ التعامل مع أملاحه كان شائعاً منذ القدم، فقد وجد علماء الآثار دلائلَ تاريخية على أنّ الملح الصخري كان مستخدماً منذ 3000 سنة قبل الميلاد، في حين أنّ الأجاج كان قد استخدم منذ حوالي 6000 سنة قبل الميلاد.[3] من الوارد أن يكون علماء القرون الوسطى قد تمكّنوا من الحصول على الكلور أثناء اكتشاف طريقة تحضير الماء الملكي وكيفية إذابته للذهب، إذ أنّ غاز الكلور هو أحد منتجات ذاك التفاعل؛ إلّا أنّه لم يتمكّن العلماء من التعرّف عليه أو عزله أو وصفه.
تمكّن يان بابتست فان هيلمونت حوالي سنة 1630 من التعرّف على وجود الكلور غازاً مستقلاً؛[4] لكنّ أوّل وصفٍ منهجيٍّ كان من كارل فلهلم شيله، الذي درسه بالتفصيل سنة 1774، ولذلك يُنسَب إليه اكتشاف هذا العنصر.[5] حصل شيله على غاز الكلور من تفاعل ثنائي أكسيد المنغنيز (معدن البيرولوسيت) مع حمض الهيدروكلوريك.[4] لاحظ شيله العديد من خواص الكلور، مثل تأثيره المبيّض على ورقة عبّاد الشمس، وأثره المميت على الحشرات، ولونه الأصفر المخضرّ، ورائحته القويّة القريبة من رائحة الماء الملكي؛[6] لكنه لم يتعرف عليه عنصراً،[7] وأسماه بشكل خاطئ «هواء حمض المورياتيك منزوع الفلوجستون»، حيث نسبه إلى «حمض المورياتيك» (وهو الاسم القديم لحمض الهيدروكلوريك)، وكذلك إلى نظرية الفلوجستون الخاطئة التي كانت لا تزال سائدة حينئذٍ. اقترح عددٌ من العلماء، ومنهم كلود لوي برتوليه، أنّ ذلك الغاز يتكوّن من مزيجٍ من الأكسجين وعنصرٍ جديدٍ لم يُكتَشف بعد أسماه «مورياتيكوم muriaticum».[8][9] في سنة 1809 حاول لوي جوزيف غي لوساك ولوي جاك تينار مفاعلةَ هذا الغاز الجديد مع الفحم بهدف تحرير ذاك العنصر الجديد من الأكسجين،[7] إلّا أنّ محاولَتَهُما باءَت بالفشل، ممّا دَفعهُما إلى الشكّ بالقول بأنّ ذاك الغاز ربّما قد يكون عنصراً بحدّ ذاته.[10] أكّد همفري ديفي سنة 1810 تلك المزاعم بإجرائه ذات التجربة مرّة أخرى، وخَلُصَ أنّ ذلك الغاز هو بالفعل عنصرٌ وليس مركّباً.[7] نشر ديفي نتائج دراسته إلى الجمعية الملكية في ذات السنة،[4] وأطلق عليه اسم الكلور من الإغريقية «χλωρός» (خلوروس)، والتي تعني «الأخضر الشاحب» نظراً للونه.[11] أمّا لفظ هالوجين، والذي يعني «مولّد الملح»، فكان قد أطلقه يوهان شفايغر على الكلور سنة 1811؛[12] إلّا أنّ هذا المصطلح استخدِمَ لاحقاً لوصف جميع العناصر في مجموعة الكلور بناءً على اقتراح من يونس ياكوب بيرسيليوس سنة 1826.[13][14] تمكّن مايكل فاراداي من تسييل غاز الكلور أوّل مرّة سنة 1823.[15][16][17]
كان كلود لوي برتوليه أوّل من استعمل غاز الكلور للتبييض، وذلك سنة 1785؛[18][19] ثم تمكّن لاحقاً من إنتاج هيبوكلوريت الصوديوم سنة 1789 في مختبره في ضاحية جافيل (والتي هي حاليًا جزءٌ من مدينة باريس)، وذلك من تمرير غاز الكلور في محلولٍ من كربونات الصوديوم؛ فحصل على سائل أسماه ماء جافيل. عُدّلت هذه العملية لاحقاً من تشارلز تينانت، حيث حصل أوّلاً على محلولٍ من هيبوكلوريت الكالسيوم (الجير المُكَلوَر)، وبعد ذلك على الشكل الصلب منه (مسحوق التبييض)،[18] الأكثر ثباتاً وأماناً للاستعمال. في نهاية القرن التاسع عشر ظهرت براءة اختراع لإنتاج هيبوكلوريت الصوديوم من التحليل الكهربائي لمحاليل الأجاج الملحية المركّزة من أجل إنتاج هيدروكسيد الصوديوم وغاز الكلور، والتي كانت تمزج للحصول على هيبوكلوريت الصوديوم؛[20][21] وهي عملية تعرف باسم عملية الكلور القلوي، والتي تعدّ الآن الخيار الأوّل لإنتاج غاز الكلور بالإضافة إلى هيدروكسيد الصوديوم على نطاقٍ صناعي.[22][23] كان أنطوان جيرمان لاباراك في عشرينيّات القرن التاسع عشر من الرائدين في استخدام ماء جافيل مادّةً مطهّرة ومقاومةً للتفسّخ؛[24] ومن حينها شاع استخدام الكلور من ضمن المعقّمات.[6] استخدَم الجيش الإمبراطوري الألماني غاز الكلور سلاحاً كيميائياً أوّل مرّة في الثاني والعشرين من أبريل سنة 1915 بالقرب من مدينة إيبر أثناء الحرب العالمية الأولى؛[25][26] وكان أثرُ هذا الهجوم كارثياً على قوّات الحلفاء، إذ لم تكن الأقنعة الواقية من الغازات منتشرة الاستخدام.[27][28]
الوفرة الطبيعية
[عدل]
إنّ غاز الكلور نشيط كيميائياً بشكلٍ كبير بحيث لا يمكن أن يوجد على شكل حرٍّ في الطبيعة؛ لكنّه يوجد بشكل منتشر على هيئة أملاح الكلوريدات. يأتي الكلور في حوالي المرتبة العشرين من حيث الوفرة الطبيعية في القشرة الأرضية، وذلك بمقدار يتراوح بين 126-145 جزء في المليون.[29] من جهةٍ أخرى، فإنّ محتوى الكلوريد في ماء البحر مرتفع بالمقارنة مع اليابسة، كما يوجد أيضاً بنسبٍ مرتفعة في بعض البحار المغلقة مثل البحر الميّت والبحيرة المالحة الكبرى.[30] يعود ذلك إلى سهولة انحلالية الكلوريدات في الماء؛ إذ يصل محتوى ماء البحر من الكلوريد إلى 19.4 غ/ل؛[29] ويشكل كلوريد الصوديوم بتركيز 18.1 غ/ل حوالي نصف كمية الأملاح المنحلة فيه.[31]
أكثر المعادن الحاوية على الكلوريد شيوعاً هو معدن الهاليت (كلوريد الصوديوم NaCl)؛ وهو أشهر معادن الهاليدات؛ بالإضافة أيضاً إلى السيلفيت (كلوريد البوتاسيوم KCl)، والكارناليت KMgCl3·6 H2O، والبيشوفيت MgCl2·6 H2O والكاينيت KMgCl(SO4)·3 H2O. من جهة أخرى، يوجد عددٌ كبيرٌ نسبياً من مركبات الكلور العضوية المتوفّرة طبيعياً؛[32] وخاصّةً في الأحياء البحرية مثل العشب البحري والإسفنجيات والغلاليات والمرجان.[32]
تتشكّل جذور الكلور في الطبيعة من أثر البشر عليها نتيجة تفكّك مركّبات الكلور العضوية في الستراتوسفير، وخاصّةً من مركّبات الكلوروفلوروكربون (CFCs)؛ والتي يمكنها أن تسبّب نضوب الأوزون.[33]
الإنتاج
[عدل]يمكن إنتاج غاز الكلور مخبرياً من تفاعل حمض الهيدروكلوريك مع ثنائي أكسيد المنغنيز:
وهي ذات طريقة الإنتاج التي تمكّن كارل فلهلم شيله من خلالها اكتشاف غازَ الكلور. إلّا أنّه لم تعد هناك حاجة لاتباع هذا الأسلوب حالياً مع توفّر المادّة تجارياً. يُنتَج الكلور صناعياً من التحليل الكهربائي لمحلول كلوريد الصوديوم في الماء بطريقةٍ تعرف باسم عملية الكلور القلوي، والتي انتشرت على نطاقٍ صناعي منذ أواخر القرن التاسع عشر؛ وهي تمثّل حالياً الطريقة المثلى للحصول على الكلور.[22][34] ما يرفع من قيمة هذه العملية أنّه يستحصل منها على منتجاتٍ أخرى ذات قيمة، وهي غاز الهيدروجين وهيدروكسيد الصوديوم.
تُجرى العملية وفق التفاعل الكيميائي الإجمالي التالي:[35]

ويكون نصفا التفاعل في تفاعل الأكسدة-الاختزال الحاصل على الشكل:
التفاعل على المصعد
التفاعل على المهبط
توجد عدّة أنظمة من الخلايا المستخدمة في عملية الكلور القلوي، وذلك إمّا بالتحليل الكهربائي الغشائي أو التحليل الكهربائي الحجابي أو عن طريق خلية الزئبق؛ ولكن الذي تشترك فيه جميعَها هو فصلُ المهبط عن المصعد، إذ أنّ امتزاج النواتج من الحجرتين يؤدّي إلى تشكّل مزيج انفجاري من الهيدروجين والكلور، بالإضافة إلى تفاعل الكلور مع الهيدروكسيد، حيث يتشكّل الهيبوكلوريت:
بإجراء التحليل الكهربائي في الخلية الحجابية يوضَع حاجزٌ فاصلٌ حاجبٌ (سابقاً من الأسبست) بين المهبط والمصعد، ممّا يحول دون إعادة امتزاج الكلور المتشكّل على المصعد من التفاعل مع هيدروكسيد الصوديوم والهيدروجين المتشكّلين على المهبط.[36] يؤمَّن إضافة المحلول الملحي المركّز (الأجاج) إلى حجرة المصعد في الخلية باستمرار، حيث ينفذ عبر الحاجز النفوذ إلى حجرة المهبط حيث ينتج الصود الكاوي. يوجد نظامٌ آخرٌ قديمٌ من الخلايا اسمه نظام خلية الزئبق، حيث يطفو محلولٌ ملحيٌّ مركّز على طبقة من الزئبق (المهبط)، والذي ينتج عليه في هذه الحالة ملغمة صوديوم؛ في حين أن الكلور ينتج على المصعد كما في خلية الحاجز؛ وهي تتميّز بأنّ النواتج تكون ذات نقاوة مرتفعة، إلّا أنّ التسمّم بالزئبق هو أحد المشاكل الرئيسية لهذا الأسلوب.[22]
يُستخدَم في نظام الخلية الغشائية غشاءٌ شبه منفذ من النافيون، والذي يقوم بدور مبادلٍ أيوني؛ وتجري العملية بشكل مماثل لما يتمّ في عملية الخلية الحجابية. تُنتِجُ هذه العملية هيدروكسيد الصوديوم بدرجة نقاوةٍ مرتفعة، لكنّها تتطلّب محاليل ملحية مركّزة عالية النقاوة.[37]
بأسلوب آخر لإنتاج الكلور، يُؤكسَد كلوريد الهيدروجين في عملية ديكون باستخدام غاز الأكسجين:
تتطلّب العملية الأصلية وجود حفّاز من النحاس؛ إلّا أنّ تطويراً على العملية لزيادة كفاءتها الإنتاجية أدّى إلى التحوّل إلى حفّازات معتمدة على الكروم والروثينيوم.[38] بأسلوبٍ آخر مطوّر من شركة دو بونت سنة 1975 يُؤكسَد كلوريد الهيدروجين باستخدام مزيج من حمض الكبريتيك وحمض نتروزيل الكبريتيك؛ حيث يتشكّل ثنائي أكسيد النيتروجين المسؤول عن عملية الأكسدة؛ لكنّ هذه العملية لم تكن ذات جدوى اقتصادية كبيرة، لذلك لم تعد مستخدمة. يُعبّأ الكلور المنتَج وفق العمليات المذكورة في أسطوانات أو حاويات ذات سعات متفاوتة حسب استطاعة الإنتاج وحسب نوع التطبيق المراد له.[39] يعدّ الكلور من المواد الكيميائية الأوّلية المهمّة في الصناعة؛ فقد أنتج منه سنة 2006 على سبيل المثال حوالي 58.9 مليون طنّ.[40]
النظائر
[عدل]هناك نظيران مستقرّان للكلور، الأوّل هو 35Cl بوفرة طبيعية مقدارها 75.78%، والآخر هو النظير 37Cl، والذي يشكّل 24.22% من عنصر الكلور في الطبيعة. تلاحَظ هذه النسبة بين النظيرين بشكلٍ واضحٍ في قياسات مطيافية الكتلة للمركّبات العضوية أو اللاعضوية؛ وهي تبلغ حسابياً 37.89:12.11 ممّا يعطي الكلور كتلةً ذرّيةً قياسيةً مقدارها 35.45 وحدة كتل ذرية (تُقرَّب أحياناً لتسهيل الحساب إلى 35.5). يتشكّل هذان النظيران في النجوم في عملية احتراق الأكسجين وعملية احتراق السيليكون.[41]
أمّا باقي نظائر الكلور فهي مشعّة وعمر النصف لها قصير. للكلور إجمالاً أربعةٌ وعشرون نظيراً معروفاً، تتراوح أعداد الكتلة لها بين 28 و 51 مع وجود متصاوغين نووين اثنين، وهما 34mCl و 38mCl. إنّ أطول نظائر الكلور المشعّة عمراً هو النظير كلور-36 36Cl؛ في حين أنّ لباقي النظائر المشعّة لهذا العنصر عمر نصف أقلّ من ساعةٍ واحدة، والعديد منها أقلّ من ثانية واحدة. أقصر هذه النظائر المشعّة عمراً هو النظير كلور-29 29Cl وكلور-30 30Cl اللذَين لديهما أعمار نصف أقلّ من 20 و 30 نانو ثانية على الترتيب.
على العموم فإنّ نمط الاضمحلال الإشعاعي للنظائر الأخف من 35Cl هو بحدوث التقاط إلكترون إلى نظائر الكبريت؛ في حين أنّ نمط الاضمحلال للنظائر الأثقل من 37Cl هو بحدوث اضمحلال بيتا إلى نظائر الآرغون؛ أمّا النظير 36Cl فقد يكون نمط الاضمحلال له إمّا إلى نظير الكبريت المستقرّ 36S أو إلى الآرغون-36.36Ar.[42] للنظير كلور-36 36Cl استقرارية نسبية رغم كونه نظيراً مشعّاً، حيث أنّ عمر النصف حوالي 300 ألف سنة (301,300 سنة).[42] توجد آثار فقط من النظير كلور-36 في الطبيعة على شكل نويدة كونية، وتكون نسبته (7–10) × 10−13 إلى 1 بالمقارنة مع نظيرَي الكلور المستقرَّين. تتشكّل هذه الآثار من النظير كلور-36 في غلاف الأرض الجوّي من أثر تشظية الأشعّة الكونية على 36Ar؛ كما ينتج في الطبقات العليا من غلاف الأرض الصخري من تنشيط النيوترون الحراري للنظير 35Cl ومن تحلّل النظيرين 39K و40Ca في القشرة الأرضية.[43][44] بسبب عمر النصف الطويل ولثبات التركيز في الغلاف الجوّي تُستخدَم تراكيز النظير كلور-36 36Cl في تحديد عمر عيّنات المياه الجوفية إلى عمرٍ أقصاه مليون سنةٍ خلت؛[45] كما يُستخدَم في تحديد أعمار عيّنات المستحاثات.[46]
الخواص الفيزيائية
[عدل]
للكلور صفات فيزيائية تقع وسطاً بين جاره الأعلى منه الفلور وجاره الأسفل منه البروم في مجموعة الهالوجينات. يوجد الكلور في الشروط القياسية من الضغط ودرجة الحرارة على شكل غاز ثنائي الذرّة Cl2؛ ذي لونٍ أصفرٍ مخضرّ، وكثافةٍ مقدارها 3.214 غ/ل عند الدرجة 0 °س؛ وهو أثقل من الهواء بحوالي مرتين ونصف. يزداد لون الهالوجين غُمقاً نزولاً في المجموعة، بالتالي، في حين أنّ للفلور الغازي لونٌ أصفر شاحب، فإنّ للكلور لونٌ أصفر مخضر مميّز؛ وتعود هذه النزعة في تغيّر اللون إلى ازياد طول الموجة التي يحدث عندها امتصاصٌ للضوء؛[47] والتي تترجم على شكل الانتقالات الإلكترونية الذرّية داخل الجزيء.[48]
كما هو الحال مع باقي الهالوجينات يبدي الكلور قوى فان دير فالس بين الجزيئية، وبما أنّ تلك القوى تزيد مع ازدياد عدد الإلكترونات، بالتالي فإنّ قيمة درجة حرارة انصهار ووغليان الكلور تقع بشكل متوسّط بين الفلور والبروم؛ فالكلور يتكثّف عند −34.0 °س ويتجمد عند −101.0 °س.[49] مع ازدياد الوزن الجزيئي للهالوجينات نزولاً في المجموعة، فإنّ الكثافة وحرارتي الانصهار والتبخّر للكلور تقع مجدّداً بين قيمتي الفلور والبروم، رغم أنّ حرارة التبخّر للهالوجينات على العموم منخفضة نسبياً (ممّا يؤدّي إلى ارتفاع التطايرية) وهذا بسبب البنية الجزيئية ثنائية الذرّة.[47]

يسهل تسييل غاز الكلور، إذ أنّ تطبيق ضغطٍ مقداره 6.7 بار عند الدرجة 20 °س يؤدّي إلى الحصول على سائل أصفر من الكلور، وهو ما يمكّن من نقله في أسطوانات أو صهاريج ملائمة.[49] تتناقص شدّة لون الكلور السائل مع انخفاض درجة الحرارة، وهو يصبح عند حوالي الدرجة −195 °س عديم اللون تقريباً.[50] كما هو الحال مع البروم واليود الصلبَين، يتبلور الكلور الصلب على نمط نظام بلوري معيني قائم،[51] بحيث تكون الشبكة البلّورية على شكل طبقات من جزيئات Cl2. يبلغ طول الرابطة Cl–Cl في الجزيء الصلب مقدار 198 بيكومتر (بم)، وهي قريبة من قيمة طول الرابطة في الحالة الغازية (199 بم)؛ أمّا قيمة المسافة Cl···Cl بين الجزيئات فهي 334 بم داخل الطبقة الواحدة، و369 بم بين الطبقات.[52] يشير هذا النظام الطبقي في بناء البلّورات إلى سهولة انفلاقها (انفصامها)؛[53] كما تعني هذه الأرقام أنّ الكلور موصلٌ سيّئٌ للكهرباء، وبالفعل فإنّ القيمة منخفضة جدّاً، بحيث لا يمكن قياسها عملياً؛[47] بالتالي فهو عازل ممتاز.
ينحلّ الكلور بسهولةٍ في الماء؛ إذ يمكن أن ينحلّ حوالي 2.3 ليتر من الكلور في ليتر من الماء؛[54] كما ينحلّ بشكلٍ جيّدٍ في سوائل المركّبات الكلورية، اللاعضوية منها مثل ثنائي كلوريد ثنائي الكبريت، والعضوية مثل الكلوروفورم؛ وكذلك في مذيبات أخرى مثل البنزين وثنائي ميثيل فورماميد.[38]
الخواص الكيميائية
[عدل]يُصنّف الكلور ضمن مجموعة الهالوجينات، وهو يقع فيها بالمرتبة الثانية تحت الفلور وفوق البروم، بالتالي فإنّ هناك تشابهاً في الخواص الكيميائية الإجمالية، وتقع بعض الخواص له وسطاً بين العنصرَين المذكورَين، كما هو الحال في قيمة الكهرسلبية وطاقة التأيّن والألفة الإلكترونية ونصف القطر الذرّي وطول الرابطة X–X، وغيرها.[47] للكلور توزيع إلكتروني على النمط Ne]3s23p5]، بالتالي توجد سبعة إلكترونات في الغلاف الإلكتروني الخارجي للذرّة (غلاف التكافؤ)، بالتالي يتبقّى له إلكترون واحد ليكمل الثمانية الإلكترونية المستقرّة، وهذا ما يفسّر النشاط الكيميائي الكبير لهذا العنصر.[47] وبالفعل، فإلى جانب الفلور، يعدّ الكلور ضمن أكثر العناصر نشاطاً كيميائياً؛ فهو يتفاعل تقريباً مع أغلب عناصر الجدول الدوري، ولكن لا يحدث تفاعل مباشر مع الأكسجين والنتروجين والغازات النبيلة. يتفاعل الكلور مع العديد من الفلزّات مثل المنغنيز والزنك وكذلك الفلزّات النبيلة من الذهب والفضّة والبلاتين، ولكن عند درجات حرارة مرتفعة. من جهةٍ أخرى، يميل الكلور إلى التفاعل مع الهيدروجين بشكلٍ عنيفٍ عند وجود طاقة تنشيط مناسبة؛ كما يتفاعل الكلور مع غازات أخرى مثل الأمونيا وكبريتيد الهيدروجين.
الكلور من المؤكسدات القويّة، وهو يأتي بعد الفلور في قوّة الأكسدة، ولكنّه أفضل من البروم واليود؛ وذلك ما يتّضح في قيمة الكمون القياسي لأزواج −X2/X؛ فهي على الترتيب (مقاسة بالفولت) F= +2.866 V وCl= +1.395 V وBr= +1.087 V وI= +0.615 V. لكنّ هذا الأمر لا ينعكس على طاقة الرابطة عند المقارنة بين مركّبات الهالوجينات المختلفة، لأنّ الفلور صغير الحجم، وذو قابلية استقطاب ضعيفة، ويفتقد إلى مدارات d المنخفضة طاقياً التي تسهّل من الارتباط الكيميائي وهو أمرٌ متوفّرٌ في الكلور؛ ومن الفروق الأخرى مقدرة الكلور على تشكيل حالة أكسدة موجبة، إذ أن الفلور لا يستطيع ذلك.[48] بالنظر إلى أنّ الكمون القياسي E°(12O2/H2O) = +1.229 V، وذلك أقلّ من قيمته للكلور، بالتالي فإنّه من المتوقّع نظرياً أن يكون الكلور قادراً على أكسدة الماء، إلّا أنّ هذا التفاعل غير مفضَّل حركياً، كما أنّ هناك تأثيرات الجهود الزائدة التي تعيق من حدوثه؛ بالتالي فإنّ التحليل الكهربائي لمحاليل الكلوريد سيطلق غاز الكلور على المصعد وليس غاز الأكسجين، وهي حقيقةٌ ذات أهميّةٍ كبيرة في عملية إنتاج الكلور الصناعي.[55]
بوجود محفّز طاقي مناسب يمكن للكلور أن يتفاعل مع الهيدروكربونات الأليفاتية، فمع الألكانات يحدث تفاعل استبدال جذري نتيجة تشكّل جذور حرة من الكلور قادرة على فصم الرابطة C-H، ممّا يفتح الباب لحدوث تفاعلات استبدال. بسبب النشاط الكيميائي الكبير للكلور فإنّ التفاعل مع الألكانات يعاني من ضعف الانتقائية الموضعية، لذلك يلاحظ حدوث تعدّد في الكلورة.[56] بالمقابل، فإنّه لا يمكن حدوث تفاعل جذري مع الهيدروكربونات العطرية؛ بل تحدث عملية الكلورة وفق آلية استبدال عطري محب للإلكترونات بوجود حفّاز ملائم من حمض لويس مثل كلوريد الألومنيوم.[57]
المركبات الكيميائية
[عدل]يشكّل الكلور عدداً كبيراً جدّاً من المركّبات الكيميائية، ويمكن أن تتفاوت فيها حالة الأكسدة لهذا العنصر من -1 إلى +7؛ بالرغم من ذلك، تعدّ حالة الأكسدة -1 هي الأكثر استقراراً وشيوعاً، أمّا حالات الأكسدة الموجبة فهي مع العناصر ذات الكهرسلبية المرتفعة مثل الأكسجين والفلور.
- الكلوريدات

تسمّى المركّبات اللاعضوية التي يقع فيها الكلور بحالة أكسدة مقدارها -1 (أيون سالب) باسم الكلوريدات. إذ يستطيع الكلور أن يتفاعل مع الهيدروجين ليشكّل كلوريد الهيدروجين HCl، وهو غاز نشيط كيميائياً، يؤدّي انحلاله في الماء إلى الحصول على حمض الهيدروكلوريك، وهو حمض معدني معروف. يتفاعل الكلور أيضاً مع اللافلزّات ويشكّل الكلوريدات الموافقة، وهي كلوريدات ذات طابع تساهمي؛ كما يستطيع أن يشكّلها حتّى مع بعض الغازات النبيلة، كما هو الحال في مركّب ثنائي كلوريد الزينون XeCl2.
يستطيع الكلور أن يشكّل أملاح الكلوريدات مع العديد من الفلزّات، وهي كلوريدات ذات طابع أيوني ومن أشهر الأمثلة عليها كلوريدات الفلزّات القلوية مثل كلوريد الصوديوم NaCl (ملح الطعام)، وكذلك كلوريد البوتاسيوم KCl. تختلف طريقة التحضير حسب الفلزّ، وذلك إمّا بالتفاعل المباشر مع الفلزّ، ولكن في هذه الحالة سيُستحصَل على كلوريد الفلزّ بأعلى حالة أكسدة ممكنة، كما هو الحال عند تفاعل الكلور مع القصدير، حيث ينتج مركب كلوريد القصدير الرباعي؛ أمّا كلوريدات حالات الأكسدة الأدنى فيمكن تحضيرها من اختزال الكلوريدات الأعلى أو التفكّك الحراري لها، كما هو الحال عند تحضير كلوريد الذهب الأحادي. يمكن تحضير الكلوريدات أيضاً من تفاعل أكسيد أو هيدروكسيد أو كربونات الفلزّ مع حمض الهيدروكلوريك. إنّ الكلوريدات على العموم ذات انحلالية جيّدة في الماء، باستثناء البعض منها مثل كلوريد الفضّة وكلوريد الرصاص الثنائي غير المنحلّة.
- مركبات بين هالوجينية
يشكّل الكلور عدداً من المركّبات بين الهالوجينية، خاصّةً مع الفلور، فتعرف هناك فلوريدات للكلور، مثل مركّب أحادي فلوريد الكلور ClF وثلاثي فلوريد الكلور ClF3، وهي مركّبات ذات قدرة كبيرة على الفلورة والأكسدة. يكون الكلور في هذه المركّبات في حالة أكسدة موجبة، قد تصل إلى +5، كما هو الحال في خماسي فلوريد الكلور ClF5. بالمقابل فإنّ المركّبات بين الهالوجينية مع البروم واليود يكون فيها الكلور بحالة أكسدة سالبة؛ ويعرف من تلك المركّبات ثلاثة فقط، وهي أحادي كلوريد البروم BrCl، وأحادي كلوريد اليود ICl، وثلاثي كلوريد اليود ICl3.
- مركبات لا عضوية أخرى
يعدّ فلوريد الكلوريل ClO2F واحداً من خمسة فلوريدات أكسجينية للكلور؛ وهي تتراوح بين المركب ClOF غير المستقرّ إلى فلوريد البيركلوريل ClO3F؛ أمّا المركّبَين المتبقيّيَن فهما F3ClO وF3ClO2؛ وجميعها عوامل مؤكسدة ومفلورة جيّدة.[58] من المركّبات اللاعضوية الأخرى لهذا العنصر مركّب نترات الكلور ClNO3؛ كما تعرف له أيضاً بعض الهاليدات الزائفة مثل كلوريد السيانوجين ClCN، وكذلك أملاح أخرى مثل السيانات ClNCO والثيوسيانات ClSCN والأزيد ClN3.[59]
- الأكاسيد
هناك سلسلة من أكاسيد الكلور، ولها الصيغة العامة ClOx (حيث x تتراوح بين 1–4) وCl2Ox (حيث x تتراوح بين 1–7). تعدّ أكاسيد الكلور ذات نشاط كيميائي كبير، وهي تتفكّك إلى عنصريها المكوّنين لها بشكلٍ انفجاري؛ من أشهر هذه الأكاسيد أحادي أكسيد ثنائي الكلور Cl2O وثنائي أكسيد الكلور ClO2.
- الأحماض الأكسجينية
هناك أربعة أحماض أكسجينية للكلور، وهي حمض الهيبوكلوروز HOCl، وحمض الكلوروز HOClO، وحمض الكلوريك HOClO2 وحمض البيركلوريك HOClO3؛ وتعدّ أملاح هذه الأحماض معروفة وشائعة ومستقرّة بشكل أكبر من الأحماض نفسها. يعدّ حمض البيركلوريك الوحيد منها الذي يمكن استحصاله على شكل مركّب نقيّ مستقرّ، أمّا الأحماض المتبقيّة فتوجد فقط على شكل محلول. تنخفض قيمة ثابت تفكك الحمض مع ازدياد عدد ذرّات الأكسجين في الحمض، وهو مؤشّر على ازدياد قوّة الحمض؛ وذلك يفسّر تصنيف حمض البيركلوريك ضمن الأحماض الفائقة.
| حالة أكسدة ذرّة الكلور |
البنية الجزيئية | اسم الحمض | اسم الملح الموافق |
|---|---|---|---|
| +I | حمض الهيبوكلوروز (أو حمض تحت الكلوروز) HClO |
هيبوكلوريت (أو تحت كلوريت) | |
| +III | حمض الكلوروز HClO2 |
كلوريت | |
| +V | 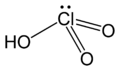 |
حمض الكلوريك HClO3 |
كلورات |
| +VII |  |
حمض البيركلوريك (أو حمض فوق الكلوريك) HClO4 |
بيركلورات (أو فوق كلورات) |
- مركبات الكلور العضوية

تعدّ الرابطة الكيميائية كربون-كلور شائعة في الكيمياء العضوية؛ إذ يوجد عدد كبير جداً من مركّبات الكلور العضوية التي جرى اصطناعها وتحضيرها على شكل كلوريدات عضوية سواء الأليفاتية منها أو العطرية منها، وذلك بعدّة طرق، منها وفق تفاعل هالوفورم، أو بتفاعل إضافة الكلور إلى الرابطة المضاعفة أو عبر عوامل مكلورة مثل خماسي كلوريد الفوسفور أو كلوريد الثيونيل.[60] لهذه المركّبات تطبيقات واسعة تشمل المذيبات وووسائط التبريد والسوائل الهيدروليكية والمبيدات، وكذلك في صناعة الدواء. تؤدّي الكلورة إلى تغيير الخواص الفيزيائية للهيدروكربونات، فهي تجعلها أكثف من الماء؛ كما أنّها مؤلكلات جيّدة، إذ أنّ الكلوريد مجموعة مغادرة.[60] من جهةٍ أخرى، تتميّز الرابطة بين الكلور والكربون بقوّتها، لذلك فإنّ هذه المركّبات لا تتفكّك بسهولة، لذلك فإنّ البعض منها سام ومقاوم للتحلل العضوي وقابل للتراكم داخل الكائنات الحية، ممّا يشكّل خطراً بيئياً؛ ومن الأمثلة على ذلك مركبات ثنائي بنزو الديوكسين متعدّدة الكلور، وهي بالإضافة إلى ثنائي كلورو ثنائي فينيل ثلاثي كلورو الإيثان (DDT) ضمن عدّة مركّبات كلور عضوية ممنوعة وفق اتفاقية استكهولم بشأن الملوّثات العضوية الثابتة.
بالمقابل، توجد هناك أيضاً في المحيط الحيوي مركّبات كلور عضوية طبيعية المنشأ،[61][62] وذلك من عدّة كائنات حيّة مثل البكتريا والعفن والأعشاب البحرية والأشنيات. تشمل هذه المركّبات هاليدات الألكيل مثل كلورو الميثان وهاليدات الأريل؛ بالإضافة إلى مشتقّات الأحماض الأمينية الكلورية. تُصطنَع هذه المركّبات حيوياً بعدّة طرق منها أثر هالو البيروكسيداز بوجود بيروكسيد الهيدروجين.[63]
الكشف عن الكلور
[عدل]لغاز الكلور لون أصفر مخضرّ مميّز، كما أن لديه رائحة مميّزة أيضاً، وذلك يمكّن من الكشف عنه ظاهرياً بشكل فيزيائي؛ أمّا كيميائياً فيُكشَف عنه اعتماداً على خواصه المؤكسدة، إذ أنّ الكلور قادرٌ على أكسدة أيونات اليوديد والبروميد إلى العناصر الموافقة؛ كما أنّ زوال لون كاشف برتقالي الميثيل يستخدَم دليلاً على وجود الكلور. لكنّ هذه الأساليب المذكورة ليست انتقائيةً بالشكل الكافي، إذ تتداخل مع مؤكسدات أخرى.[64] من الأساليب الانتقائية للكشف عن الكلور القيام بالتفاعل مع التولويدين؛ حيث يتشكّل صباغ أصفر، والذي يمكن قياسه لونياً.[64]
أمّا أيونات الكلوريد فيُكشَف عنها بإجراء تفاعل ترسيب بوجود أيونات الفضّة، حيث يترسّب كلوريد الفضّة ضعيف الانحلالية، وهو يتميز بلونه الأبيض عن بروميد الفضة ويوديد الفضة، اللّذان يملكان لوناً أقرب للأصفر. باستخدام أسلوب المعايرة بالفضة يمكن قياس محتوى الكلوريد بالعيّنة.[65]
الدور الحيوي
[عدل]يمتلك عنصر الكلور خواصاً مؤكسدة، لذلك فهو قادرٌ أن يتفاعل مع الأنسجة الحيوية النباتية والحيوانية، بالتالي فهو ضارٌّ ومؤذٍ بالنسبة للكائنات الحيّة. بالمقابل فإنّ لأيون الكلوريد دوراً حيوياً مهمّاً في الجسم، إذ يؤثّر الكلوريد على الضغط التناضحي (الأسموزي)، بالتالي على المحتوى المائي في الجسم. بالإضافة إلى ذلك تساهم أيونات الكلوريد في التبادل الأيوني في الخلايا، وهو أمرٌ يلعب دوراً في نقل ثنائي أكسيد الكربون على شكل بيكربونات في الجسم.[66] من أجل حدوث هذا التبادل ومن أجل إعادة تشكيل جهد الراحة توجد هناك ما يعرف باسم قنوات الكلوريد، وهي تؤمّن مرور أيونات الكلوريد عبر الغشاء الخلوي.[67] تدخل أيونات الكلوريد إلى الجسم عبر تناول ملح الطعام، وتبلغ كمّية التناول اليومية الموصى بها 3.2 غ للبالغين، و0.5 غ للرضع.[68]
يحتوي جسم الإنسان وزنه 70 كغ على 95 غ من الكلوريد.[68] يوجد الكلوريد بشكلٍ منحلٍّ على هيئة أيون مقابل لأيونات الصوديوم في الوسط خارج الخلية، ويتراوح الحدّ الوسطي لتركيز الكلوريد في بلازما الدم بين 100–107 ميلي مول/الليتر.[66] يمكن أن يُفسَّر خروج تراكيز الكلوريد عن القيم الوسطى بحدوث حالةٍ من اضطرابات الكهرل في الجسم، كما هو الحال عند حدوث نقص كلوريد الدم، والذي يمكن أن يترافق مع حدوث نقص التهوية،[69] وكذلك يمكن أيضاً أن يترافق مع حدوث حماض تنفسي؛[70] بالمقابل، فقد وُجدَ أنّ اضطراب فرط كلوريد الدم يمكن أن يؤثّر على نقل الأكسجين عند العجول.[71]
الاستخدامات
[عدل]
يُستخدَم الكلور بشكلٍ واسعٍ في الصناعة الكيميائية، حيث يدخل حوالي الثلثَين منه (63%) لتحضير مركّبات الكلور العضوية، ويعدّ مركّب كلوريد الفاينيل من ضمنها أكثرُها إنتاجاً، لدخوله في صناعة بوليمر كلوريد متعدد الفاينيل (PVC)؛[23] كما تدخل الكلوريدات العضوية في صناعة الأدوية،[23] وكذلك في صناعة المبيدات. في حين أنّ حوالي الخُمس (18%) من الكلور المنتج يدخل في تحضير الكلوريدات اللاعضوية، والتي يمكن أن تُستحصَل من تفاعل الكلور مع الفلزّ الموافق، أو بطريقة أسهل عن طريق تحضير كلوريد الهيدروجين، والذي يعطي محلوله في الماء حمض الهيدروكلوريك، والذي يعدّ مصدراً لأيونات الكلوريد.
أمّا النسبة المتبقيّة (19%) فيستخدم فيها الكلور بشكلٍ مباشر في تركيب المبيّضات والمطّهرات. إذ عند تمرير غاز الكلور في الماء يتشكّل حمض الهيبوكلوروز بالإضافة إلى حمض الهيدروكلوريك، والأوّل من المؤكسدات القويّة وله تأثير مبيّض ومطهّر. يمكن أن يُستخدَم التأثير المبيّض للكلور في صناعة اللبّ والورق، حيث أنّ للكلور يؤكسد الحلقات العطرية في الليغنين، ممّا يغيّر من بنية حامل اللون، بالتالي يبدو الورق بلونٍ أنصع. إلّا أنّ المخاطر الصحّية والبيئية لمركّبات الكلور الناتجة عن العملية مثل مركّبات ثنائي بنزو الديوكسين متعدّدة الكلور أو مركّبات الكلوروفينول أدّى إلى البحث عن بدائل أكثر سلامة، مثل مركّب ثنائي ثيونيت الصوديوم.[72] يستخدم التأثير المطهّر لمحاليل الكلور المائية في كلورة المياه بهدف تنقيتها من الجراثيم، وخاصّةً في تطهير مياه المسابح. تعود الرائحة المميّزة للمياه المعقّمة بمحاليل الكلور المائية إلى مركّبات الكلورامينات، والتي تنتج من تفاعل الكلور الحرّ المنحلّ مع الأمينات في المواد العضوية. يُعمَد بشكلٍ متزايدٍ إلى استخدام الكلورامين بحدّ ذاته في عمليات التطهير بهدف معالجة المياه؛[73] كما يمكن أن تستخدم بدائل كلورية أخرى مثل مركّب ثنائي كلورو إيزوسيانورات الصوديوم أو حمض ثلاثي كلورو إيزوسيانوريك، والتي تتميّز بتوفّرها على شكل مساحيق صلبة سهلة الاستخدام وبكونها قادرةً على تحرير الكلور ببطء لتشكّل بالنهاية حمضّ الهيبوكلوروز، ذا التأثير المطهّر والمعقّم. أمّا بالنسبة لمعالجة ماء الشرب، فعادةً ما تُستخدَم موادٌ كيميائيةٌ أخرى للتطهير، مثل ثنائي أكسيد الكلور أو الأوزون، بهدف تجنّب تشكّل أيّ آثارٍ من مركّبات كلوريةٍ مضرّة، مثل مركّبات ثلاثي هالو الميثان (مركّبات الهالوفورم).[74] هناك على العموم نزعةٌ للتخفيف من وجود مركّبات الكلور في العمليات الصناعية ولإيجاد بدائل مناسبة عنها، نظراً للآثار البيئية والصحّية لها.[75]
المخاطر
[عدل]| كلور | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H270, H315, H319, H331, H335, H400 |
| بيانات وقائية وفق GHS | P220, P244, P261, P304, P340, P312, P403, P233, P410, P403[76] |
| NFPA 704 |
|
| تعديل مصدري - تعديل | |
الكلور غازٌ سامٌّ قادرٌ على التسبّب بالضرر والأذى للجهاز التنفسي والعينين والجلد.[77][78] ما يزيد الخطورة أنّ الكلور أكثفُ من الهواء، بالتالي فإنّه يتركّز في قعر وأسفل الأماكن المغلقة قليلة التهوية. كما أنّ الكلور من المؤكسدات القويّة، بالتالي فهناك خطورة تفاعله مع المواد سهلة الاشتعال.[79][80]
من السهل عموماً الكشف عن الكلور، إذ أنّ التراكيز الدنيا للكشف باستخدام الأجهزة هي حوالي 0.2 جزء في المليون (ppm)، وبالرائحة عند حوالي 3 جزء في المليون. حُدِّدَ التركيز الخطر من غاز الكلور بمقدار 10 جزء في المليون.[81] يمكن للكلور أن يسبّب سعالاً وإقياءاً عند تراكيز مقدارها 30 جزء في المليون؛ في حين أنّه يسبّب ضرراً للرئتين عند 60 جزء في المليون؛ أمّا تركيز 1000 جزء في المليون من غاز الكلور فهو يمكن أن يكون مسبّباً للوفاة في حال استنشاقه بعمق.[6] عيّنت إدارة السلامة والصحة المهنية في الولايات المتّحدة الأمريكية حدَّ التعرّض المسموح به من عنصر الكلور بمقدار 1 جزء في المليون (ppm) أو 3 مغ/م3؛ في حين أنّ المعهد الوطني للسلامة والصحّة المهنية الأمريكي عيّن حدَّ التعرّض الموصى به بمقدار 0.5 جزء في المليون (ppm) لمدّة 15 دقيقة.[81]
يمكن أن يؤدّي تفاعل الكلور المستخدم في تنقية المياه إلى تشكّل نواتج ثانوية، والتي قد يكون لها تأثيرات سلبية على صحّة الإنسان.[82][83] كما أنّه ينبغي على العموم تجنّب خلط المعقّمات والمطهّرات في المنازل، إذ يمكن أن يؤدّي مزج محاليل الهيبوكلوريت مع منظّفات حمضية معيّنة إلى انطلاق غاز الكلور المهيّج؛[84] كما أن مزج محاليل الهيبوكلوريت مع الأمونيا يمكن أن يؤدّي إلى إنتاج مركبات الكلورامينات، التي قد تسبّب الأذى.[85]
- مخاطر إنشائية
- يمكن للكلور المستخدّم في تطهير وتعقيم المياه أن يتفاعل مع الإنشاءات المعدنية والفولاذية ممّا قد يسبّب حدوث تشقّق ناتج عن إجهاد التآكل.[86] كما يمكن أن تلاحظ تأثيرات التشقّق على أنواع من البوليمرات المستخدمة في التجهيزات الصحّية، مثلما هو الحال في المصنوعة من بولي أوكسي الميثيلين على سبيل المثال.[87]
- يمكن لعنصر الحديد أن يتّحد مع الكلور عند درجات حرارة مرتفعة في تفاعل ناشر للحرارة بشكلٍ كبير، الأمر الذي يسبّب حدوث ما يعرف باسم «نار الكلور والحديد»؛[88][89] وهي تمثّل خطراً في منشآت الصناعات الكيميائية التي تستخدم الأنابيب الفولاذية لنقل الكلور.[88][89]
طالع أيضاً
[عدل]مراجع
[عدل]- ^ Chlorine, Gas Encyclopaedia, Air Liquide
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ "The earliest salt production in the world: an early Neolithic exploitation in Poiana Slatinei-Lunca, Romania". مؤرشف من الأصل في 2011-04-30. اطلع عليه بتاريخ 2008-07-10.
- ^ ا ب ج Greenwood and Earnshaw, p. 789–92
- ^ Scheele، Carl Wilhelm (1774). "Om Brunsten, eller Magnesia, och dess Egenskaper". Kongliga Vetenskaps Academiens Handlingar [Proceedings of the Royal Scientific Academy]. ج. 35: 89–116, 177–194. مؤرشف من الأصل في 2020-04-23.
- ^ ا ب ج Greenwood and Earnshaw, pp. 792–93
- ^ ا ب ج "17 Chlorine". Elements.vanderkrogt.net. مؤرشف من الأصل في 2010-01-23. اطلع عليه بتاريخ 2008-09-12.
- ^ Ihde, Aaron John (1984). The development of modern chemistry. Courier Dover Publications. ص. 158. ISBN:978-0-486-64235-2. مؤرشف من الأصل في 2020-05-30.
- ^ Weeks، Mary Elvira (1932). "The discovery of the elements. XVII. The halogen family". Journal of Chemical Education. ج. 9 ع. 11: 1915. Bibcode:1932JChEd...9.1915W. DOI:10.1021/ed009p1915.
- ^ Gay-Lussac؛ Thenard (1809). "Extrait des mémoires lus à l'Institut national, depuis le 7 mars 1808 jusqu'au 27 février 1809" [Extracts from memoirs read at the national Institute, from 7 March 1808 to 27 February 1809]. Mémoires de Physique et de Chimie de la Société d'Arcueil. ج. 2: 295–358. مؤرشف من الأصل في 2014-02-12.
- ^ Davy، Humphry (1811). "The Bakerian Lecture. On some of the combinations of oxymuriatic gas and oxygene, and on the chemical relations of these principles, to inflammable bodies". Philosophical Transactions of the Royal Society of London. ج. 101: 1–35. Bibcode:1811RSPT..101....1D. DOI:10.1098/rstl.1811.0001. مؤرشف من الأصل في 2020-04-23.
- ^ Schweigger, J.S.C. (1811). "Nachschreiben des Herausgebers, die neue Nomenclatur betreffend" [Postscript of the editor concerning the new nomenclature]. Journal für Chemie und Physik (بالألمانية). 3 (2): 249–255. Archived from the original on 2020-04-23.
- ^ Berzelius, Jacob (1826). Årsberättelser om Framstegen i Physik och Chemie [Annual Report on Progress in Physics and Chemistry] (بالسويدية). Stockholm, Sweden: P.A. Norstedt & Söner. Vol. 6. p. 187. Archived from the original on 2020-04-23.
- ^ Snelders, H. A. M. (1971). "J. S. C. Schweigger: His Romanticism and His Crystal Electrical Theory of Matter". Isis. ج. 62 ع. 3: 328–338. DOI:10.1086/350763. JSTOR:229946.
- ^ Faraday، M. (1823). "On fluid chlorine". Philosophical Transactions of the Royal Society of London. ج. 113: 160–164. Bibcode:1823RSPT..113..160F. DOI:10.1098/rstl.1823.0016. مؤرشف من الأصل في 2020-04-23.
- ^ Chodos, Alan (المحرر). "This Month in Physics History September 4, 1821 and August 29, 1831: Faraday and Electromagnetism". American Physical Society. مؤرشف من الأصل في 2010-06-15. اطلع عليه بتاريخ 2010-05-08.
- ^ O'Connor J. J.؛ Robertson E. F. "Michael Faraday". School of Mathematics and Statistics, University of St Andrews, Scotland. مؤرشف من الأصل في 2010-02-20. اطلع عليه بتاريخ 2010-05-08.
- ^ ا ب "Bleaching". Encyclopædia Britannica (ط. 9th Edition (1875) and 10th Edition (1902)). مؤرشف من الأصل في 2012-05-24. اطلع عليه بتاريخ 2012-05-02.
- ^ Aspin، Chris (1981). The Cotton Industry. Shire Publications Ltd. ص. 24. ISBN:978-0-85263-545-2. مؤرشف من الأصل في 2020-05-30.
- ^ Paul May. "Bleach (Sodium Hypochlorite)". University of Bristol. مؤرشف من الأصل في 2016-12-13. اطلع عليه بتاريخ 2016-12-13.
- ^ Almqvist، Ebbe (2003). History of Industrial Gases. Springer Science & Business Media. ص. 220. ISBN:978-0-306-47277-0. مؤرشف من الأصل في 2020-05-30.
- ^ ا ب ج Greenwood and Earnshaw, p. 798
- ^ ا ب ج Peter Schmittinger u. a.: Chlorine. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, ISBN 3-527-30385-5.
- ^ Bouvet, Maurice (1950). "Les grands pharmaciens: Labarraque (1777–1850)" [The great pharmacists: Labarraque (1777–1850)]. Revue d'Histoire de la Pharmacie (بالفرنسية). 38 (128): 97–107. DOI:10.3406/pharm.1950.8662.
- ^ "Chlorine – History" (PDF). مؤرشف من الأصل (PDF) في 2007-02-21. اطلع عليه بتاريخ 2008-07-10.
- ^ "Weaponry: Use of Chlorine Gas Cylinders in World War I". historynet.com. 12 يونيو 2006. مؤرشف من الأصل في 2008-07-02. اطلع عليه بتاريخ 2008-07-10.
- ^ Staff (29 يوليو 2004). "On the Western Front, Ypres 1915". Veteran Affairs Canada. مؤرشف من الأصل في 2008-12-06. اطلع عليه بتاريخ 2008-04-08.
- ^ Lefebure، Victor؛ Wilson, Henry (2004). The Riddle of the Rhine: Chemical Strategy in Peace and War. Kessinger Publishing. ISBN:978-1-4179-3546-8.
- ^ ا ب David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. CRC Press, Boca Raton, Florida 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ^ Greenwood and Earnshaw, p. 795
- ^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 433
- ^ ا ب Gordon W. Gribble: The diversity of naturally produced organohalogens. In: Chemosphere. 2003, 52, S. 289–297, doi:10.1016/S0045-6535(03)00207-8.
- ^ Martin Dameris, Thomas Peter, Ulrich Schmidt, Reinhard Zellner: Das Ozonloch und seine Ursachen. In: Chemie in unserer Zeit. 41, 3, 2007, S. 152–168, doi:10.1002/ciuz.200700418.
- ^ F. R. Minz, R. Schliebs: Moderne Verfahren der Großchemie: Chlor und Natronlauge. In: Chemie in unserer Zeit. 12. Jahrg. Nr. 5, 1978, S. 135–145, doi:10.1002/ciuz.19780120502.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, p. 408, ISBN 0-12-352651-5
- ^ "The diaphragm cell process". Euro Chlor. مؤرشف من الأصل في 2011-11-11. اطلع عليه بتاريخ 2007-08-15.
- ^ "The membrane cell process". Euro Chlor. مؤرشف من الأصل في 2011-11-11. اطلع عليه بتاريخ 2007-08-15.
- ^ ا ب Schmittinger, Peter et al. (2006) "Chlorine" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co., دُوِي:10.1002/14356007.a06_399.pub2
- ^ Greenwood and Earnshaw, pp. 796–800
- ^ The Chlorine Institute: Chlorine Manufacture, Arlington, 2008, abgerufen am 25. Juni 2009. نسخة محفوظة 16 مايو 2016 على موقع واي باك مشين.
- ^ Cameron، A. G. W. (1973). "Abundance of the Elements in the Solar System" (PDF). Space Science Reviews. ج. 15 ع. 1: 121–46. Bibcode:1973SSRv...15..121C. DOI:10.1007/BF00172440. مؤرشف من الأصل (PDF) في 2011-10-21.
- ^ ا ب G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, دُوِي:10.1088/1674-1137/41/3/030001 (Volltext). نسخة محفوظة 2019-11-30 على موقع واي باك مشين.
- ^ M. Zreda؛ وآخرون (1991). "Cosmogenic chlorine-36 production rates in terrestrial rocks". Earth and Planetary Science Letters. ج. 105 ع. 1–3: 94–109. Bibcode:1991E&PSL.105...94Z. DOI:10.1016/0012-821X(91)90123-Y.
- ^ M. Sheppard and M. Herod (2012). "Variation in background concentrations and specific activities of 36Cl, 129I and U/Th-series radionuclides in surface waters". Journal of Environmental Radioactivity. ج. 106: 27–34. DOI:10.1016/j.jenvrad.2011.10.015. PMID:22304997.
- ^ Chlorine - SAHRA, Arizona Board of Regents, 2005 (engl. نسخة محفوظة 2019-11-18 على موقع واي باك مشين.
- ^ Anita Quiles, Hélène Valladas, Hervé Bocherens, Emmanuelle Delqué-Količ, Evelyne Kaltnecker, Johannes van der Plicht, Jean-Jacques Delannoy, Valérie Feruglio, Carole Fritz, Julien Monney, Michel Philippe, Gilles Tosello, Jean Clottes, Jean-Michel Geneste: A high-precision chronological model for the decorated Upper Paleolithic cave of Chauvet-Pont d’Arc, Ardèche, France. In: PNAS. Band 113, Nr. 17, 26. April 2016, S. 4670–4675, doi:10.1073/pnas.1523158113.
- ^ ا ب ج د ه Greenwood and Earnshaw, pp. 800–4
- ^ ا ب Greenwood and Earnshaw, pp. 804–09
- ^ ا ب A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 436
- ^ Thomas Klapötke, I. C. Tornieporth-Oetting: Nichtmetallchemie. Wiley-VCH, Weinheim 1994, ISBN 3-527-29052-4, S. 397.
- ^ Robert L. Collin: The crystal structure of solid chlorine: correction. In: Acta Cryst. 9, 1956, S. 537, doi:10.1107/S0365110X56001467.
- ^ Robert L. Collin: The crystal structure of solid chlorine. In: Acta Cryst. 5, 1952, S. 431–432, doi:10.1107/S0365110X52001295.
- ^ Ulrich Müller: Anorganische Strukturchemie. 6. Auflage. Teubner, Stuttgart 2008, ISBN 978-3-8348-0626-0, S. 153.
- ^ موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
- ^ Greenwood and Earnshaw, pp. 853–56
- ^ Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 21–26.
- ^ Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 217–220.
- ^ Greenwood and Earnshaw, pp. 875–80
- ^ Greenwood and Earnshaw, pp. 835–42
- ^ ا ب M. Rossberg et al. "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a06_233.pub2
- ^ Gordon W. Gribble (1998). "Naturally Occurring Organohalogen Compounds". Acc. Chem. Res. ج. 31 ع. 3: 141–52. DOI:10.1021/ar9701777.
- ^ Gordon W. Gribble (1999). "The diversity of naturally occurring organobromine compounds". Chemical Society Reviews. ج. 28 ع. 5: 335–46. DOI:10.1039/a900201d.
- ^ K. Naumann: Chlorchemie in der Natur. In: Chemie in unserer Zeit. 27. Jahrg. Nr. 1, 1993, S. 33–41, doi:10.1002/ciuz.19930270105.
- ^ ا ب L. W. Haase, G. Gad: Über die Bestimmung von freiem Chlor in Wasser mit Hilfe von Dimethyl-p-phenylendiamin. In: Fresenius' Journal of Analytical Chemistry. 107, 1–2, 1936, S. 1–8, doi:10.1007/BF01388203.
- ^ G. Jander, E. Blasius, J. Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 136.
- ^ ا ب Chlorid. In: Römpp Online. Georg Thieme Verlag
- ^ M. Suzuki, T. Morita, T. Iwamoto: Diversity of Cl− channels. In: Cell Mol Life Sci. 63, (1), 2006, S. 12–24. PMID 16314923.
- ^ ا ب W. Kaim, B. Schwederski: Bioanorganische Chemie. 4. Auflage. Teubner, Wiesbaden 2005, ISBN 3-519-33505-0, S. 7-14.
- ^ Lavie، CJ؛ Crocker، EF؛ Key، KJ؛ Ferguson، TG (أكتوبر 1986). "Marked hypochloremic metabolic alkalosis with severe compensatory hypoventilation". South. Med. J. ج. 79 ع. 10: 1296–99. DOI:10.1097/00007611-198610000-00025. PMID:3764530.
- ^ Levitin، H؛ Branscome، W؛ Epstein، FH (ديسمبر 1958). "The pathogenesis of hypochloremia in respiratory acidosis". J. Clin. Invest. ج. 37 ع. 12: 1667–75. DOI:10.1172/JCI103758. PMC:1062852. PMID:13611033.
- ^ Cambier، C؛ Detry، B؛ Beerens، D؛ وآخرون (أكتوبر 1998). "Effects of hyperchloremia on blood oxygen binding in healthy calves". J. Appl. Physiol. ج. 85 ع. 4: 1267–72. DOI:10.1152/jappl.1998.85.4.1267. PMID:9760315.
- ^ Hans Ullrich Süss: Bleaching. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, دُوِي:10.1002/14356007.a04_191.pub2.
- ^ "Disinfection with chloramine". Centers for Disease Control and Prevention (CDC). Atlanta, Georgia, USA. مؤرشف من الأصل في 2019-01-20. اطلع عليه بتاريخ 2019-01-20.
- ^ Chlorung. In: Römpp Online. Georg Thieme Verlag
- ^ Reinhold Buttgereit: Die Chlorchemie auf dem Prüfstand – gibt es Alternativen? In: Spektrum der Wissenschaft. 1994, S. 108–113.
- ^ "Chlorine 295132". مؤرشف من الأصل في 2020-05-10.
- ^ "Facts About Chlorine". www.bt.cdc.gov. مؤرشف من الأصل في 2016-04-23. اطلع عليه بتاريخ 2016-04-12.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Winder, Chris (2001). "The Toxicology of Chlorine". Environmental Research. ج. 85 ع. 2: 105–14. Bibcode:2001ER.....85..105W. DOI:10.1006/enrs.2000.4110. PMID:11161660.
- ^ "Chlorine MSDS" (PDF). 1997-10-23. مؤرشف من الأصل (PDF) في 2007-09-26. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ NOAA Office of Response and Restoration, US GOV. "Chlorine". noaa.gov. مؤرشف من الأصل في 2015-10-15. اطلع عليه بتاريخ 2015-08-25.
- ^ ا ب "NIOSH Pocket Guide to Chemical Hazards #0115". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ "What's in your Water?: Disinfectants Create Toxic By-products". ACES News. College of Agricultural, Consumer and Environmental Sciences – University of Illinois at Urbana-Champaign. 31 مارس 2009. مؤرشف من الأصل في 2014-09-03. اطلع عليه بتاريخ 2009-03-31.
- ^ Richardson، Susan D.؛ Plewa، Michael J.؛ Wagner، Elizabeth D.؛ Schoeny، Rita؛ DeMarini، David M. (2007). "Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research". Mutation Research/Reviews in Mutation Research. ج. 636 ع. 1–3: 178–242. DOI:10.1016/j.mrrev.2007.09.001. PMID:17980649.
- ^ Berezow، Alex. "Why You Should Never Mix Different Drain Cleaners". Forbes. مؤرشف من الأصل في 2016-04-25. اطلع عليه بتاريخ 2016-04-12.
- ^ "Bleach Mixing Dangers : Washington State Dept. of Health". www.doh.wa.gov. مؤرشف من الأصل في 2016-04-14. اطلع عليه بتاريخ 2016-04-12.
- ^ Bertolini, Luca؛ Elsener, Bernhard؛ Pedeferri, Pietro؛ Polder, Rob B. (2004). Corrosion of steel in concrete: prevention, diagnosis, repair. Wiley-VCH. ص. 148. ISBN:978-3-527-30800-2. مؤرشف من الأصل في 2020-06-14.
- ^ Lewis, P.R. (1 يناير 2000). Polymer Product Failure. iSmithers Rapra Publishing. ص. 19–. ISBN:978-1-85957-192-7. مؤرشف من الأصل في 2013-05-10. اطلع عليه بتاريخ 2011-04-30.
- ^ ا ب "Chlorine: Product Datasheet" (PDF). Bayer MaterialScience AG. 21 أبريل 2008. مؤرشف من الأصل (PDF) في 2012-09-15. اطلع عليه بتاريخ 2013-12-17.
- ^ ا ب Sanders، Roy E. (2004). Chemical Process Safety: Learning from Case Histories, 3rd Revised edition. Oxford: Elsevier Science & Technology. ص. 92. ISBN:978-0-7506-7749-3.
روابط خارجية
[عدل]| في كومنز صور وملفات عن: كلور |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||









