معقد تناسقي

المركب التناسقي[1] أو المعقد التساندي[2][3] أو المتراكب التناسقي[4] في الكيمياء، هنالك فروع عديدة، منها الكيمياء التناسقية. تعد الكيمياء التناسقية إحدى أهم الفروع التي تهتم بدراسة المركبات التناسقية (المعقدات التناسقية)، ودراسة خواصها وتفاعلاتها. المعقد التناسقي، يعرف بأنه مركب يتكون من ذرة الفلز المركزي (شرط أن تكون هذه الذرة من العناصر الانتقالية الموجود في الركن d، وهو ثلاثة سلاسل، تحتوي على أوربيتال واحد فارغ أو أكثر)، وأيضًا تتكون من ليكاندات (جزيئات متعادلة الشحنة، مثل: الأمونيا، والماء، والايثلين ثنائي الأمين، أو أيونات مشحونة بالشحنة السالبة، مثل: الهالوجينات، منها الكلور، والفلور، والبروم وغيرها). ترتبط ذرة الفلز المركزي مع الأيونات أو الجزيئات بوساطة آصرة تعرف بالآصرة التناسقية، [5][6]
يعرف المجال من علم الكيمياء الذي يعني بدراسة هذا المركبات من حيث خواصها وطرق تحضيرها باسم الكيمياء التناسقية.
المجال الذي يحتويهم يسمى مجال التناسق (كرة التناسق)؛ الأيونات الموجودة خارج كرة التناسق تسمى بالأيونات المرافقة، التي تعادل شحنة المعقد التناسقي.
K3[Co(NH3)6]
في هذا المثال الإيضاحي، يعد الكوبلت: فلز الذرة المركزية، ويعد حامض لويس؛ يحتوي على أوربيتال واحد متاح (فارغ) أو أكثر.
الأمونيا: هي الليكاند، وهي جزيئة متعادلة الشحنة تحتوي على زوج إلكتروني وتعبر قاعدة لويس، بينما البوتاسيوم هو الأيون المرافق.
تسمية المعقدات التناسقية
[عدل]المركب التناسقي يتكون من كرة التناسق مع أيون المرافق عند التسمية حسب نظام الأيوباك، وهنالك خطوات يجب أتباعها:
أ- البحث عن الأيون الموجب: إذا كان أيون مرافق أضع اسم الأيون، أما إذا كان معقد؛ نكتب المقطع اللاتيني (ثلاثي، أو رباعي، أو خماسي...)، الذي يدل على عدد الليكاندات المتشابهة التي ترتبط مع الفلز المركزي أولًا، ثم اسم الليكاند مع إضافة المقطع «و» في نهاية الاسم، مثلًا سيانو، كلورو، فلورو... أما إذا كان هنالك أكثر من الليكاند تجري التسمية حسب الأبجدية، ثم اسم الفلز المركزي وعدد تأكسده أيضًا يعبر عنه بالمقاطع اللاتينية (إذا كان تأكسده أحادي I، أو ثنائي II، أو ثلاثي III...).
ب- الأيون السالب: إذا كان أيون مرافق أضع اسم الأيون، أما إذا كان معقد نكتب المقطع اللاتيني (ثلاثي، أو رباعي، أو خماسي...)، الذي يدل على عدد الليكاندات المتشابهة التي ترتبط مع الفلز المركزي أولًا، ثم اسم الليكاند مع إضافة المقطع «و» في نهاية الاسم، مثلًا سيانو، كلورو، فلورو... أما إذا كان هنالك أكثر من الليكاند تجري التسمية حسب الأبجدية، ثم اسم الفلز المركزي وإضافة المقطع «ات»، مثلًا: كرومات، أو كوبلتات، إلخ، وأيضًا إضافة عدد تأكسده.
ج- إذا كان الليكاند جزيئة ثنائية المخلب، مثلًا أثلين ثنائي أمين (en)، وهي جزيئة ثنائية المخلب تحتوي على جزيئتين أمين (NH2) كل جزيئة أمين تعطي ارتباط مع الذرة المركزية، في حال وجود أكثر من جزيئة من الأثلين ثنائي أمين، تجري إضافة المقاطع اللاتينية (bis ثنائي، tris ثلاثي، إلخ)
[NiCl4]-2 → tetrachloridonickelate(II) ion]
CuNH3Cl5]-3 → amminepentachloridocuprate(II) ion
[Cd(en)2(CN)2] → dicyanidobis(ethylenediamine)cadmium(II)
[Co(NH3)5Cl]SO4 → pentaamminechloridocobalt(III) sulfate
عدة أمثلة توضيحية على كيفية تسمية المعقدات.
الشكل الهندسي
[عدل]الشكل الهندسي للمعقد يعتمد على عدد الأواصر التي يرتبط بها الليكاند مع الفلز المركزي، هذا يسمى بعدد التناسق (عدد الليكاندات مضروبًا بعدد المزدوجات التي يحويها الليكاند). النظرية التي فسرت الشكل الهندسي هي نظرية التكافؤ للعالم بولنك، الذي فسر الشكل الهندسي للمعقد التناسقي، وأيضًا نوع التهجين.
| عدد التناسق | الشكل الهندسي | نوع التهجين | مثال على ذلك |
| ٢ | خطي | SP | [Ag(NH3)2] |
| ٤ | رباعي السطوح
مربع مستوي |
SP3
dSP2 |
[Zn(CN)4]-2
[Pt(NH3)2CI2] |
| ٥ | مثلث ثلاثي الهرم | dSP3 | [Mn(CO)4NO] |
| ٦ | ثماني السطوح | d2SP3
SP3d2 |
[Co(NH3)6]+3
[Ni(H2O)6]+2 |
التاريخ
[عدل]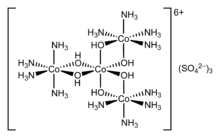
عرفت المعقدات قديماً مع بدء الكيمياء، ولكن طبيعتها لم تكن مفهومة على الإطلاق، فمثلاً الأزرق البروسي وكبريتات النحاس الثنائي كانت معروفة منذ القدم. إلا أن أهم تقدم في هذا المجال حدث عند اقتراح ألفرد فيرنر سنة 1893 أن الكوبالت الثلاثي Co(III) يحمل ستة ربيطات في شكل ثماني السطوح. وقد ساعدت نظريته على فهم الفرق بين التناسق والأيونية في المركبات كما هو الحال في أيون الكلوريد في معقد كلوريد أمين الكوبالت، وكذلك ساعدت على شرح العديد من المعقدات التي كانت عصية على التفسير.
تمكن فيرنر سنة 1914 من تقسيم أول معقد تناسقي، واسمه هكسول، إلى ايزومرات بصرية، مفنداً بذلك فكرة أن الكيرالية مرتبطة فقط بمركبات الكاربون.
بنية المعقدات التناسقية
[عدل]تسمى الذرات أو الأيونات أو الجزيئات المحيطة بالذرة المركزية بالربيطات، وترتبط هذه الربيطات بالذرة المركزية برابطة تساندية (منح مزدوج الكتروني إلى مدار فارغ في الفلز). هناك بعض المركبات العضوية مثل الألكينات حيث يمكن لرابطة باي فيها أن ترتبط تساندياً مع مدارات الفلز الفارغة، فعلى سبيل المثال يتساند الإيثيلين في معقد يعرف بملح زيس.
الشكل الهندسي
[عدل]يتم وصف الشكل الهندسي في الكيمياء التساندية بواسطة العدد التساندي وهو عدد الربيطات المتساندة مع الفلز (عدد الذرات المانحة بشكل أكثر تحديداً). عادة ما يمكن معرفة هذا العدد عن طريق عد الذرات الواهبة، ولكن في بعض الأحيان لا يعطي العد نتيجة صحيحة. تترواح الأعداد التساندية بين 2 و 9، أما الأعداد التساندية الأكبر فتكون شائعة في اللانثانات والأكتينات. ويعتمد عدد الروابط على الحجم، والشحنة، والترتيب الإلكتروني لأيون الفلز وللربيطة، وقد يمتلك الفلز الواحد أكثر من عدد تساندي واحد.
تفسر كيمياء المعقدات على أساس التداخل بين المدارات s و p الجزيئية في الربيطة، والمدار d في ايون الفلز. بمقدور مدارات s,p,d,f في الفلز حمل 18 الكترون، (قاعدة 18 إلكترون؛ ولعناصر القطاع f يتسع هذا الرقم إلى 32 الكترون). وبالتالي فإن أقصى عدد تساندي للفلز يرتبط بالترتيب الإلكتروني لأيون الفلز (أو عدد المدارات الفارغة) وبنسبة حجم الربيطات وأيونات الفلزات. فالفلز الكبير والربيطة الصغيرة يكونان عدداً تساندياً عالياً مثال [Mo(CN)8]4-، والفلز الصغير والربيطة الكبيرة يكونان عدداً تساندياً صغيراً مثل Pt[P(CMe3)]2. ونظراً لكبر حجم اللانثانات والأكتينات والعناصر الانتقالية المتأخرة فإنها تميل إلى امتلاك أعداد تساندية عالية.
وفيما يلي قائمة بالأشكال الهندسية الأكثر شيوعاً:
- الخطي (عدد تساندي 2).
- مثلث مستوي (عدد تساندي 3).
- رباعي السطوح أو مربع مستوي (عدد تساندي 4).
- ثنائي الهرم المثلثي أو هرم مربعي (عدد تساندي 5).
- ثماني السطوح أو الموشور المثلثي (عدد تساندي 6).
- ثنائي الهرم الخماسي (عدد تساندي 7).
- موشور متضاد مربعي (عدد تساندي 8).
- موشور مثلثي ثلاثي الرؤوس (عدد تساندي 9).
التماكب
[عدل]يكون ترتيب الربيطات حول الفلز في معقد معين ثابتاً، ولكن قد يتغير هذا الترتيب بسبب تفاعل يؤدي إلى تكوين متماكب آخر مستقر، وهناك أنواع مختلفة من التماكب في المعقدات التساندية، كما هو الحال في كثير من المركبات الأخرى.
التماكب الفراغي
[عدل]يحدث التماكب الفراغي لنفس الروابط في توجيهات مختلفة بالنسبة لبعضها البعض، ويمكن تقسيم التماكب الفراغي إلى:
تماكب مقرون ـ مفروق و fac-mer
[عدل]يحدث تماكب مقرون-مفروق في المعقدات ذات الشكل الهندسي ثماني السطوح والمربع المستوي ولا يحدث في المعقدات ذات الشكل رباعي السطوح. فعندما تتجاور ربيطتان متشابهتان يقال عنهما مقرون (cis) وعندما تتقابل ربيطتان متشابهتان يقال عنهما مفروق (trans). وعندما تشغل ثلاث ربيطات متماثلة أحد وجوه الشكل الثماني السطوح، يسمى المتماكب وجهي (fac) ، في هذا النوع من المتماكبات تكون كل ربيطتين متماثلتين مقرونتين لبعضهما البعض. وعندما تكون الربيطات الثلاثة المتماثلة وأيون الفلز في مستوى واحد يسمى المتماكب زوالي (mer) ويمكن اعتبار هذا المتماكب مزيجاً من المقرونات والمفروقات.
التماكب الضوئي
[عدل]يحصل التماكب الضوئي عندما لا تنطبق صورة المرآة لمركب معين عليه، ويدعى هذا التماكب بالضوئي لأن هذه المتماكبات فعالة ضوئياً أي أنها تدور الضوء المستقطب. يستخدم الرمز Λ كسابقة لوصف المعقد اليساري المتكون من ارتباط ثلاث ربيطات ثنائية السن، ويستخدم الرمز Δ كسابقة لوصف المعقد اليميني.
-
Λ-[Fe(ox)3]3−
-
Δ-[Fe(ox)3]3−
-
Δ-cis-[CoCl2(en)2]+
التماكب البنيوي
[عدل]يحدث التماكب البنيوي عندما تكون الروابط مختلفة، فمثلاً تماكب الارتباط هو أحد الأنواع المتعددة للتماكب البنيوي في المعقدات التساندية (كما هو الحال في المركبات الأخرى)، يحصل تماكب الارتباط مع الربيطات مختلفة السن والتي يمكن أن ترتبط بالفلز من أكثر من جهة واحدة، فعلى سبيل المثال، NO2 ليكاند مختلف السن وبمقدوره الارتباط مع الفلز عن طريق ذرة N أو ذرة O.
تسمية المعقدات
[عدل]يمكن تلخيص القواعد الأساسية للتسمية بما يلي:
- عند تسمية أيون معقد، تسمى الربيطات قبل تسمية الفلز.
- تكتب أسماء الربيطات حسب التسلسل الأبجدي (لا تؤثر اللواحق العددية على الترتيب).
- تضاف سابقة إلى الربيطات المتماثلة المتكررة تعبر عن عدد تكرر هذه الربيطات: ثنائي (-di)، أو ثلاثي (-tri)، أو رباعي (-tetra)، أو خماسي (-penta)، أو سداسي (-hexa)، أو سباعي (-hepta)، أو ثماني (-octa)، أو تساعي (-nona)، أو عشاري (-deca)، أو اثنا عشري (-dodeca)، أما في الربيطات متعددة السن تضاف إليها السوابق: مضاعف (بيس -bis) أو مثالث (تريس -tris) أو مرابع (تتراكيس -teterakis) أو مخامس (بنتاكيس -pentakis) وهكذا.
- عادة ما تنتهي الربيطات الأنيونية بالمقطع o، فتحول sulfate إلى sulfato.
- تسمى الربيطات المتعادلة بأسمائها الاعتيادية، عدا بعض الاستثناءات: NH3 تصبح ammine، و H2O تصبح aqua، و CO تصبح carbonyl، و NO تصبح nitrosyl.
- يكتب اسم الفلز، وإذا كان المعقد أنيونياً تضاف اللاحقة ate، ويستخدم الاسم اللاتيني للفلز إن وجد (عدا الزئبق).
- يعبر عن حالة التأكسد للذرة المركزية بعدد لاتيني بين قوسين.
- يسمى الكتيون يليه الأنيون مفصولين بفاصلة.
وفيما يلي بعض الأمثلة:
- [NiCl4]2− → tetrachloridonickelate(II) ion
- [CuNH3Cl5]3− → amminepentachloridocuprate(II) ion
- [Cd(en)2(CN)2] → dicyanidobis(ethylenediamine)cadmium(II)
- [Co(NH3)5Cl]SO4 → pentaamminechloridocobalt(III) sulfate
ويشار إلى العدد التساندي للربيطات التي ترتبط بأكثر من فلز واحد (ربيطات جسرية) يشار إليه برقم أسفل الرمز الإغريقي μ قبل اسم الربيطة. يرمز لثنائي الوحدات لكلوريد الألمنيوم Al2Cl4(μ2-Cl)2.
المغناطيسية
[عدل]إحدى الصفات التي يتميز بها المعقد التناسقي، عند ملأ الأوربيتالات بإلكترونيات يجري الملأ أفرادًا، ثم يجري الازدواج، إذ يُملئ الأوربيتال الواحد بإلكترونين. ذرة الفلز المركزي يتم ملئ أوربيتال d بعدد من الإلكترونات وأيضًا الليكاندات، لو وجد إلكترون واحد مفرد في الأوربيتال سوف يطلق على هذا المعقد باسم البارا مغناطيس؛ أما إذا تم ملء الأوربيتالات بإلكترونات ولم نجد الكترون مفرد سوف يطلق على هذا المعقد باسم الدايا مغناطيس.
عالية الدوران أو منخفضة الدوران: هذه الصفة تخصص للمعقدات التناسقية الداخلية، والخارجية. يكون المعقد داخلي عندما يكون ترتيب الاغلفة:
(d (n-1) nS nP
منها معقدات ثمانية السطوح d2SP3، تسمى بالمعقدات الداخلية تتميز بقوة جذب النواة للإلكترونات عالية، وصعوبة في فقد الإلكترونات، وطاقة التأين عالية جدًا، بالتالي تكون مستقرة جدًا لهذا الأسباب المتعددة تكون ذات دورانية عالية. إما المعقدات الخارجية يكون ترتيب الأغلفة:
nS nP d (n-1)
منها معقدات ثمانية السطوح SP3d2، تسمى بالمعقدات الخارجية تتميز بقوة جذب النواة للإلكترونات واطئة، وسهولة في فقدان إلكترونات، وطاقة التأين واطئة، تكون بعيدة عن نواة الذرة المركزية، بالتالي تكون ذات دورانية منخفضة.
طالع أيضاً
[عدل]المراجع
[عدل]- ^ مقرر جامعة الكوفة نسخة محفوظة 13 ديسمبر 2016 على موقع واي باك مشين. [وصلة مكسورة]
- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 108، OCLC:931065783، QID:Q113378673
- ^ الموسوعة العربية نسخة محفوظة 07 نوفمبر 2017 على موقع واي باك مشين.
- ^ مجمع القاهرة - مجموعة المصطلحات العلمية والفنية - المجلد الرابع عشر - سنة اثنين وسبعين ميلادية
- ^ IUPAC definition of complex نسخة محفوظة 18 فبراير 2017 على موقع واي باك مشين.
- ^ IUPAC definition of coordination entity نسخة محفوظة 14 أكتوبر 2016 على موقع واي باك مشين.

![cis-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/132px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/150px-Trans-dichlorotetraamminecobalt%28III%29.png)
![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/136px-Mer-trichlorotriamminecobalt%28III%29.png)
![Λ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Δ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Λ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![Δ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)