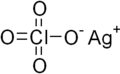بيركلورات الفضة
المظهر
| بيركلورات الفضة | |
|---|---|
| الاسم النظامي (IUPAC) | |
Silver perchlorate |
|
| المعرفات | |
| CAS | 7783-93-9 |
| بوب كيم | 24562 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | AgClO4 |
| الكتلة المولية | 207.32 غ/مول |
| المظهر | صلب عديم اللون |
| الكثافة | 2.81 غ/سم3 |
| نقطة الانصهار | 486 °س (يتفكك) |
| الذوبانية في الماء | 557 غ/100 مل ماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
بيركلورات الفضة مركب كيميائي صيغته AgClO4، وهو قابل للاسترطاب بشكل كبير وغالباً ما يكون على شكل أحادي هيدرات AgClO4·H2O على هيئة بلورات عديمة اللون.
التحضير
يحضر المركب من تفاعل حمض البيركلوريك مع أكسيد الفضة الأحادية[2] حسب التفاعل:
الخواص
يوجد المركب في الشروط القياسية على شكل بلورات عديمة اللون قابلة للتسيل بسبب قابلية الاسترطاب المرتفعة، ويوجد غالباً على شكل أحادي هيدرات، وهو جيد الانحلالية في الماء؛ كما أنه قادر أيضاً على الذوبان في المذيبات العضوية مثل البنزين والتولوين؛[3] وتميل الفضة في تلك المذيبات العضوية إلى الارتباط مع الأرينات كما أظهرت دراسة البلورات بالأشعة السينية.[4][5]
يعد المركب من المؤكسدات القوية.
الاستخدامات
يستخدم المركب على نطاق محدود في مجال التحفيز في الكيمياء العضوية.
المراجع
- ^ ا ب ج 7783-93-9 (بالإنجليزية), QID:Q278487
- ^ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 997
- ^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 1016.
- ^ E. A. Hall Griffith؛ E. L. Amma (1974). "Metal Ion-Aromatic Complexes. XVIII. Preparation and Molecular Structure of Naphthalene-Tetrakis(silver perchlorate) Tetrahydrate". Journal of the American Chemical Society. ج. 96 ع. 3: 743–749. DOI:10.1021/ja00810a018.
- ^ R. K. McMullan؛ T. F. Koetzle؛ C. J. Fritchie Jr. (1997). "Low-Temperature Neutron Diffraction Study of the Silver Perchlorate–Benzene π Complex". Acta Crystallographica B. ج. 53 ع. 4: 645–653. DOI:10.1107/S0108768197000712.