تثبيت النيتروجين

تثبيت النيتروجين[1] (بالإنجليزية: Nitrogen fixation) هو العملية التي يتحول فيها النيتروجين (N2) الموجود في الجو إلى أمونيوم[2] النيتروجين الجوي أو النيتروجين الجزيئي (N2) هو خامل نسبياً: فلا يتفاعل مع مواد كيميائية أخرى مولداً مركبات جديدة. تقوم عملية تثبيت النيتروجين على تحويله من الشكل الثنائي (N2) حتى يستخدم بطرق أخرى.
تثبيت النيتروجين الطبيعي والصناعي هو جوهري لجميع أشكال الحياة لأنه ضروري للتكوين البيولوجي لكتل البناء الأساسية في النباتات والحيوانات وغيرها من أشكال الحياة. مثلا: النوكليوتيدات والحمض النووي والحموض الأمينية للبروتينات. لذا فإن تثبيت النيتروجين هام للزراعة وصناعة الأسمدة. كما أنه هام في صناعة المتفجرات (مثل البارود والديناميت والتي إن تي). يحدث تثبيت النيتروجين بشكل طبيعي عند حدوث البرق.[3][4]
كما يشير تثبيت النيتروجين إلى تحويلات حيوية أخرى للنيتروجين، كتحويله إلى ثنائي أكسيد النيتروجين. الميكروبات التي بإمكانها تثبيت النيتروجين هي بدائيات النوى (بكتيريا وعتائق معاً موزعين في ممالكهم الخاصة) تدعى دايازتروف. طورت بعض النباتات والحيوانات (مثل أرضة) علاقة تعايش مع الدايازتروف.
التثبيت الحيوي للنيتروجين[عدل]
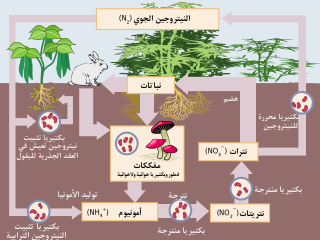
اكتشف التثبيت الحيوي للنيتروجين كل من المهندس الزراعي الألماني هيرمان هيلريغل وعالم الميكروبات الهولندي مارتينوس بايرينك. يحدث التثبيت الحيوي للنيتروجين (BNF) عندما يتحول النيتروجين الجوي إلى أمونيا عن طريق أنزيمات النيتروجيناز.[2] وتفاعل التثبيت الحيوي للنيتروجين هو:
- N2 + 8 H+ + 8 e− → 2 NH3 + H2
العملية مقرونة بحلمهة 16 مكافئ من ثلاثي فوسفات الأدينوسين ويرافقها تشكل جزيء H2. في الدايازتروف التي تعيش بشكل حر تهضم الأمونيا التي ولدها النيتروجيناز إلى غلوتامات عن طريق أنزيم غلوتامين سينثيتاز.
الجينات الميكروبية المطلوبة لتثبيت النيتروجين موزعة على نطاق عريض في البيئات المتنوعة.[5][6]
الأنزيمات المسئولة عن عمل النيتروجيناز حساسة جداً للتخريب بالأوكسيجين. كثير من البكتيريا تتوقف عن إنتاج الأنزيمات في وجود الأوكسيجين.[2] توجد الكثير من أحياء تثبيت النيتروجين فقط في ظروف لا هوائية، وتتنفس لإنقاص معدلات الأوكسيجين، أو تربطة ببروتين مثل ليغيموغلوبين.[2]
الميكروبات التي تثبت النيتروجين[عدل]
الدايازتروفات هي زراقم مثل التريكوديزميوم والخضربيات والآزوتيات والريزوبيا والفرانكيا.
تعيش الزراقم تقريباً في جميع البيئات المضائة وتلعب دوراً رئيسياً في دورة الكربون والنيتروجين في غلاف الأرض الحيوي. بشكل عام فيمكن للزراقم الاستفادة من مصادر متنوعة عضوية وغير عضوية من مركبات النيتروجين، مقل النيترات أو النتريت أو الأمونيوم أو اليوريا أو بعض الحموض الأمينية. ويمكن لبعض سلالات الزراقم تحقيق نمو دايازتروفي، وهي إمكانية كانت موجودة في آخر الأسلاف المعروفين للعتائق[7]
يمكن للزراقم في الشعاب المرجانية أن تثبت ضعف كمية النيتروجين على اليابسة، حيث يتم تثبيت حوالي 1.8 كغ من النيتروجين لكل هيكتار في اليوم. يعتقد أن الزراقم البحرية الاستعمارية التريكوديزميوم تثبت النيتروجين يعادل نصف النيتروجين المثبت في الأنظمة البحرية على مستوى العالم.[8]
تعايش العقد الجذرية[عدل]
فصيلة البقليات[عدل]
فصيلة البقليات هي من النباتات التي تشارك في تثبيت النيتروجين – بقوليات - أصناف من النفل وفول الصويا والبرسيم الحجازي والترمس والفول السوداني وKudzu وRooibos. حيث تحتوي على بكتيريا تعايشية تسمى ريزوبيا في عقد على جذورها، تنتج مركبات نيتروجينية تساعد النبات على النمو منافسة النباتات الأخرى. يتحرر النيتروجين عندما يموت النبات، مما يجعله متوافراً للنباتات الأخرى ويساعد في تسميد التربة.[2][9] معظم البقليات لديها هذا الارتباط، باستثناء بعض الأجناس مثل (Styphnolobium). في الزراعة العضوية والتقليدية يتم تدوير الحقول على عدة أنواع من المحاصيل، والتي عادة ما تتضمن النفل أو الحنطة السوداء (فصيلة البطباطية الغير بقلية) والتي تدعى أحياناً بالسماد الأخضر.
تعتمد الزراعة في أزقة الأنغا على الجنس البقولي إنغا، وهي شجرة استوائية صغيرة قاسية الأوراق مثبتة للنيتروجين.[10]
غير البقليات[عدل]

بالرغم من أن الغالبية العظمى من النباتات المثبتة للنيتروجين عن طريق العقد الجذرية هي من الفصيلة البقولية، إلا أنه يوجد بعض الاستثنائات:
- Parasponia، هي جنس استوائي من الفصيلة القنبية يمكنها التفاعل مع بكتيريا الريزوبيا مشكلة عقد مثبتة للنيتروجين[11]
- النباتات شعاعية الجذر: مثل النغت والشمعاء (Myrica) يمكنها تشكيل عقد مثبتة للنيتروجين، بفضل العلاقة التعايشية مع بكتيريافرانكيا. تنتمي هذه النباتات إلى 25 جنس[12] موزعة على 8 فصائل نباتية.
قابلية تثبيت النيتروجين نادرة الوجود في هذه الفصائل. فمثلاً، 4 فقط من بين 122 جنس في الفصيلة الوردية يمكنها صنع النيتروجين. كل هذه الفصائل تنتمي إلى رتبة القرعيات والتي تشكل مع البلوطيات والورديات والفوليات فرع (eurosids). وفي هذا الفرع فإن الفوليات هي أول نسل يتفرع.
| الفصيلة: الجنس |
خلافية :
|
|
|
كما أن هناك عدة علاقات تعايش مثبتة للنيتروجين تستخدم الزراقم (مثل نوستك):
- بعض الأشنات مثل Lobaria وPeltigera
- سرخس البعوض (أنواع أزولا)
- Cycads
- جونيرة
- نباتات زهقرنية
التثبيت الصناعي للنيتروجين[عدل]
تم اكتشاف قابلية النيتروجين للتفاعل مع بعض المركبات للمرة الأولى على يد (Desfosses) في عام 1828. حيث لاحظ أن خليط الكربون مع أكاسيد المعادن القلوية يتفاعل مع النيتروجين عند درجات الحرارة العالية. في عام 1860 طور Margueritte وSourdeval العملية الأولى المستخدمة تجارياً باستخدام كربونات الباريوم كمادة بادئة. حيث يمكن مفاعلة سيانيد الباريوم الناتج مع البخار معطياً الأمونيا. في عام 1898 فصل Adolph Frank وNikodem Caro العملية حيث قاموا أولاً بإنتاج كربيد الكالسيوم ثم فاعلوه في خطوة لاحقة مع النيتروجين معطياً سياناميد الكالسيوم. اكتشفت عملية أوستوالد لإنتاج حمض الآزوت عام 1902. وسيطرت عملية فرانك-كارو وعملية أوستوالد على صناعة تثبيت النيتروجين حتى اكتشاف عملية هابر-بوش في عام 1909.[13][14] قبل 1900، اختبر نيكولا تسلا الإنتاج الصناعي للنيتروجين «باستخدام تيارات كهربائية ذات ترددات عالية جداً».[15][16]
انظر أيضاً[عدل]
- عملية بيركلاند-إيد: عملية إنتاج للأسمدة الصناعية.
- نزع النيتروجين: عملية عضوية لتحرير النيتروجين.
- النترجة: الإنتاج البيولوجي للنيتروجين.
- دورة النيتروجين: سير وتحول النيتروجين في البيئة.
- نيتروجيناز: أنزيم تستخدم بعض الأحياء لتثبيت النيتروجين.
- جورج واشنطن كارفر: عالم النبات الأمريكي
- نيتروجيناز: إنزيمات تستخدمها الكائنات الحية لإصلاح النيتروجين
- عملية أوستفالد: عملية كيميائية لصنع حامض النيتريك HNO3
المراجع[عدل]
- ^ المعجم الموحد لمصطلحات علم الأحياء، سلسلة المعاجم الموحدة (8) (بالعربية والإنجليزية والفرنسية)، تونس: مكتب تنسيق التعريب، 1993، ص. 144، OCLC:929544775، QID:Q114972534
- ^ أ ب ت ث ج Postgate, J. (1998). Nitrogen Fixation, 3rd Edition. Cambridge University Press, Cambridge UK.
- ^ Slosson، Edwin (1919). Creative Chemistry. New York: The Century Co. ص. 19–37. مؤرشف من الأصل في 2022-05-06.
- ^ Biological Sciences | The University of Edinburgh نسخة محفوظة 16 يناير 2013 على موقع واي باك مشين.
- ^ Gaby, J.C.; Buckley, D.H. (2011). "A global census of nitrogenase diversity". Environmental Microbiology. ج. 13 ع. 7: 1790–1799. DOI:10.1111/j.1462-2920.2011.02488.x.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Hoppe, B.; Kahl, T.; Karasch, P.; Wubet, T.; Bauhus, J.; Buscot, F.; Krüger, D. (2014). "Network analysis reveals ecological links between N-fixing bacteria and wood-decaying fungi". PLoS ONE. ج. 9 ع. 2: e88141. DOI:10.1371/journal.pone.0088141.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "The evolution of nitrogen fixation in cyanobacteria" N. Latysheva, V. L. Junker, W. J. Palmer, G. A. Codd and D. Barker; Bioinformatics; 2012: 28(5) pp 603–606; (Article) دُوِي:10.1093/bioinformatics/bts008
- ^ Bergman, B.; Sandh, G.; Lin, S.; Larsson, H.; and Carpenter, E. J. (2012). "Trichodesmium – a widespread marine cyanobacterium with unusual nitrogen fixation properties". FEMS Microbiology Reviews. ج. 37 ع. 3: 1–17. DOI:10.1111/j.1574-6976.2012.00352.x.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Smil, V (2000). Cycles of Life. Scientific American Library.
- ^ Elkan, Daniel. "Slash-and-burn farming has become a major threat to the world's rainforest". The Guardian, 21 April 2004.
- ^ Op den Camp، Rik؛ Streng، A.؛ وآخرون (2010). "LysM-Type Mycorrhizal Receptor Recruited for Rhizobium Symbiosis in Nonlegume Parasponia". Science. ج. 331 ع. 6019: 909–912. DOI:10.1126/science.1198181.
- ^ Dawson، J. O. (2008). "Ecology of actinorhizal plants". Nitrogen-fixing Actinorhizal Symbioses. Springer. ج. 6. ص. 199–234. DOI:10.1007/978-1-4020-3547-0_8.
- ^ Nevbner، Rolf (1934). "Die Umwandlungsgleichung Ba(Cn)2 → BaCN2 + C Im Temperaturgebiet von 500 Bis 1000 °C". Zeitschrift für Elektrochemie und angewandte physikalische Chemie. ج. 40 ع. 10: 693–698. DOI:10.1002/bbpc.19340401005.
{{استشهاد بدورية محكمة}}: الوسيط|الأول1=يفتقد|الأخير1=(مساعدة)، الوسيط غير المعروف|doi_inactivedate=تم تجاهله (مساعدة)، وعمود مفقود في:|الأول1=(مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ Curtis، Harry Alfred (1932). Fixed nitrogen. مؤرشف من الأصل في 2014-11-29.
- ^ "The Problem of Increasing Human Energy" by Nikola Tesla نسخة محفوظة 22 أكتوبر 2006 على موقع واي باك مشين.
- ^ THE PROBLEM OF INCREASING HUMAN ENERGY
| تثبيت النيتروجين في المشاريع الشقيقة: | |
| |
