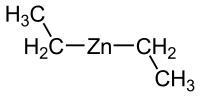ثنائي إيثيل الزنك
| ثنائي إيثيل الزنك | |
|---|---|
| الاسم النظامي (IUPAC) | |
diethylzinc |
|
| المعرفات | |
| رقم CAS | |
| CAS | 557-20-0 |
| بوب كيم | 101667988 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C4H10Zn |
| الكتلة المولية | 123.51 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.21 غ/سم3 |
| نقطة الانصهار | −28 °س |
| نقطة الغليان | 117 °س |
| الذوبانية في الماء | يتفاعل |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثنائي إيثيل الزنك هو مركب عضوي للزنك صيغته C4H10Zn، والتي يمكن أن تكتب على الشكل المفصل Zn(C2H5)2 ويوجد على هيئة سائل عديم اللون.
التحضير[عدل]
كان إدوارد فرانكلاند أول من تمكن من تحضير هذا المركب، سنة 1848، وذلك من تفاعل عنصر الزنك مع يودو الإيثان (يوديد الإيثيل).[3][4]
بأسلوب آخر، يمكن تحضير هذا المركب من تفاعل ثلاثي إيثيل الألومنيوم مع كلوريد الزنك:[5]
الخواص[عدل]
يوجد هذا المركب في الشروط القياسية على هيئة سائل عديم اللون، وهو مركب نشط كيميائياً ويتفاعل بعنف مع الماء. في الطور الصلب يتبلور المركب وفق نظام بلوري رباعي.[6]
الاستخدامات[عدل]
يستخدم هذا المركب في مجال الاصطناع العضوي في مختبرات البحث العلمي.[7]
المراجع[عدل]
- ^ أ ب ت CID101667988 (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ E. Frankland (1850). "On the isolation of the organic radicals". Quarterly Journal of the Chemical Society. ج. 2 ع. 3: 263–296. DOI:10.1039/QJ8500200263. مؤرشف من الأصل في 2023-06-04.
- ^ Dietmar Seyferth (2001). "Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry". Organometallics. ج. 20 ع. 14: 2940–2955. DOI:10.1021/om010439f.
- ^ Michael J. Krause, Frank Orlandi, Alfred T. Saurage, Joseph R. Zietz Jr., "Aluminium Compounds, Organic" (in German), Ullmann’s Encyclopedia of Industrial Chemistry (Weinheim: Wiley-VCH), doi:10.1002/14356007.a01_543
- ^ John Bacsa؛ Felix Hanke؛ Sarah Hindley؛ Rajesh Odedra؛ George R. Darling؛ Anthony C. Jones؛ Alexander Steiner (2011). "The Solid State Structures of Dimethylzinc and Diethylzinc". Angewandte Chemie International Edition. ج. 50 ع. 49: 11685–11687. DOI:10.1002/anie.201105099. PMC:3326375. PMID:21919175.
- ^ Klaus Stingl, Jürgen Martens, "Synthesis of chiral Catalysts for the enantioselective Addition of Diethylzinc to aromatic Aldehydes" (in German), Synth. Commun. 22: pp. 2745-2756, doi:10.1080/00397919208021539
| ثنائي إيثيل الزنك في المشاريع الشقيقة: | |
| |