ورم عصبي ليفي من النوع الأول
| الورم العصبي الليفي من النوع الأول | |
|---|---|
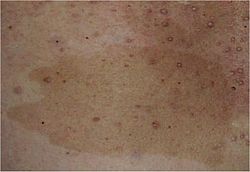
Café au lait spot characteristic of NF1.
| |
| معلومات عامة | |
| الاختصاص | علم الوراثة الطبية، وطب الجهاز العصبي[1] |
| من أنواع | ورام ليفي عصبي، ومرض |
| الوبائيات | |
| انتشار المرض | |
| تعديل مصدري - تعديل | |
الورم العصبي الليفي من النوع الأول (بالإنجليزية: Neurofibromatosis type I)أو ما يعرف أيضا بمرض فون ريكلنغهاوزن (von Recklinghausen disease ) وهو مرض وراثي يصيب شخص واحد من بين 3000 شخص . وأول من شرح هذه الحالة هو الطبيب الألماني فريدرش دانيل فون ركلينغهاوزن في عام 1882. لذلك سمي هذا المرض باسمه.
العلامات والأعراض
[عدل]فيما يلي قائمة بالحالات والمضاعفات المرتبطة بالورم العصبي الليفي من النوع الأول -وحيثما أتيح- النطاق العمري للظهور والتطور التدريجي ونسبة حدوث الورم العصبي الليفي من النوع الأول، وطريقة التشخيص المبكر، والعلاجات والتخصصات الطبية ذات الصلة. يكون تطور الحالة كالتالي:[3][4]
- قد تكون الاضطرابات العضلية الهيكلية الخلقية موجودة أو غير موجودة
- يمكن ملاحظة الحالات الجلدية في الطفولة المبكرة
- قد تظهر أورام صغيرة في الشبكية يمكن أن تؤدي في النهاية إلى العمى. بالإضافة إلى ذلك، قد تنمو عقيدات على القزحية، لكنها غير ضارة.
- قد تظهر صعوبات التعلم في الأطفال ما قبل المدرسة
- قد تحدث الأورام الليفية العصبية ويمكن أن تسبب أحيانًا العديد من الحالات العصبية والتشوه الجلدي والهيكل العظمي.
- قد يحدث الاكتئاب والقلق الاجتماعي نتيجة للإعاقات التي تسببها الحالة
- قد تتطور الأورام الليفية العصبية -في 8-13% من الحالات- إلى السرطان، والذي يمكن أن يكون مهددًا للحياة[5]
يحتفظ برنامج الورم العصبي الليفي السريري في مستشفى سانت لويس للأطفال بقائمة شاملة من الدراسات البحثية الحالية للورم العصبي الليفي.
اضطراب الجهاز العضلي الهيكلي
[عدل]تشتمل التشوهات العضلية الهيكلية التي تؤثر على الجمجمة على خلل التنسج العظمي الوتدي، واستسقاء الرأس الخلقي والضعف العصبي المصاحب. هذه التشوهات غير تقدمية ويمكن تشخيصها في الجنين أو عند الولادة.
تشتمل الاضطرابات التي تصيب العمود الفقري على ما يلي:
- في الورم العصبي الليفي من النوع الأول، يمكن أن يكون هناك خلل عام في الأنسجة الرخوة في الجنين، والذي يشار إليه باسم خلل تنسج الأديم المتوسط، ما يؤدي إلى سوء نمو الهياكل الهيكلية.
- القيلة السحائية وتشكيل الرتج الكيسي لجافية العمود الفقري، لا علاقة لها بالسنسنة المشقوقة (تشقق العمود الفقري).
- إشعاعيًا، يمكن أن يؤدي توسع الجافية إلى التقوقع في الأجسام الفقرية الخلفية وتشكيل الرتج الكيسي في الجافية من العمود الفقري. قد يؤدي هذا إلى فقدان مؤقت أو دائم لوظيفة استشعار الأطراف السفلية.[6]
- يعد الجنف البؤري و/أو الحداب أكثر مظاهر الهيكل العظمي شيوعًا للورم العصبي الليفي من النوع الأول، ويحدثان في 20% من المرضى المصابين. يحتاج ما يقرب من 25% من المرضى إلى جراحة تصحيحية.
ضعف العضلات والهيكل العظمي وعجز التحكم الحركي
جرى التعرف على أوجه القصور في الوظيفة الحركية في الورم العصبي الليفي من النوع الأول منذ فترة طويلة، وقد عُزيت تاريخيًا إلى اختلال وظيفي في الأعصاب. ومع ذلك -في السنوات الأخيرة- تشير الدراسات إلى ارتباط الورم العصبي الليفي من النوع الأول بمشكلة أساسية في وظيفة العضلات (اعتلال عضلي).[7]
تشمل النتائج السريرية لدى الأشخاص المصابين بالورم العصبي الليفي من النوع الأول ما يلي:
- انخفاض حجم العضلات والهيكل العظمي
- انخفاض القدرة على ممارسة الرياضة
- ضعف العضلات (تشير أحدث الدراسات إلى انخفاض قوة عضلات الأطراف العلوية والسفلية بنسبة 30-50% لدى الأطفال الورم العصبي الليفي من النوع الأول مقارنة بالضوابط المتطابقة).[8]
أكدت الدراسات التي أجريت على الفئران المعدلة وراثيًا حتى الآن أن جين الورم العصبي الليفي من النوع الأول حيوي لنمو العضلات الطبيعي والتمثيل الغذائي. الضربة القاضية لجين الورم العصبي الليفي من النوع الأول في العضلات أنه يؤدي إلى استقلاب الدهون غير المنظم وضعف العضلات.[7][9]
يعد الورم العصبي الليفي من النوع الأول مرضًا في عائلة الأمراض اعتلالات RA، والتي تشمل متلازمة كوستيلو، ومتلازمة نونان، ومتلازمة القلب والأوعية الدموية. كما تظهر اعتلالات RA مع ضعف العضلات والهيكل العظمي. من المحتمل أن يرتبط ضعف وظيفة العضلات في هذه الاضطرابات بإشارة Ras/MAPK المتغيرة، ومع ذلك، تبقى الآليات الجزيئية الدقيقة غير معروفة.[10]
عظام وأطراف الوجه
[عدل]- انحناء العظم الطويل مع الميل إلى الكسر وعدم الالتئام، ما يؤدي إلى داء مفصلي كاذب. أكثر العظام المتأثرة شيوعًا هي عظمة القصبة، ما يتسبب في داء المفصل الكاذب الخلقي في القصبة أو CPT. يحدث CPT في 2-4% من الأفراد المصابين بالورم العصبي الليفي من النوع الأول. يشمل العلاج بتر الأطراف أو التصحيح بطريقة إليزاروف كأسلوب استبقاء الأطراف.
- تشوه في عظام الوجه أو تجاويف العين (عيوب الدرز اللامي، خلل التنسج الوتدي)
- فرط نمو أحد الأطراف من جانب واحد. عندما يظهر الورم الليفي العصبي الضفيري على الساق أو الذراع، ويتسبب في زيادة الدورة الدموية، وبالتالي قد يسرع من نمو الطرف. قد يتسبب هذا في اختلاف كبير في الطول بين الأطراف اليمنى واليسرى. لموازنة الاختلاف أثناء الطفولة، هناك جراحة تقويمية تسمى فصل المشاشية، حيث يتوقف النمو في صفيحة المشاشية (النمو). يمكن إجراؤها على جانب واحد من العظم للمساعدة في تصحيح التشوه الزاوي، أو على كلا الجانبين لإيقاف نمو هذا العظم تمامًا. يجب أيضًا التخطيط للجراحة بعناية فيما يتعلق بالتوقيت، حيث لا يمكن عكسها. الهدف هو أن تكون الأطراف متساوية الطول في نهاية النمو.
الجلد
[عدل]- الآفات المسطحة المصطبغة على الجلد تسمى بقع café au lait (بقع القهوة بالحليب)، وهي آفات شديدة التصبغ قد تختلف في اللون من البني الفاتح إلى البني الداكن. وهذا ما ينعكس في اسم الشرط الذي يعني القهوة بالحليب. قد تكون الحدود سلسة أو غير منتظمة. يمكن أن تنمو هذه البقع منذ الولادة ويمكن أن تستمر في النمو طوال حياة الشخص. يمكن أن تزداد في الحجم والأعداد خلال فترة البلوغ وأثناء الحمل. وهي موجودة في حوالي 99% من المرضى من أصل أوروبي وفي حوالي 93% من المرضى من أصل هندي.[11]
- نمش الإبط أو المناطق الأربية.
- يتجلى الورم الليفي العصبي الجلدي على شكل نتوءات مطاطية أحادية أو متعددة بأحجام مختلفة على جلد الشخص. سن بداية البلوغ. تقدمية في العدد والحجم. ليست خبيثة. يمكن علاجه بليزر ثاني أكسيد الكربون أو إزالته بواسطة جراح تجميل متخصص في الورم العصبي الليفي من النوع الأول.[12][13]
أمراض العين
[عدل]- عقيدات (ليش) في القزحية.
- يمكن أن يسبب الورم الدبقي البصري على طول أحد أو كلا العصب البصري أو التصالب البصري جحوظًا وحركة لا إرادية للعين، و/أو التحديق، و/أو فقدان الرؤية. قد يشمل العلاج الجراحة أو الإشعاع +/- الستيرويدات أو العلاج الكيميائي (عند الأطفال).[14]
اضطراب النمو السلوكي العصبي
[عدل]المضاعفات الأكثر شيوعًا في مرضى الورم العصبي الليفي من النوع الأول هي الإعاقة الإدراكية والتعلمية. وقد ثبت أن هذه المشكلات المعرفية موجودة في حوالي 90% من الأطفال والبالغين المصابين بالورم العصبي الليفي من النوع الأول ولها آثار كبيرة على تعليمهم وحياتهم اليومية. وقد ثبت أن هذه المشاكل المعرفية مستقرة في مرحلة البلوغ بشكل رئيسي في منتصف العشرينات إلى أوائل الثلاثينيات ولا تزداد سوءًا على عكس بعض الأعراض الجسدية الأخرى للورم العصبي الليفي من النوع الأول. المشاكل المعرفية الأكثر شيوعًا هي الإدراك والوظيفة التنفيذية والانتباه. تشتمل الاضطرابات على:[15]
- يعاني ما يقرب من 42% من الأطفال المصابين بمرض الورم العصبي الليفي من النوع الأول من أعراض التوحد، 36.78% منهم حالات شديدة، و33.33% منهم حالات خفيفة إلى متوسطة، و29.89% منهم يعانون من أعراض التوحد واضطراب فرط الحركة ونقص الانتباه.[16]
- تبين أن اضطراب فرط الحركة ونقص الانتباه موجود في نحو 40% من الأطفال المصابين بالورم العصبي الليفي من النوع الأول.[17]
- كما حددت تأخيرات في النطق واللغة في حوالي 68% من أطفال ما قبل المدرسة المصابين بالورم العصبي الليفي من النوع الأول.[18]
- العجز الحركي شائع. العجز الحركي الناجم عن الورم العصبي الليفي من النوع الأول ربما لا يكون مخيخيًا.[19]
- العجز المكاني. يستخدم لوفاستاتين عادة لعلاج فرط كوليسترول الدم، وهو حاليًا في المرحلة الأولى من التجربة السريرية (NCT00352599). وقد ثبت أن هذا الدواء يعكس العجز المكاني في الفئران. لم يُظهر السيمفاستاتين، وهو دواء مشابه لوفاستاتين، فائدة على الوظيفة أو السلوك الإدراكي في تجربتين معشاة ذات شواهد على الأطفال المصابين بالورم العصبي الليفي من النوع الأول.[20][21][22]
الأسباب
[عدل]السبب الرئيسي هو طفرات،[23] تؤدي إلى خلل في الجينات وخاصة في الجين الموجود على كروموسوم 17.[24][25] والوراثة هي السبب الرئيسي لانتشار هذا المرض .[26]
التشخيص
[عدل]تشخيص المرض يكون اعتمادا على الأعراض الإكلينيكية . ومن الممكن اكتشاف المرض بفحص الجينات خلال فترة الحمل .[27] حيث يتم فحص السائل الأمينوسي أو فحص المشيمة .[28]
العلاج
[عدل]حاليا لا يوجد علاج شافي لهذا المرض. ولكن تتم معالجة الاعراض المرافقة . وقد يخضع المريض لأشعة مقطعية أو مغناطيسية للعصب البصري مبدئيا مع متابعة النمو وضغط الدم والعمود الفقري ومكان ظهور الألياف العصبية المعقدة.[29][30]
انظر أيضًا
[عدل]المراجع
[عدل]- ^ Josef Bednařík; Zdeněk Ambler; Evžen Růžička. Klinická neurologie: část speciální (بالتشيكية). ISBN:978-80-7387-389-9. QID:Q90835855.
- ^ Friedman JM (1 Mar 1999). "Epidemiology of neurofibromatosis type 1". American Journal of Medical Genetics Part A (بالإنجليزية). 89 (1): 1–6. DOI:10.1002/(SICI)1096-8628(19990326)89:1<1::AID-AJMG3>3.3.CO;2-#. ISSN:0148-7299. PMID:10469430. QID:Q33723844.
- ^ "Neurofibromatosis 1: Current Issues in Diagnosis, Therapy, and Patient Management", by David Viskochil MD PhD, Mountain States Genetic Foundation, Denver 2010[وصلة مكسورة] نسخة محفوظة 2015-11-06 على موقع واي باك مشين.
- ^ ""Current Therapies for Neurofibromatosis Type 1", by Laura Klesse MD PhD, Mountain States Genetic Foundation, Denver 2010" (PDF). مؤرشف من الأصل (PDF) في 2012-03-09. اطلع عليه بتاريخ 2011-05-15.
- ^ D، Evans (1 أبريل 2003). "Malignant peripheral nerve sheath tumours in neurofibromatosis 1". Journal of Medical Genetics. ج. 39 ع. 5: 311–4. DOI:10.1136/jmg.39.5.311. PMC:1735122. PMID:12011145.
- ^ Mutua, Victor; Mong’are, Newnex; Bundi, Brian; von Csefalvay, Chris; Oriko, David; Kitunguu, Peter (Sep 2021). "Sudden bilateral lower limb paralysis with dural ectasia in Neurofibromatosis type 1: A case report". Medicine: Case Reports and Study Protocols (بالإنجليزية الأمريكية). 2 (9): e0165. DOI:10.1097/MD9.0000000000000165. ISSN:2691-3895. Archived from the original on 2021-11-30.
- ^ ا ب Summers، M.A.؛ Quinlan، K.G.؛ Payne، J.M.؛ Little، D.G.؛ North، K.N.؛ Schindeler، A. (يونيو 2015). "Skeletal muscle and motor deficits in Neurofibromatosis Type 1". Journal of Musculoskeletal & Neuronal Interactions. ج. 15 ع. 2: 161–170. PMC:5133719. PMID:26032208.
- ^ Cornett، Kayla M. D.؛ North، Kathryn N.؛ Rose، Kristy J.؛ Burns، Joshua (2015). "Muscle weakness in children with neurofibromatosis type 1". Developmental Medicine & Child Neurology. ج. 57 ع. 8: 733–736. DOI:10.1111/dmcn.12777. PMID:25913846. S2CID:38835893.
- ^ Sullivan، Kate؛ El-Hoss، Jad؛ Quinlan، Kate G.R.؛ Deo، Nikita؛ Garton، Fleur؛ Seto، Jane T.C.؛ Gdalevitch، Marie؛ Turner، Nigel؛ Cooney، Gregory J.؛ Kolanczyk، Mateusz؛ North، Kathryn N.؛ Little، David G.؛ Schindeler، Aaron (1 مارس 2014). "NF1 is a critical regulator of muscle development and metabolism". Human Molecular Genetics. ج. 23 ع. 5: 1250–1259. DOI:10.1093/hmg/ddt515. PMC:3954124. PMID:24163128.
- ^ Stevenson، David A.؛ Allen، Shawn؛ Tidyman، William E.؛ Carey، John C.؛ Viskochil، David H.؛ Stevens، Austin؛ Hanson، Heather؛ Sheng، Xiaoming؛ Thompson، Brandi A.؛ J. Okumura، Megumi؛ Reinker، Kent؛ Johnson، Barbara؛ Rauen، Katherine A. (سبتمبر 2012). "Peripheral muscle weakness in RASopathies". Muscle & Nerve. ج. 46 ع. 3: 394–399. DOI:10.1002/mus.23324. PMID:22907230. S2CID:21120799.
- ^ Lakshmanan، Aarthi؛ Bubna، AdityaKumar؛ Sankarasubramaniam، Anandan؛ Veeraraghavan، Mahalakshmi؛ Rangarajan، Sudha؛ Sundaram، Murugan (2016). "A clinical study of neurofibromatosis-1 at a tertiary health care centre in south India". Pigment International. ج. 3 ع. 2: 102. DOI:10.4103/2349-5847.196302.
- ^ "Northwestern Health Sciences University ~ Diagnosis and Discussion". www.nwhealth.edu. مؤرشف من الأصل في 2016-03-04. اطلع عليه بتاريخ 2015-10-27.
- ^ Piersall, Linda, David H. Gutmann, & Rosalie Ferner. Living with Neurofibromatosis Type 1: A Guide for Adults. New York, NY: The National Neurofibromatosis Foundation, Inc. Print.
- ^ مدلاين بلس Optic glioma
- ^ Hyman SL، Shores A، North KN (أكتوبر 2005). "The nature and frequency of cognitive deficits in children with neurofibromatosis type 1". Neurology. ج. 65 ع. 7: 1037–44. DOI:10.1212/01.wnl.0000179303.72345.ce. PMID:16217056. S2CID:10198510.
- ^ Hyman SL، Gill DS، Shores EA، وآخرون (أبريل 2003). "Natural history of cognitive deficits and their relationship to MRI T2-hyperintensities in NF1". Neurology. ج. 60 ع. 7: 1139–45. DOI:10.1212/01.WNL.0000055090.78351.C1. PMID:12682321. S2CID:26812237.
- ^ Garg، S.؛ Lehtonen، A.؛ Huson، S. M.؛ Emsley، R.؛ Trump، D.؛ Evans، D. G.؛ Green، J. (2013). "Autism and other psychiatric comorbidity in neurofibromatosis type 1: Evidence from a population-based study". Developmental Medicine and Child Neurology. ج. 55 ع. 2: 139–45. DOI:10.1111/dmcn.12043. PMID:23163236. S2CID:11781870.
- ^ Thompson HL، Viskochil DH، Stevenson DA، Chapman KL (فبراير 2010). "Speech-language characteristics of children with neurofibromatosis type 1". Am. J. Med. Genet. A. ج. 152A ع. 2: 284–90. DOI:10.1002/ajmg.a.33235. PMID:20101681. S2CID:26650152.
- ^ van der Vaart T، van Woerden GM، Elgersma Y، de Zeeuw CI، Schonewille M (يونيو 2011). "Motor deficits in neurofibromatosis type 1 mice: the role of the cerebellum". Genes Brain Behav. ج. 10 ع. 4: 404–9. DOI:10.1111/j.1601-183X.2011.00685.x. PMID:21352477. S2CID:19609654.
- ^ موقع التجارب السريرية NCT00352599 Trial to Evaluate the Safety of Lovastatin in Individuals With Neurofibromatosis Type I (NF1)
- ^ Krab LC، de Goede-Bolder A، Aarsen FK، وآخرون (يوليو 2008). "Effect of simvastatin on cognitive functioning in children with neurofibromatosis type 1: a randomized controlled trial". JAMA. ج. 300 ع. 3: 287–94. DOI:10.1001/jama.300.3.287. PMC:2664742. PMID:18632543.
- ^ van der Vaart T، Plasschaert E، Rietman AB، وآخرون (نوفمبر 2013). "Simvastatin for cognitive deficits and behavioural problems in patients with neurofibromatosis type 1 (NF1-SIMCODA): a randomised, placebo-controlled trial". Lancet Neurol. ج. 12 ع. 11: 1076–83. DOI:10.1016/S1474-4422(13)70227-8. PMID:24090588. S2CID:206161362. مؤرشف من الأصل في 2018-07-23.
- ^ الوراثة المندلية البشرية عبر الإنترنت (OMIM): NEUROFIBROMATOSIS, TYPE I; NF1 -162200
- ^ "neurofibromin 1" بطاقات الجينات نسخة محفوظة 21 يونيو 2017 على موقع واي باك مشين.
- ^ "Human Gene NF1 (uc002hgf.1) Description and Page Index" نسخة محفوظة 03 أكتوبر 2018 على موقع واي باك مشين.
- ^ Goldberg NS, Collins FS (November 1991). "The hunt for the neurofibromatosis gene". Arch Dermatol. ج. 127 ع. 11: 1705–7. DOI:10.1001/archderm.1991.01680100105014. PMID:1952978. مؤرشف من الأصل في 30 أبريل 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ "British couple successfully screens out genetic disorder using NHS-funded PGD" by Antony Blackburn-Starza, June 9, 2008, BioNews 461 نسخة محفوظة 30 مارس 2016 على موقع واي باك مشين.
- ^ "Are there any prenatal tests for the neurofibromatoses?" نسخة محفوظة 21 مارس 2012 على موقع واي باك مشين.
- ^ "Neurofibromatosis 1: Current Issues in Diagnosis, Therapy, and Patient Management", by David Viskochil MD PhD, Mountain States Genetic Foundation, Denver 2010 نسخة محفوظة 06 نوفمبر 2015 على موقع واي باك مشين.
- ^ "Current Therapies for Neurofibromatosis Type 1", by Laura Klesse MD PhD, Mountain States Genetic Foundation, Denver 2010 نسخة محفوظة 9 مارس 2012 على موقع واي باك مشين. "نسخة مؤرشفة" (PDF). مؤرشف من الأصل في 2012-03-09. اطلع عليه بتاريخ 2013-09-17.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link)