حمض النتروز
| حمض النتروز | |
|---|---|
| أسماء أخرى | |
حمض الآزوتي |
|
| المعرفات | |
| رقم CAS | 7782-77-6 |
| بوب كيم (PubChem) | 24529 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | HNO2 |
| الكتلة المولية | 47.01 غ/مول |
| المظهر | محلول أزرق فاتح |
| نقطة الانصهار | 42.35 درجة حرارة مئوية |
| نقطة الغليان | 158 درجة حرارة مئوية |
| حموضة (pKa) | 3.29 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض النتروز هو حمض ضعيف أحادي البروتون يتكون من النتروجين والهيدروجين والأكسجين، وله الصيغة الكيميائية HNO2، ويوجد فقط على شكل محلول، ذي لون أزرق فاتح.
يحصل من حمض النتروز على أملاح النتريت المختلفة.
التحضير
[عدل]يحضر حمض النتروز من تفاعل ثنائي أكسيد النتروجين مع الماء في تفاعل عدم تناسب، مثلما يحدث في عملية أوستفالد على سبيل المثال، بحيث نحصل على حمض النتريك وحمض النتروز:
يمكن التحضير مخبرياً من تفاعل حمض الكبريتيك الممدد مع أحد أملاح النتريت مثل نتريت الباريوم.[3]
الخصائص
[عدل]يوجد حمض النتروز على شكل محلول فقط ولا يمكن عزله بشكل نقي. يؤدي التسخين إلى حدوث تفاعل عدم تناسب، حيث يتفكك وذلك إلى حمض النتريك وأحادي أكسيد النتروجين [3]
يؤدي تفاعل حمض النتروز مع المحاليل القلوية إلى تشكيل أملاح النتريت الموافقة. فعند تفاعل حمض النتروز مع محلول هيدروكسيد الصوديوم الممدد ينتج نتريت الصوديوم:
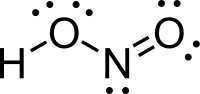
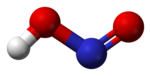
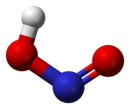
يمكن لجزيئات حمض النتروز أن تتبنى بنية جزيئية من النمط مقرون cis أو النمط مفروق trans، مع العلم أن النمط مفروق trans هو السائد في الشروط العادية، إذ تشير حسابات مطيافية الأشعة تحت الحمراء أن طاقة غيبس الحرة الدالة على الاستقرار هي حوالي 2.3 كيلوجول/مول.[4]
الأبعاد بين الذرية للنمط المفروق |
نموذج فراغي من العصي والكرات للنمط المفروق |
نموذج فراغي من العصي والكرات للنمط المقرون
|
الاستخدامات
[عدل]يستخدم حمض النتروز من أجل تحضير أملاح الديازونيوم.[3]
طالع أيضاً
[عدل]المراجع
[عدل]- ^ ا ب ج NITROUS ACID (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ ا ب ج M. Binnewies؛ وآخرون (2010)، Allgemeine und Anorganische Chemie، Spektrum، ص. 491، ISBN:3-82742533-6
{{استشهاد}}: Explicit use of et al. in:|الأخير=(مساعدة) - ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0-08-037941-9. p. 462
| حمض النتروز في المشاريع الشقيقة: | |
| |