خماسي كبريتيد الفسفور
| خماسي كبريتيد الفوسفور | |
|---|---|
| أسماء أخرى | |
phosphorus sulfide |
|
| المعرفات | |
| CAS | 1314-80-3 |
| بوب كيم | 14817 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | P4S10 |
| الكتلة المولية | 444.55 غ/مول |
| المظهر | صلب أصفر |
| الكثافة | 2.09 غ/سم3 |
| نقطة الانصهار | 288 °س |
| نقطة الغليان | 514 °س |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
خماسي كبريتيد الفوسفور هو مركب كيميائي من الكبريت والفوسفور ينتمي إلى كبريتيدات الفوسفور، وصيغته P4S10، والتي يمكن كتابتها على الشكل P2S5. يوجد المركب على شكل صلب بلوري أصفر اللون.
التحضير
[عدل]يمكن أن يحضر المركب من التفاعل المباشر بين العنصرين المكونين وهما الكبريت والفوسفور عند درجات حرارة تصل إلى 300 °س.[2] كان برسيليوس أول من قام بتفاعل التحضير هذا سنة 1843.[3][4]
الخواص
[عدل]يوجد المركب في الشروط القياسية على شكل صلب بلوري أصفر اللون، وتبدو العينات التجارية منه ذات لون أخضر مائل إلى الرمادي بسبب وجود الشوائب. يتفاعل هذا المركب مع الماء ليعطي حمض الفوسفوريك بالإضافة إلى كبريتيد الهيدروجين:
كما يتفاعل مع مذيبات عضوية أخرى مثل الكحولات وثنائي ميثيل السلفوكسيد وثنائي ميثيل فورماميد؛ ولكنه بالمقابل ينحل في ثنائي كبريتيد الكربون.[5]
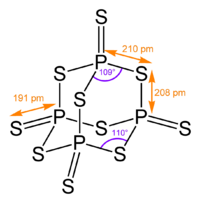
للمركب بنية جزيئية رباعية السطوح شبيهة ببنية الأدامانتان، وهي قريبة جداً من بنية خماسي أكسيد الفوسفور.[6]
الاستخدامات
[عدل]يستخدم خماسي كبريتيد الفوسفور في عدة تطبيقات مثل دخوله مادة بادئة في صناعة المبيدات الحشرية، مثل باراثيون ومالاثيون.[7]
مراجع
[عدل]- ^ ا ب ج Phosphorus pentasulfide (بالإنجليزية), QID:Q278487
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 565–568.
- ^ Berzelius, J. (1843). "Ueber die Verbindungen des Phosphors mit Schwefel". Annalen der Chemie und Pharmacie. ج. 46 ع. 2: 129–154. DOI:10.1002/jlac.18430460202. مؤرشف من الأصل في 2020-01-14.
- ^ Berzelius, J. (1843). "Ueber die Verbindungen des Phosphors mit Schwefel". Annalen der Chemie und Pharmacie. ج. 46 ع. 3: 251–281. DOI:10.1002/jlac.18430460303. (continuation of p. 154 of the same volume)
- ^ Scott D. Edmondson, Mousumi Sannigrahi "Phosphorus(V) sulfide" Encyclopedia of Reagents for Organic Synthesis 2004 John Wiley & Sons. دُوِي:10.1002/047084289X.rp166s.pub2
- ^ Corbridge, D. E. C. (1995). Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology (ط. 5th). Amsterdam: Elsevier. ISBN:0-444-89307-5.
- ^ Bettermann, G.؛ Krause, W.؛ Riess, G.؛ Hofmann, T. (2002). "Phosphorus Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a19_527. ISBN:3527306730.
| خماسي كبريتيد الفسفور في المشاريع الشقيقة: | |
| |