فلوريد الزرنيخ الخماسي
| فلوريد الزرنيخ الخماسي | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Arsenic pentafluoride |
|
| أسماء أخرى | |
Arsenic(V) fluoride, |
|
| المعرفات | |
| CAS | 7784-36-3 |
| بوب كيم | 82223 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | AsF5 |
| الكتلة المولية | 169.91 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 2.14 غ/سم3 (مقيسة بالطور السائل عند نقطة الغليان) |
| نقطة الانصهار | −79.8 °س |
| نقطة الغليان | −52.8 °س |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H280, H319, H350, H361, H370, H372 |
| بيانات وقائية وفق GHS | P201, P202, P260, P264, P270, P280, P281, P305+351+338, P307+311, P308+313, P314, P321, P337+313, P405 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
فلوريد الزرنيخ الخماسي (أو خماسي فلوريد الزرنيخ) هو مركب كيميائي صيغته AsF5، ويوجد في الشروط القياسية على شكل غاز عديم اللون.
ينتمي المركب إلى مجموعة الفلوريدات، وهو سام مثل باقي مركبات الزرنيخ اللاعضوية.
التحضير
[عدل]يحضر المركب من التفاعل المباشر للعنصرين المكونين له الزرنيخ والفلور:[3] [4]
كما يمكن أن تتم عملية التحضير من الفلورة اللاحقة لمركب فلوريد الزرنيخ الثلاثي:
الخواص
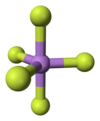
[عدل]يوجد المركب في الشروط القياسية على شكل غاز عديم اللون، وله بنية جزيئية هرمية ثلاثية مضاعفة. يبلغ طول الرابطة As−F المحورية في الحالة الصلبة مقدار 171.9 بيكومتر، أما الاستوائية فمقدارها 166.8 بيكومتر.[4]
يشكل خماسي فلوريد الزرنيخ معقدات هاليدية، ويتميز بكونه مستقبل جيد للإلكترونات كما يتضح في التفاعل مع رباعي فلوريد الكبريت:
- .
كما يشكل معقدات مختلفة مع ثنائي فلوريد الزينون:[5]
المخاطر
[عدل]إن مركب فلوريد الزرنيخ الثلاثي سام جداً مثل باقي مركبات الزرنيخ اللاعضوية.
مراجع
[عدل]- ^ ا ب ج Arsenic pentafluoride (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 198–9.
- ^ ا ب Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ Ralf Steudel: Chemie der Nichtmetalle, Synthesen – Strukturen – Bindung – Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 570, (Walter De Gruyter Online).
| فلوريد الزرنيخ الخماسي في المشاريع الشقيقة: | |
| |



![{\displaystyle \mathrm {AsF_{5}+SF_{4}\longrightarrow SF_{3}^{+}[AsF_{6}]^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ee1d1d083216e6e15ff78f052c1dc1358037ee2)
![{\displaystyle \mathrm {2\,XeF_{2}+AsF_{5}\rightarrow [Xe_{2}F_{3}][AsF_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7908536e1314d65cc30c1cbcee6f034181c805e7)
![{\displaystyle \mathrm {XeF_{2}+AsF_{5}\rightarrow [XeF][AsF_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a90aabf3a158d87480222a600ccd1d47c1f21d15)
![{\displaystyle \mathrm {XeF_{2}+2\,AsF_{5}\rightarrow [XeF][As_{2}F_{11}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4059be4656983f8a65dc2d53e40cdd0db85c91bc)