مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم
| مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم | |
|---|---|
مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم
| |
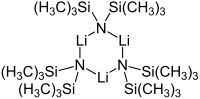
ثلاثي وحدات حلقي
| |
| الاسم النظامي (IUPAC) | |
Lithium bis(trimethylsilyl)amide |
|
| أسماء أخرى | |
سداسي ميثيل ثنائي سيليزيد الليثيوم |
|
| المعرفات | |
| الاختصارات | LHMDS |
| رقم CAS | 4039-32-1 |
| بوب كيم (PubChem) | 2733832 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C6H18LiNSi2 |
| الكتلة المولية | 167.33 غ/مول |
| المظهر | صلب أبيض اللون إلى أصفر |
| الكثافة | 0.86 غ/سم3 |
| نقطة الانصهار | 71-72 °س |
| نقطة الغليان | 80 - 84 °س |
| الذوبانية في الماء | يتفكك |
| حموضة (pKa) | 36 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم هو مركب ليثيوم وسيليكون عضوي له الصيغة LiN(SiMe3)2. يسمّى المركب أيضاً سداسي ميثيل ثنائي سيليزيد الليثيوم، ويرمز له لذلك LHMDS.
التحضير[عدل]
يحضّر مركب مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم من إجراء تفاعل بين ن-بوتيل الليثيوم في وسط من البينتان مع محلول من مضاعف (ثلاثي ميثيل سيليل) أمين (سداسي ميثيل ثنائي سيلازان) في وسط من الإيثر.[2][3]
يمكن أن يحضّر المركب بهذا الأسلوب بشكل مباشر في وسط التفاعل (في الموقع).[4]
الخواص[عدل]
إن مركب مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم هو مركب صلب، يتفكك لدى تماسه مع الهواء، كما أنه تلقائي الاشتعال، لذلك يحفظ ضمن جو من غاز خامل مثل النيتروجين.[2] يوجد المركب في الحالة الصلبة على شكل ثلاثي وحدات،[5] وفي حالة المحلول فإنه يتجمع مثله مثل العديد من مركبات الليثيوم العضوية. إن درجة تجمع المركب على شكل متعدد وحدات يعتمد على نوع المذيب المستعمل.
ينحل المركب في العديد من المذيبات العضوية مثل رباعي هيدرو الفوران أو الإيثر، ويوجد المركب في مثل هذه المذيبات التي يمكن أن تشكل معقدات تساندية مثل الإيثرات [6] على شكل مزيج من أحادي وثنائي الوحدات، كما يحدث ذلك أيضاً في الأمينات.[7] في حين أنه في المذيبات غير التساندية مثل الهيدروكربونات كالبينتان والمذيبات العطرية مثل التولوين يكون على شكل مزيج من ثنائي ورباعي الوحدات.[8]

| ||||
 ناتج ضم LiHMDS مع TMEDA. |
 ثنائي الوحدات مع LiHMDS)2•THF2 : THF) |
 ثلاثي الوحدات الخالي من المذيبات: LiHMDS)3) | ||
الاستخدامات[عدل]
يستخدم LiHMDS في الكيمياء العضوية كقاعدة قوية غير محبة للنواة. إن قيمة ثابت تفكك الحمض له مشابهة لمركب ثنائي إيزوبروبيل أميد الليثيوم LDA (حوالي ~36)، لكن لديه إعاقة فراغية أكبر وبالتالي أقل نكليوفيلية. يمكن أن يستخدم ليشكّل أسيتيليد،[9] أو إينولات لفلز الليثيوم.[4]

على هذا الأساس يستخدم في العديد من تفاعلات الازدواج، خاصة في تفاعلات تشكيل روابط كربون-كربون مثل تفاعل فراتر-سيباخ Fráter–Seebach reaction و تكاثف كلايسن.
كما يدخل LiHMDS كربيطة في العديد من التفاعلات ليعطي معقدات تساندية.[10]
المراجع[عدل]
- ^ أ ب ت Lithium bis(trimethylsilyl)amide (بالإنجليزية), QID:Q278487
- ^ أ ب Georg Brauer: Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band I, Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 711.(بالألمانية)
- ^ Amonoo-Neizer، E. H.؛ Shaw، R. A.؛ Skovlin، D. O.؛ Smith، B. C. (1966). "Lithium Bis(Trimethylsilyl)Amide and Tris(Trimethylsilyl)Amine". Inorg. Synth. Inorganic Syntheses. ج. 8: 19–22. DOI:10.1002/9780470132395.ch6. ISBN:978-0-470-13239-5.
- ^ أ ب Danheiser, R. L.; Miller, R. F.; Brisbois, R. G.(1990)."Detrifluoroacetylative Diazo Group Transfer: (E)-1-Diazo-4-phenyl-3-buten-2-one". Org. Synth.73: 134; Coll. Vol. 9: 197.
- ^ Rogers، Robin D.؛ Atwood، Jerry L.؛ Grüning، Rainer (1978). "The crystal structure of N-lithiohexamethyldisilazane, [LiN(SiMe3)2]3". J. Organomet. Chem. ج. 157 ع. 2: 229–237. DOI:10.1016/S0022-328X(00)92291-5.
- ^ Lucht، Brett L.؛ Collum, David B. (1995). "Ethereal Solvation of Lithium Hexamethyldisilazide: Unexpected Relationships of Solvation Number, Solvation Energy, and Aggregation State". Journal of the American Chemical Society. ج. 117 ع. 39: 9863–9874. DOI:10.1021/ja00144a012.
- ^ Lucht، Brett L.؛ Collum, David B. (1996). "Lithium Ion Solvation: Amine and Unsaturated Hydrocarbon Solvates of Lithium Hexamethyldisilazide (LiHMDS)". Journal of the American Chemical Society. ج. 118 ع. 9: 2217–2225. DOI:10.1021/ja953029p.
- ^ Philip L. Fuchs: Handbook of Reagents for Organic Synthesis, Reagents for Silicon-Mediated .... John Wiley & Sons, 2013, ISBN 978111863613-8, p. 356
- ^ Reich، Melanie (24 أغسطس 2001). "Addition of a lithium acetylide to an aldehyde; 1-(2-pentyn-4-ol)-cyclopent-2-en-1-ol". ChemSpider Synthetic Pages. ص. 137. مؤرشف من الأصل في 2015-04-02. اطلع عليه بتاريخ 2010-09-05.
- ^ Michael Lappert, Andrey Protchenko, Philip Power, Alexandra Seeber (2009). Metal Amide Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/9780470740385.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
| مضاعف (ثلاثي ميثيل سيليل) أميد الليثيوم في المشاريع الشقيقة: | |
| |


![{\displaystyle \mathrm {[(CH_{3})_{3}Si]_{2}NH+C_{4}H_{9}Li\longrightarrow LiN[Si(CH_{3})_{3}]_{2}+C_{4}H_{10}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/62f542fdc784c8df79ededae0cea13e3d414edec)