تأين ذاتي للماء

التأين الذاتي للماء هو تفاعل كيميائي يتم في الماء النقي أو المحلول المائي ذاتياً، حيث ينتقل بروتون من جزيء الماء إلى جزيء آخر، فيتكون أيونين هما الهيدرونيوم +H3O والهيدروكسيد− OH. ويعد التأين الذاتي للماء مثال على تحلل البروتون التلقائي وتمثيل التذبذب (متردد) الطبيعي للماء.
التركيز
[عدل]الماء الكيميائي النقي له قدرة توصيل كهربائي يعادل 0.055 مايكرو سيمنز. سم −1. ويرجع ذلك لوجود أيونات في الماء وفقا لنظرية سفانت أوغست أرهينيوس , وتنتج هذه الأيونات (سالبة الشحنة، وموجبة الشحنة) من تفاعل التأين الذاتي للماء :
حيث ينطبق هذا التوازن على الماء النقي وأي محلول مائي، ويعطى ثابت الإتزان الكيميائي بالعلاقة التالية :
في حالة إذا كان تركيز المواد المذابة في المحلول[H2O] منخفضة فيمكن اعتبارها ثابته وتساوي [55.5M. [1
يرمز لثابت تأين الماء (ثابت التفكك) أو ثابت التأين الذاتي للماء بالرمز Kw ويعطى بالعلاقة التالية :
حيث : [+H3O] هو تركيز أيون الهيدروجين أو أيون الهيدرونيوم [−OH] وهو مساوٍ لتركيز أيون الهيدروكسيد عند 25 درجة مئوية ,:
- ثابت تأين الماء
- Kw = 1.0×10−14
عند فصل جزيئات الماء إلى كميات متساوية من+ H3O و−OH تكون تركيزاتها متساوية mol dm−3 7− 10 ×1.0 (يكون تركيز +H3O في الماء مساوياً لتركيز − OH)
الماء النقي متعادل لكن معظم المياه تحتوي على شوائب ينتج عنها إما أن يكون المحلول حمضي أو قاعدي الذي بدوره يؤثر على تركيز أيون الهيدروكسيد وأيون الهيدرونيوم ,
وتمتص عينات الماء المعرضة للهواء حامض ثاني أكسيد الكربون فيزيد تركيز+ H3O ويقل تركيز -OH وباستمرار ذلك يستمر إنتاج [-H3O+][OH].
اعتماد التأين الذاتي على الضغظ ودرجة الحرارة وقوة التأين
[عدل] |
 |
 |
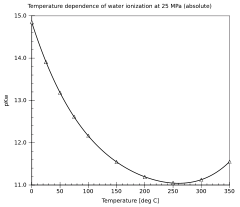
1- تنخفض قيمة pKw بارتفاع درجة الحرارة من نقطة انصهار الجليد إلى 250 درجة مئوية وتظل في الارتفاع حتى النقطة الحرجة 374 درجة مئوية.[2]
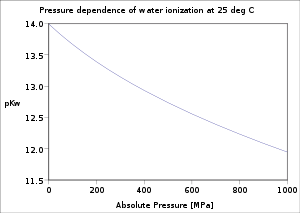
2- انخفاض قيمة pKw بارتفاع الضغط
3- في المحاليل الموصلة للكهرباء تعتمد pKw على القوة الأيونية للمحلول ,
في محاليل الكهارل تعتمد قيمة pKw على القوة الأيونية للكهرل. وعلى سبيل المثال، تكون قيمته لمحلول كلوريد الصوديوم هي القيمة المعتادة لنوع الكهارل 1:1 (الصيغة الكيميائية لكلوريد الصوديوم NaCl أي 1 كلور : 1 صوديوم). أما للكهارل بنسبة 1:2 ،وهي الكهارل ذات الصيغة الكيميائية MX2, فتنخفض pKw بتزايد القوة الأيونية.[1]
تأثير النظائر
[عدل]تأين الماء الثقيل D2O أقل بكثير من تأين الماء العادي H2O , حيث أن روابط الأكسجين في الماء الثقيل أقوى قليلا من تلك الموجودة في الماء العادي وذلك لكبر كتلة الديتريوم (الماء الثقيل) ويختلف ذلك عند قيم أقل من نقطة الطاقة الصفرية وتحت تأثير ميكانيكا الكم. الجدول التالي يوضح قيم pKw للماء الثقيل والماء الخفيف :
pKw للماء النقي T/°C 10 20 25 30 40 50 H2O 14.535 14.167 13.997 13.830 13.535 13.262 D2O 15.439 15.049 14.869 14.699 14.385 14.103
آلية التأين
[عدل]معدل التفكك للتفاعل
- H2O → H+ + OH-
يعتمد على طاقة التنشيط ΔE‡ , وفقا لتوزيع بولتزمان تكون نسبة جزيئات الماء التي لديها طاقة مناسبة للتسكين الحراري تعطى بالعلاقة :
حيث ان :
K ثابت بولتزمان , حيث يحدث التفكك الحراري عند توفر طاقة حرارية كافية بينما يعتمد تسلسل التفكك على التقلب الحراري للماء السائل [5] , فتحدث تقلبات عشوائية في حركة جزيئات السائل (مرة واحدة كل 10 ساعات [6]) فينتج عن التقلب كسر للروابط بالتالي ينتج حقل كهربائي قوي ينتج عنه أيون الهيدرونيوم وأيون الهيدروكسيد فيتحرر بروتون من أيون الهيدرونيوم وفقا لآلية جروتاس واستبدال الرابطة الهيدروجينية بعزل أيونين التي تستقرخلال 1 بيكو ثانية.
إعادة تكوين الرابطة الهيدروجينية يسمح بانتقال البروتون السريع وإيجاد فرق جهد وإعادة ترتيب الايونات مرة أخرى.
هذا الجدول الزمني يتناسب مع زمن تكون الرابطة الهيدروجينية وإعادة ترتيبها في الماء.[7][8][9]
انظر أيضا
[عدل]المراجع
[عدل]- ^ Harned، H.S.؛ Owen,، B.B. (1958). The Physical Chemistry of Electrolytic Solutions (ط. £rd.). New York: Reinhold Publishing Corp.,. ص. 634–649, 752–754.
{{استشهاد بكتاب}}: صيانة الاستشهاد: علامات ترقيم زائدة (link)

![{\displaystyle K_{eq}={\frac {[H_{3}O^{+}][OH^{-}]}{[H_{2}O]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c805a473d285429a37871575e24dd45fbe09cc7f)
![{\displaystyle K_{w}=[H_{3}O^{+}][OH^{-}]=K_{eq}\times [H_{2}O]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d60f2c106fb3da7ca29ae6007f253e152e3f9de)
