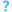فيروسات رنا سالبة السلسلة
فيروسات رنا سالبة السلسلة | |
|---|---|
 |
|
| المرتبة التصنيفية | شعبة[1][2] |
| التصنيف العلمي | |
| فوق النطاق | حيويات |
| مملكة | فيروس |
| realm | ريبوفيريا |
| مملكة | Orthornavirae |
| الاسم العلمي | |
| Negarnaviricota[1][2] | |
| تعديل مصدري - تعديل | |
تُعد فيروسات الحمض النووي الريبوزي سالبة السلسلة (-فيروسات ssRNA) مجموعة فيروسات مترابطة مصنوعة من الحمض النووي الريبوزي وتحتوي جينومات أحادية السلسلة سالبة الاتجاه. تمتلك هذه الفيروسات جينومات تعمل بمثابة سلاسل مكملة يُصنع باستخدامها الرنا المرسال (mRNA) بواسطة إنزيم بوليميراز الرنا المعتمدة على الرنا الفيروسي (آر دي آر بّي)، الذي يشكل في أثناء تنسخ الجينوم الفيروسي جينومًا مضادًا (سلسلة إيجابية الاتجاه) يستخدمه كقالب لإنشاء الحمض النووي الريبوزي الجيني سلبي الاتجاه. تشترك فيروسات الرنا سالبة السلسة أيضًا في عدد من الخصائص الأخرى: يضم معظمها غلافًا فيروسيًا يحيط بالقفيصة التي تغلف الجينوم الفيروسي، وعادة ما تكون جينومات هذه الفيروسات خطية، مع شيوع تجزؤ جينوماتها.
تشكل فيروسات الرنا سالبة السلسة شعبة Negarnaviricota، في مملكة Orthornavirae ونطاق Riboviria، وتنحدر من سلف مشترك هو فيروس الرنا مزدوج السلسلة (dsRNA)، وتُعد مجموعة شقيقة لفيروسات reovirus؛ فيروسات مزدوجة السلسة أيضًا. تضم الشعبة فرعين رئيسيين يشكلان شعيبتين: Haploviricotina، التي تضم فيروسات غير مجزأة الجينوم غالبًا، وترمز إنزيم بوليميراز الرنا المعتمدة على الرنا الفيروسي الذي يُعد مسؤولًا عن عملية تقبيع الرنا المرسال، وPolyploviricotina، التي تضم فيروسات مجزأة الجينوم وترمز الإنزيم الذي ينتزع القبعات من الرنا المرسال المضيف. يُذكر أنه تم التعرف على ستة أصناف في هذه الشعبة.
ترتبط فيروسات الرنا سالبة السلسلة ارتباطًا وثيقًا بمفصليات الأرجل ويمكن تقسيمها بصورة غير رسمية إلى قسم يعتمد على المفصليات للانتقال وآخر ينحدر من فيروسات مفصليات الأرجل لكنه قادر حاليًا على التكاثر في الفقاريات دون مساعدة المفصليات. تشمل أبرز فيروسات الرنا سالبة السلسلة التي تنقلها المفصليات فيروس حمى الوادي المتصدع وفيروس ذبول الطماطم المبقّع، بينما تندرج فيروسات الإيبولا وهانتا والإنفلونزا وحمى لاسا وداء الكلب ضمن فيروسات الرنا سالبة السلسلة في الفقاريات.
اشتقاق الاسم[عدل]
تأخذ Negarnaviricota الجزء الأول من اسمها من الكلمة اللاتينية nega، بمعنى سالب، ويدل الجزء الأوسط rna على الرنا، أما الجزء الأخير -viricota، فهي اللاحقة المستخدمة لشعبة الفيروس. تأخذ الشعيبة Haploviricotina الجزء الأول من اسمها Haplo من الكلمة اليونانية القديمة ἁπλός، بمعنى بسيط، أما -viricotina فهي اللاحقة المستخدمة لشعيبة الفيروس. تتبع تسمية شعيبة Polyploviricotina النمط نفسه: أُخذت كلمة Polyplo من الكلمة اليونانية القديمة πολύπλοκος، التي تعني معقدة.[7]
الخصائص[عدل]
الجينوم[عدل]

إن جميع الفيروسات في Negarnaviricota فيروسات أحادية السلسلة سالبة الاتجاه، تضم جينومات مكونة من الرنا أحادي السلسلة، بدلًا من ثنائي السلسلة، ولأن جينومها سلبي الاتجاه، فهي قادرة على تصنيع الرنا المرسال مباشرة من الجينوم بواسطة إنزيم بوليميراز الرنا المعتمدة على الرنا الفيروسي، الذي يسمى ايضًا إنزيم الرنا المتنسخ؛ إنزيم ترمزه جميع الفيروسات سالبة السلسلة. تمتلك جميع فيروسات الرنا سالبة السلسلة جينومات خطية بدلًا من دائرية، باستثناء الفيروسات التابعة لجنس Tenuivirus وبعض الفيروسات الموجودة في عائلة Chuviridae، علمًا أن الجينومات قد تكون مجزأة أو غير مجزأة. تحتوي جميع جينومات الرنا سالبة السلسلة على تكرارات طرفية مقلوبة، وهي تسلسلات نيوكليوتيدات متناظرة في كل طرف من طرفي الجينوم.[7][8][9]
التنسخ والنسخ[عدل]
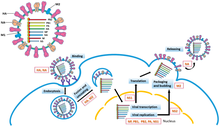
يحدث تنسخ فيروسات الرنا سالبة السلسلة بواسطة آر دي آر بي، الذي يبدأ عملية التنسخ من طريق الارتباط بتسلسل قيادي على النهاية 3' (تسمى عادةً «نهاية رئيسية ثالثة») من الجينوم، ثم يستخدم الإنزيم الجينوم ذي الاتجاه السلبي كقالب لتشكيل جينوم مضاد إيجابي الاتجاه. في عملية تنسخ الجينوم المضاد، يرتبط إنزيم آر دي آر بّي أولًا بتسلسل جرار على النهاية 3' من الجينوم المضاد، ليتجاهل بعدها إنزيم آر دي آر بّي جميع إشارات النسخ على الجينوم المضاد ويشكل نسخة من الجينوم مع استخدام الجينوم المضاد كقالب. يُنفذ التنسخ في أثناء وجود الجينوم داخل القفيصة المنواة، ويكشف إنزيم آر دي آر بّي عن القفيصة وينتقل على طول الجينوم في أثناء التنسخ. يجري تجميع بروتينات القفيصة وتغليف الرنا الفيروسي المتنسخ حديثًا بالتزامن مع تصنيع تسلسلات النوكليوتيدات الجديدة بواسطة إنزيم آر دي آر بّي.[10]
تتبع عملية نسخ الرنا المرسال من الجينوم النمط الاتجاهي نفسه المتبع في عملية إنتاج الجينوم المضاد. في التسلسل القيادي، يجمع إنزيم آر دي آر بّي رنا قيادي ثلاثي الفوسفات عند النهاية 5' (تسمى عادةً «نهاية أساسية خامسة»)، وإما يُقبّع النهاية 5' كما هو الحال في فيروسات شعيبة Haploviricotina، أو ينزع قبعة الرنا المرسال الخاص بالمضيف ويربطه بالرنا المرسال الفيروسي لتتمكن خلايا المضيف من ترجمة الرنا المرسال بواسطة ريبوسوماتها، كما هو الحال في فيروسات شعيبة Polyploviricotina.[11][12][13]
بعد تقبيع الرنا المرسال، يبدأ إنزيم آر دي آر بّي النسخ عند كودون البدء ثم ينهي النسخ لاحقًا عند الوصول إلى كودون التوقف. يصنع إنزيم آر دي آر بّي في نهاية النسخ ذيلًا عديد الأدينين (ذيل بولي إيه) يتكون من مئات الأدينينات في نهاية الرنا المرسال 3'، أو يحدث تعثر للبوليميراز على سلسلة من اليوراسيل. بعد إنشاء ذيل عديد الأدنين، يُطلق الرنا المرسال بواسطة إنزيم آر دي آر بّي. في الجينومات التي تشفر أكثر من جزء واحد قابل للنسخ، يمكن لإنزيم آر دي آر بّي مواصلة المسح حتى يصل إلى كودون البدء التالي لمتابعة عملية النسخ.[14]
بعض فيروسات الرنا سالبة السلسلة ثنائية الاتجاه، ما يعني أن السلالة الجينومية السالبة والجينوم المضاد الإيجابي يشفران بروتينات مختلفة عن بعضهما بصورة مستقلة، ومن أجل إتمام عملية نسخ هذه الفيروسات، تحدث جولتين من النسخ: أولًا، يُنتَج الرنا المرسال مباشرةً من الجينوم؛ ثانيًا، يتم إنشاء الرنا المرسال من الجينوم المضاد. تحتوي جميع الفيروسات ثنائية الاتجاه على حلقة جذعية توقف النسخ بعد نسخ الرنا المرسال الخاص بالبروتين.[15]
المورفولوجيا[عدل]

تحتوي فيروسات الرنا سالبة السلسلة على مركب بروتين نووي ريبوزي مكون من الجينوم وإنزيم آر دي آر بّي متصل بكل جزء محاط بقفيصة من الجينوم. تتكون القفيصة من بروتينات تضم بنيتها المطوية خمسة لوالب ألفا في النهاية الأمينية (شكل إتش-5) وثلاثة لوالب ألفا في النهاية الكربوكسيلية (شكل إتش-3). يقع الجينوم بين هاتين النهايتين داخل القفيصة. باستثناء عائلة Aspiviridae، تحتوي فيروسات الرنا سلبية السلسلة غلافًا فيروسيًا خارجيًا، وهو غشاء دهني يحيط بالقفيصة. يتنوع شكل جسيم الفيروس الخاص بهذه الفيروسات، أو ما يسمى الفيريون، وقد يكون خيطيًا أو متعدد الأشكال أو كرويًا أو أنبوبيًا.[16][17]
التطور[عدل]
يُعد تجزؤ الجينوم سمة بارزة في العديد من فيروسات الرنا، وإما تحوي جينومات ذات جزء واحد، كما هو الحال بصورة نموذجية في رتبة الفيروسات السلبية الأحادية Mononegavirales، أو تتألف جينوماتها من أجزاء عدة قد تصل إلى عشرة أجزاء، مثل فيروس البُلطي tilapia tilapinevirus. لم يظهر مع مرور الوقت اتجاه واضح يحدد عدد أجزاء جينوم هذه الفيروسات، إذ يبدو أن تجزؤ جينومها سمة مرنة لأنها تطورت بصفة مستقلة في مناسبات متعددة. إن معظم الجينومات الفيروسية في شعيبة Haploviricotina غير مجزأة، في حين أن التجزئة قد باتت صفة عالمية في فيروسات Polyploviricotina.[18]
مراجع[عدل]
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (17 Oct 2018), ICTV Master Species List 2018a v1 (بالإنجليزية), QID:Q57700017
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (8 Mar 2019), ICTV Master Species List 2018b.v2 (بالإنجليزية), QID:Q62075759
- ^ International Committee on Taxonomy of Viruses, ed. (24 Apr 2020), ICTV Master Species List 2019.v1 (بالإنجليزية), QID:Q91806681
- ^ International Committee on Taxonomy of Viruses, ed. (18 May 2021), ICTV Master Species List 2020.v1 (بالإنجليزية), QID:Q106917282
- ^ International Committee on Taxonomy of Viruses, ed. (1 Nov 2022), ICTV Master Species List 2021.v3 (بالإنجليزية), QID:Q116118382
- ^ International Committee on Taxonomy of Viruses, ed. (8 Apr 2023), ICTV Master Species List 2022.v1 (بالإنجليزية), QID:Q118434107
- ^ أ ب Wolf YI، Kazlauskas D، Iranzo J، Lucia-Sanz A، Kuhn JH، Krupovic M، Dolja VV، Kooning EV (27 نوفمبر 2018). "Origins and Evolution of the Global RNA Virome". mBio. ج. 9 ع. 6: e02329-18. DOI:10.1128/mBio.02329-18. PMC:6282212. PMID:30482837.
- ^ Käfer S، Paraskevopoulou S، Zirkel F، Wieseke N، Donath A، Petersen M، Jones TC، Liu S، Zhou X، Middendorf M، Junglen S، Misof B، Drosten C (12 ديسمبر 2019). "Re-assessing the diversity of negative strand RNA viruses in insects". PLOS Pathog. ج. 15 ع. 12: e1008224. DOI:10.1371/journal.ppat.1008224. PMC:6932829. PMID:31830128. مؤرشف من الأصل في 2021-05-27. اطلع عليه بتاريخ 2020-08-06.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Li CX، Shi M، Tian JH، Lin XD، Kang YJ، Chen LJ، Qin XC، Xu J، Holmes EC، Zhang YZ (29 يناير 2015). "Unprecedented genomic diversity of RNA viruses in arthropods reveals the ancestry of negative-sense RNA viruses". eLife. ج. 4 ع. 4: e05378. DOI:10.7554/eLife.05378. PMC:4384744. PMID:25633976. مؤرشف من الأصل في 2021-05-26. اطلع عليه بتاريخ 2020-08-06.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Negative stranded RNA virus replication". ViralZone. Swiss Institute of Bioinformatics. مؤرشف من الأصل في 2021-05-05. اطلع عليه بتاريخ 2020-08-06.
- ^ "Negative-stranded RNA virus transcription". ViralZone. Swiss Institute of Bioinformatics. مؤرشف من الأصل في 2021-05-23. اطلع عليه بتاريخ 2020-08-06.
- ^ "Cap snatching". ViralZone. Swiss Institute of Bioinformatics. مؤرشف من الأصل في 2020-10-08. اطلع عليه بتاريخ 2020-08-06.
- ^ Kuhn JH، Wolf YI، Krupovic M، Zhang YZ، Maes P، Dolja VV، Koonin EV (فبراير 2019). "Classify viruses - the gain is worth the pain". Nature. ج. 566 ع. 7744: 318–320. DOI:10.1038/d41586-019-00599-8. PMID:30787460. مؤرشف من الأصل في 2020-11-07. اطلع عليه بتاريخ 2020-08-06.
- ^ "Negative-stranded RNA virus polymerase stuttering". ViralZone. Swiss Institute of Bioinformatics. مؤرشف من الأصل في 2021-05-10. اطلع عليه بتاريخ 2020-08-06.
- ^ "Ambisense transcription in negative stranded RNA viruses". ViralZone. Swiss Institute of Bioinformatics. مؤرشف من الأصل في 2021-02-26. اطلع عليه بتاريخ 2020-08-06.
- ^ Zhou H، Sun Y، Guo Y، Lou Z (سبتمبر 2013). "Structural perspective on the formation of ribonucleoprotein complex in negative-sense single-stranded RNA viruses". Trends Microbiol. ج. 21 ع. 9: 475–484. DOI:10.1016/j.tim.2013.07.006. PMID:23953596.
- ^ Fermin، G. (2018). Viruses: Molecular Biology, Host Interactions and Applications to Biotechnology. Elsevier. ص. 19-27, 43. DOI:10.1016/B978-0-12-811257-1.00002-4. ISBN:9780128112571. مؤرشف من الأصل في 2020-10-22.
- ^ Bacharach E، Mishra N، Briese T، Zody MC، Kembou Tsofack JE، Zamostiano R، Berkowitz A، Ng J، Nitido A، Corvelo A، Toussaint NC، Abel Nielsen SC، Hornig M، Del Pozo J، Bloom T، Ferguson H، Eldar A، Lipkin WI (5 أبريل 2016). "Characterization of a Novel Orthomyxo-like Virus Causing Mass Die-Offs of Tilapia". mBio. ج. 7 ع. 2: e00431-16. DOI:10.1128/mBio.00431-16. PMC:4959514. PMID:27048802.