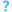فيروس داء الكلب
Rabies | |
|---|---|
مجهر إلكتروني نافذ صورة مجهرية with numerous rabies فيروسs (small dark-grey rod-like particles) and Negri bodies (the larger علم تشخيص الأمراض cellular inclusions of rabies infection)
| |
| المرتبة التصنيفية | نوع[1][2] |
| تصنيف الفيروسات | |
| المجموعة: | ((-)ssRNA) V مجموعة
|
| الرتبة: | فيروسات سلبية أحادية |
| الفصيلة: | فيروسات ربدية |
| الجنس: | Lyssavirus |
| النوع: | Rabies virus |
| الاسم العلمي | |
| Rabies virus[1][2] | |
| تعديل مصدري - تعديل | |
فيروس داء الكلب هو عبارة عن فيروس يصيب العصب ويتسبب في إصابة الإنسان والحيوان بداء الكلب. يمكن لداء الكلب أن ينتقل عن طريق لعاب الحيوانات، وعن طريق الاتصال مع لعاب الإنسان وهذا قليلاً ما يحدث. يعتبر فيروس داء الكلب أسطواني الشكل، وهو نوع من أنواع جنس الفيروسات الكلبية من فصيلة الفيروسات الربدية (Rhabdoviridae). وهذه الفيروسات محاطة بغلاف وتحتوي على جينوم الحمض النووي الريبي وحيد البناء بحس سلبي. تجتمع المعلومات الوراثية كمجموعة بروتينات نووية ريبوزية التي من خلالها يقوم البروتين النووي الفيروسي بإحاطة الحمض النووي الريبي (RNA) بإحكام. ولدى جينوم الحمض النووي الريبي للفيروس خمس جينات يتم حفظ ترتيبها بشكل جيد، وهذه الجينات ترمز إلى: بروتين نووي (M)، وبروتين فسفوري (P)، وبروتين المصفوفة (M)، وبروتين سكري (G)، وبوليميراز الحمض النووي الريبي الفيروسي (L).[7] ويتراوح التسلسل الكامل للجينوم من 11615 إلى 11966 شفافية قفوية في الطول.[8]
تحدث جميع أحداث النسخ والتكرار في السيتوبلازم داخل «مصنع الفيروس» المتخصص، أو الجسم النيجري (سُمي على شخص يدعى أديلتشي نيجري [الإنجليزية][9]). ويبلغ قطرها 2-10 ميكرون وهي تعتبر نموذجًا لعدوى داء الكلب، لذلك اُستخدمت كدليل هيستولوجي لمثل هذه العدوى.[10]
الهيكل[عدل]
تتمتع الفيروسات الكلبية بتناسقها اللولبي، لذلك تعتبر جسيماتها المعدية اسطوانية الشكل تقريباً. وتتميز هذه الفيروسات بشموليتها الواسعة جداً بدءًا من النباتات إلى الحشرات والثديات؛ فالفيروسات التي تصيب الإنسان غالباً ما يكون تماثلها متعدد السطوح ذو 20 وجهاً وتأخذ أشكالاً متعددة السطوح بصورة منتظمة تقريباً.
لدى فيروس داء الكلب شكل يشبه الرصاصة ويبلغ طوله حوالي 180 نانو متر، وقطر المقطع المستعرض حوالي 75 نانو متر. نهاية الطرف الأول للفيروس قد تكون مدورة أو مخروطية الشكل، أما نهاية طرفه الآخر فقد تكون مسطحة أو مقعرة. ويحمل غلاف البروتين الشحمي مسامير تشبه النتوءات التي تتكون من البروتين السكري (G)، وهذه المسامير لا تغطي نهاية الطرف المسطح لجسيمات الفيروس. ويوجد تحت الغلاف غشاء أو طبقة بروتين مصفوفة (M) التي قد تغطي نهاية الطرف المسطح. ويتكون جوف جسيمات الفيروس من بروتين نووي ريبوزي منَظًم بصورة لولبية.
دورة الحياة[عدل]
يدخل فيروس داء الكلب في الخلايا المضيفة عن طريق ممر النقل الداخلي بعدما يتم حزم المستقبل. فتقوم قيمة الرقم الهيدروجيني المنخفضة داخل الاندوسوم (أو الجسيم الداخلي) بتحفيز عملية الانصهار الغشائي، وبالتالي يتم تمكين الجينوم الفيروسي للوصول إلى العصارة الخلوية، ويتم تحفيز كلاً من عملية الانصهار الغشائي وعملية حزم المستقبل عن طريق بروتين (G) السكري الذي يلعب دوراً كبيرًا في نشوء المرض (فيروسات متحولة لا يمكن أن تنتشر من دون بروتينات (G)).[7]
و تتمثل الخطوة التالية بعد دخول نسخة الجينوم الفيروسي بوليميريز P-L (و هو مساعد أساسي لبوليميريز L) وذلك لإنشاء بروتينات فيروسية جديدة. ويستطيع البوليميريز الفيروسي التعرف على البروتين النووي الريبوزي لكن لا يمكنه استخدام الحمض النووي الريبي (RNA) الحُر كمرصاف. ويتم تنظيم النسخ عن طريق التسلسلات المقرونة بالجينوم الفيروسي وأيضا عن طريق بروتين المصفوفة (M) الذي يقوم بتنظيم إنتاج جزيئات الحمض النووي الريبي المرسل (mRNA) للاستنساخ، فضلا عن كونه عاملًا ضروريًا لبرعمة الفيروس. وخلال العدوى يتحول نشاط البوليميراز لاحقًا إلى الاستنساخ وذلك لإنتاج نسخ حمضية نووية ريبية كاملة الطول وايجابية الطاق. ويتم استخدام هذه الأحماض التكميلية كمراصيف لانشاء جينومات حمضية نووية ريبية سالبة الطاق. ويتم تعبئتها جنبا إلى جنب مع البروتين النووي (N) لتشكيل بروتين نووي ريبوزي الذي يمكن من خلاله أن يشكل فيروسات جديدة.[10]
الإصابة بالعدوى[عدل]
وجد الاختصاصي في علم البكتيريا لدى الحكومة "جوزيف لينوكس باوان [الإنجليزية]" في سبتمبر عام 1931م، في جزيرة ترينيداد أحد جزر الهند الغربية أجسام نيغري [الإنجليزية] في دماغ خفاش يتصرف بتصرفات غير عادية. فاكتشف جوزيف في عام 1932م بأن الخفافيش النزافة المصابة بالعدوى قد تنقل داء الكلب إلى الإنسان والحيوانات الأخرى.[11][12] راجع التاريخ الموجز من «جيمس واتيرمان» للاطلاع على لمحة تاريخية موجزة عن بعض القضايا المثيرة للجدل الي تحيط الاكتشافات السابقة المتعلقة بداء الكلب في ترينيداد.[13]
من مدخل الإصابة، ينتقل فيروس داء الكلب بسرعة على طول الممرات العصبية في الجهاز العصبي المحيطي. ويعد نقل المحور العصبي الرجعي من فيروس داء الكلب إلى الجهاز العصبي المركزي خطوة رئيسية للإمراض خلال العدوى الطبيعية. وعلى الرغم من وضوح عملية حزم البروتين (P) من فيروس داء الكلب إلى بروتين داينين ذو السلسلة الخفيفة (DYNLL1)، إلا أن الآلية الجزيئية الدقيقة لهذا النقل غير معروفة.[14] كما يعمل البروتين (P) باعتباره مضادا للأنترفيرون، مما يؤدي إلى خفض الاستجابة المناعية للمضيف.
من لحظة دخول الفيروس يكون الفيروس موجِّه للعصب؛ حيث ينتقل بسرعة عبر الممرات العصبية إلى الجهاز العصبي المركزي ومن ثم إلى أعضاء الجسم الأخرى. وتستقبل الغدد اللعابية الموجودة في أنسجة الفم والخدين تركيزًا عاليًا من الفيروسات مما يتيح لها أن تنتقل بصورة فائقة وذلك بسبب إفراز اللعاب. وقد تحدث الوفاة عند التشخيص للمرة الأولى بالإصابة بالعدوى وذلك خلال مدة تتراوح ما بين يومين إلى خمس سنوات،[15] لكن نسبة حدوث الوفاة تعتمد إلى حد كبير على فصيلة الحيوان ومستودعه. فأغلب الثديات المصابة بهذه العدوى تموت خلال أسابيع، بينما ثمة سلالات من فصيلة مثل النمس الأصفر الأفريقي (Cynictis penicillata) قد تبقى على قيد الحياة لسنوات وهي مصابة بالعدوى بدون أعراض.[16]
الاستضداد[عدل]
ينتج الجسم أضداد مستعدلة للفيروس التي تعمل على إعاقة حركة الفيروس ونشاطه، وذلك عند دخول الفيروس إلى الجسم، وأيضا بعد التطعيم. وقد ثبت أن مناطق معينة من البروتين السكري (G) هي الأكثر أستضدادًا مما يؤدي إلى إنتاج أضداد مستعدلة للفيروس.[17] وتصنف هذه المواقع المستضدية إلى مناطق I-IV والمنطقة الثانوية a. وقد أثبت العمل السابق بأن الأضداد المستعدلة الطبيعية غالبا ما تستهدف المواقع II و III المستضدية. بالإضافة إلى أن ضِد وحيد النَّسيلَة مع الوظيفة المستعدلة يستهدف الموقع I المستضدي.[18] واظهرت الدراسات بأن البروتينات الأخرى، مثل البروتين النووي، غير قادرة على إنتاج أضداد مستعدلة للفيروس بفعالية.[19] وتعتبر المستضدات التي تقوم بإعاقة الأضداد المستعدلة خطية وتكوينية.[20]
التطور[عدل]
اتضح أن جميع فيروسات داء الكلب قد تطورت خلال 1500 سنة الأخيرة.[21] ولفيروس داء الكلب سبعة أنماط جينية، فالحالات في أوراسيا كانت تبعا لثلاثة انماط من هذه السبعة وهي: النمط الجيني الأول (داء الكلب الكلاسيكي)، والنمط الجيني الخامس والسادس التي تعتبر الأقل حدة (الخفاش الأوروبي ليسافيروسيس نوع 1 و 2).[22] فالنمط الأول تطور في أوروبا في القرن السابع عشر وامتد إلى آسيا وأفريقيا والأمريكتين نتيجة للاستكشاف الأوروبي والاستعمار.
و قد ظهر بأن الخفافيش المصابة بداء الكلب في أمريكا الشمالية موجودة منذ عام 1281 م (فاصل الثقة 95%: 906-1577 ميلادي).[23]
التطبيق[عدل]
يستخدم فيروس داء الكلب في الأبحاث لتتبع الخلايا العصبية الفيروسية وذلك لإنشاء روابط متشابكة وتحديد اتجاه الانتقال المتشابك.[24]
المراجع[عدل]
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (30 Jun 2014), ICTV Master Species List 2013 v2 (بالإنجليزية), QID:Q18810383
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (12 Jun 2015), ICTV Master Species List 2014 v4 (بالإنجليزية), QID:Q24716610
- ^ ICTV Master Species List 2005 (بالإنجليزية), 2005, QID:Q69579583
- ^ ICTV Master Species List 2009 (بالإنجليزية), 2009, QID:Q69578243
- ^ ICTV Master Species List 2011 (بالإنجليزية), 2011, QID:Q69577927
- ^ ICTV Master Species List 2012 (بالإنجليزية), 2013, QID:Q69577800
- ^ أ ب Finke S, Conzelmann KK (أغسطس 2005). "Replication strategies of rabies virus". Virus Res. ج. 111 ع. 2: 120–131. DOI:10.1016/j.virusres.2005.04.004. PMID:15885837.
- ^ "Rabies complete genome". المركز الوطني لمعلومات التقانة الحيوية Nucleotide Database. مؤرشف من الأصل في 2018-12-25. اطلع عليه بتاريخ 2013-05-29.
- ^ synd/2491 على قاموس من سمى هذا؟
- ^ أ ب Albertini AA, Schoehn G, Weissenhorn W, Ruigrok RW (يناير 2008). "Structural aspects of rabies virus replication". Cell. Mol. Life Sci. ج. 65 ع. 2: 282–294. DOI:10.1007/s00018-007-7298-1. PMID:17938861.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Pawan، J. L. (1936). "Transmission of the Paralytic Rabies in Trinidad of the Vampire Bat: Desmodus rotundus murinus Wagner, 1840". Annals of Tropical Medicine and Parasitology. ج. 30: 137–156. ISSN:0003-4983.
- ^ Pawan، J. L. (1936). "Rabies in the vampire bat of Trinidad, with special reference to the clinical course and the latency of infection". Ann Trop Med Parasitol. ج. 30: 101–129. ISSN:0003-4983.
- ^ Waterman، James A. (1965). "The History of the Outbreak of Paralytic Rabies in Trinidad Transmitted by Bats to Human beings and Lower animals from 1925". Caribbean Medical Journal. ج. 26 ع. 1–4: 164–169. ISSN:0374-7042.
- ^ Raux H, Flamand A, Blondel D (نوفمبر 2000). "Interaction of the rabies virus P protein with the LC8 dynein light chain". J. Virol. ج. 74 ع. 21: 10212–10216. DOI:10.1128/JVI.74.21.10212-10216.2000. PMC:102061. PMID:11024151. مؤرشف من الأصل في 2019-12-11.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "Rabies". University of Northern British Columbia. مؤرشف من الأصل في 2012-10-13. اطلع عليه بتاريخ 2008-10-10.
- ^ Taylor PJ (ديسمبر 1993). "A systematic and population genetic approach to the rabies problem in the yellow mongoose (Cynictis penicillata)". Onderstepoort J. Vet. Res. ج. 60 ع. 4: 379–87. PMID:7777324.
- ^ Benmansour A (1991). "Antigenicity of rabies virus glycoprotein". Journal of Virology. ج. 65 ع. 8: 4198–4203. PMC:248855. PMID:1712859.
- ^ Marissen، WE.؛ Kramer، RA.؛ Rice، A.؛ Weldon، WC.؛ Niezgoda، M.؛ Faber، M.؛ Slootstra، JW.؛ Meloen، RH.؛ وآخرون (أبريل 2005). "Novel rabies virus-neutralizing epitope recognized by human monoclonal antibody: fine mapping and escape mutant analysis". J Virol. ج. 79 ع. 8: 4672–8. DOI:10.1128/JVI.79.8.4672-4678.2005. PMC:1069557. PMID:15795253.
- ^ Wiktor، TJ.؛ György، E.؛ Schlumberger، D.؛ Sokol، F.؛ Koprowski، H. (يناير 1973). "Antigenic properties of rabies virus components". J Immunol. ج. 110 ع. 1: 269–76. PMID:4568184.
- ^ Bakker، AB.؛ Marissen، WE.؛ Kramer، RA.؛ Rice، AB.؛ Weldon، WC.؛ Niezgoda، M.؛ Hanlon، CA.؛ Thijsse، S.؛ وآخرون (يوليو 2005). "Novel human monoclonal antibody combination effectively neutralizing natural rabies virus variants and individual in vitro escape mutants". J Virol. ج. 79 ع. 14: 9062–8. DOI:10.1128/JVI.79.14.9062-9068.2005. PMC:1168753. PMID:15994800.
- ^ Nadin-Davis، S. A.؛ Real، L. A. (2011). "Molecular phylogenetics of the lyssaviruses--insights from a coalescent approach". Adv Virus Res. Advances in Virus Research. ج. 79: 203–238. DOI:10.1016/B978-0-12-387040-7.00011-1. ISBN:9780123870407. PMID:21601049.
- ^ McElhinney، L. M.؛ Marston، D. A.؛ Stankov، S؛ Tu، C.؛ Black، C.؛ Johnson، N.؛ Jiang، Y.؛ Tordo، N.؛ Müller، T.؛ Fooks، A. R. (2008). "Molecular epidemiology of lyssaviruses in Eurasia". Dev Biol (Basel). ج. 131: 125–131. PMID:18634471.
- ^ Kuzmina، N. A.؛ Kuzmin، I. V.؛ Ellison، J. A.؛ Taylor، S. T.؛ Bergman، D. L.؛ Dew، B.؛ Rupprecht، C. E. (2013). "A reassessment of the evolutionary timescale of bat rabies viruses based upon glycoprotein gene sequences". Virus Genes. Forthcoming ع. 2: 305. DOI:10.1007/s11262-013-0952-9.
- ^ Ginger, M., Haberl M., Conzelmann K.-K., Schwarz M. and Frick A. (2013). Revealing the secrets of neuronal circuits with recombinant rabies virus technology. Front. Neural Circuits. دُوِي:10.3389/fncir.2013.00002
روابط خارجية[عدل]
| Rabies في المشاريع الشقيقة: | |
| |