كلوريد الفوسفوريل
| كلوريد الفوسفوريل | |
|---|---|
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Phosphoryl trichloride[1] |
|
| أسماء أخرى | |
Phosphorus oxychloride |
|
| المعرفات | |
| CAS | 10025-87-3 |
| بوب كيم | 24813 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | POCl3 |
| الكتلة المولية | 153.33 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.64 غ/سم3 |
| نقطة الانصهار | 1.25 °س |
| نقطة الغليان | 105.8 °س |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
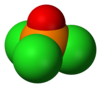
كلوريد الفوسفوريل (أو أوكسي كلوريد الفوسفور) هو مركب كيميائي من الكلور والأكسجين والفوسفور ينتمي إلى هاليدات الفوسفوريل، صيغته POCl3، ويوجد على شكل سائل عديم اللون.
التحضير
يمكن أن يحضر المركب مخبرياً بعدة طرق، مثلاً من تفاعل خماسي كلوريد الفوسفور مع ثنائي أكسيد الكبريت:
كما يمكن أن يجرى تفاعل الأكسدة باستخدم مؤكسد قوي مثل كلورات البوتاسيوم:[4]
كما يمكن أن يحضر المركب بأسلوب آخر انطلاقاً من فوسفات ثلاثي الكالسيوم بتفاعله مع الكربون والكلور:[5]
الخواص
يوجد المركب في الشروط القياسية على شكل سائل عديم اللون، وللمركب بنية رباعية السطوح مثل الفوسفات.[6]
يتفاعل كلوريد الفوسفوريل مع الماء ليعطي كلوريد الهيدروجين وحمض الفوسفوريك:
الاستخدامات
يستخدم المركب في المختبرات الكيميائية لإنجاز تفاعلات بلمهة (نزع الماء)؛ مثل تحويل الأميدات إلى النتريلات.[7]
وكذلك في تفاعلات التحليق:
طالع أيضاً
مراجع
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ص. 926. DOI:10.1039/9781849733069-FP001. ISBN:978-0-85404-182-4.
- ^ أ ب ت PHOSPHORUS OXYCHLORIDE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Pradyot، Patnaik (2003). Handbook of Inorganic Chemicals. New York: McGraw-Hill. ص. 709. ISBN:0070494398. مؤرشف من الأصل في 2020-03-26.
- ^ Lerner، Leonid (2011). Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling. Boca Raton, Florida: CRC Press. ص. 169–177. ISBN:9781439813126. مؤرشف من الأصل في 2020-03-26.
- ^ Greenwood، N. N.؛ Earnshaw، A. (1997). Chemistry of the Elements (ط. 2nd). Oxford: Butterworth-Heinemann.
- ^ March، J. (1992). Advanced Organic Chemistry (ط. 4th). New York, NY: Wiley. ص. 723.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|السنة=لا يطابق|تاريخ=(مساعدة)
| كلوريد الفوسفوريل في المشاريع الشقيقة: | |
| |







