ستيرويد ابتنائي: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
| سطر 145: | سطر 145: | ||
=== التفاعل مع مستقبلات غابا === |
=== التفاعل مع مستقبلات غابا === |
||
تقوم بعض الستيرويدات مثل [[التستوستيرون]]، وديهدروتستوسترون، وستانوزولول، وميثيلتستوستيرون بتعديل [[مستقبلات جابا|مستقبلات غابا]] على غرار الستيرويدات العصبية الذاتية مثل ألوبريغنانولون، 3α-أندروستانديول، كبريتات ديهيدروبياندروستيرون، وكبريتات بريغنينولون. وقد اقترح أن هذا يمكن أن يسهم كآلية بديلة أو إضافية للآثار العصبية والسلوكية للستيرويدات الأندروجينية الابتنائية.<ref name="pmid8294123">{{cite journal |vauthors=Bitran D, Kellogg CK, Hilvers RJ |title=Treatment with an anabolic-androgenic steroid affects anxiety-related behavior and alters the sensitivity of cortical GABAA receptors in the rat |journal=Horm Behav |volume=27 |issue=4 |pages=568–83 |year=1993 |pmid=8294123 |doi=10.1006/hbeh.1993.1041 }}</ref><ref name="pmid7603620">{{cite journal |vauthors=Masonis AE, McCarthy MP |title=Direct effects of the anabolic/androgenic steroids, stanozolol and 17α-methyltestosterone, on benzodiazepine binding to the γ-aminobutyric acid<sub>A</sub> receptor |journal=Neurosci. Lett. |volume=189 |issue=1 |pages=35–8 |year=1995 |pmid=7603620 |doi= 10.1016/0304-3940(95)11445-3|url=}}</ref><ref name="pmid16814373">{{cite journal |vauthors=Rivera-Arce JC, Morales-Crespo L, Vargas-Pinto N, Velázquez KT, Jorge JC |title=Central effects of the anabolic steroid 17alpha methyltestosterone in female anxiety |journal=Pharmacol. Biochem. Behav. |volume=84 |issue=2 |pages=275–81 |year=2006 |pmid=16814373 |doi=10.1016/j.pbb.2006.05.009 |url=}}</ref><ref name="pmid17433821">{{cite journal |vauthors=Henderson LP |title=Steroid modulation of GABAA receptor-mediated transmission in the hypothalamus: effects on reproductive function |journal=Neuropharmacology |volume=52 |issue=7 |pages=1439–53 |year=2007 |pmid=17433821 |pmc=1985867 |doi=10.1016/j.neuropharm.2007.01.022 |url=}}</ref><ref name="pmid19376158">{{cite journal |vauthors=Schwartzer JJ, Ricci LA, Melloni RH |title=Interactions between the dopaminergic and GABAergic neural systems in the lateral anterior hypothalamus of aggressive AAS-treated hamsters |journal=Behav. Brain Res. |volume=203 |issue=1 |pages=15–22 |year=2009 |pmid=19376158 |doi=10.1016/j.bbr.2009.04.007 }}</ref> |
تقوم بعض الستيرويدات مثل [[التستوستيرون]]، وديهدروتستوسترون، وستانوزولول، وميثيلتستوستيرون بتعديل [[مستقبلات جابا|مستقبلات غابا]] على غرار الستيرويدات العصبية الذاتية مثل ألوبريغنانولون، 3α-أندروستانديول، كبريتات ديهيدروبياندروستيرون، وكبريتات بريغنينولون. وقد اقترح أن هذا يمكن أن يسهم كآلية بديلة أو إضافية للآثار العصبية والسلوكية للستيرويدات الأندروجينية الابتنائية.<ref name="pmid8294123">{{cite journal |vauthors=Bitran D, Kellogg CK, Hilvers RJ |title=Treatment with an anabolic-androgenic steroid affects anxiety-related behavior and alters the sensitivity of cortical GABAA receptors in the rat |journal=Horm Behav |volume=27 |issue=4 |pages=568–83 |year=1993 |pmid=8294123 |doi=10.1006/hbeh.1993.1041 }}</ref><ref name="pmid7603620">{{cite journal |vauthors=Masonis AE, McCarthy MP |title=Direct effects of the anabolic/androgenic steroids, stanozolol and 17α-methyltestosterone, on benzodiazepine binding to the γ-aminobutyric acid<sub>A</sub> receptor |journal=Neurosci. Lett. |volume=189 |issue=1 |pages=35–8 |year=1995 |pmid=7603620 |doi= 10.1016/0304-3940(95)11445-3|url=}}</ref><ref name="pmid16814373">{{cite journal |vauthors=Rivera-Arce JC, Morales-Crespo L, Vargas-Pinto N, Velázquez KT, Jorge JC |title=Central effects of the anabolic steroid 17alpha methyltestosterone in female anxiety |journal=Pharmacol. Biochem. Behav. |volume=84 |issue=2 |pages=275–81 |year=2006 |pmid=16814373 |doi=10.1016/j.pbb.2006.05.009 |url=}}</ref><ref name="pmid17433821">{{cite journal |vauthors=Henderson LP |title=Steroid modulation of GABAA receptor-mediated transmission in the hypothalamus: effects on reproductive function |journal=Neuropharmacology |volume=52 |issue=7 |pages=1439–53 |year=2007 |pmid=17433821 |pmc=1985867 |doi=10.1016/j.neuropharm.2007.01.022 |url=}}</ref><ref name="pmid19376158">{{cite journal |vauthors=Schwartzer JJ, Ricci LA, Melloni RH |title=Interactions between the dopaminergic and GABAergic neural systems in the lateral anterior hypothalamus of aggressive AAS-treated hamsters |journal=Behav. Brain Res. |volume=203 |issue=1 |pages=15–22 |year=2009 |pmid=19376158 |doi=10.1016/j.bbr.2009.04.007 }}</ref> |
||
=== مقارنة الستيرويدات الأندروجينية الابتنائية === |
|||
==== 5α-ريدكتاز (إنزيم مختزِل) والآثار التذكيرية ==== |
|||
يمكن تحويل [[التستوستيرون]] بقوة بواسطة 5α-ريدكتاز إلى ديهدروتستوسترون في ما يسمى بالأنسجة المذكرة مثل [[الجلد]] و[[فروة الرأس]] و[[البروستاتا]] و[[الحويصلات المنوية]]، ولكن ليس في [[العضلات]] أو [[العظام]]، إذ لا يتم التعبير فيها عن 5α-ريدكتاز. |
|||
تُعدّ القدرة على [[الاستقلاب]] بواسطة 5α-ريدكتاز ونشاط المستقبلات الأندروجينية لنواتج [[الأيض]] الناتجة واحدة من أهم محددات النسبة الأندروجينية-الابتنائية لستيرويد معين. الستيرويدات التي لا تُقوَّى بواسطة 5α-ريدكتاز أو التي ضُعِّفت من قِبَل 5α-ريدكتاز في الأنسجة الأندروجينية لديها نسبة خطر أقل للآثار الجانبية الذكورية مثل [[حب الشباب]]، و[[الصلع]] الأندروجيني (نمط الصلع في الذكور)، و[[الشعرانية]] (نمو الشعر المفرط بالنمط الذكوري) ، و[[تضخم البروستاتا]] الحميد، و[[سرطان البروستاتا]]، في حين لايوجد فرق في حدوث ومدى ضخامة الآثار الأخرى مثل تضخم العضلات، وتغيرات العظام،<ref name="OrwollBilezikian2009">{{cite book|author1=Orwoll, Eric S. |author2=Bilezikian, John P. |author3=Vanderschueren, Dirk |title=Osteoporosis in Men: The Effects of Gender on Skeletal Health|url=https://books.google.com/books?id=nfWNYFdOsCsC&pg=PA296|date=30 November 2009|publisher=Academic Press|isbn=978-0-08-092346-8|pages=296–}}</ref> وتعميق الصوت، والتغيرات في [[الرغبة الجنسية]].<ref name="FillitRockwood2010">{{cite book|author1=Fillit, Howard M. |author2=Rockwood, Kenneth |author3=Woodhouse, Kenneth |title=Brocklehurst's Textbook of Geriatric Medicine and Gerontology|url=https://books.google.com/books?id=DPcUtY0kP7oC&pg=PA166|date=10 May 2010|publisher=Elsevier Health Sciences|isbn=1-4377-2075-7|pages=166–167}}</ref> |
|||
==== أروماتاز والآثار الإستروجينية (الإيداق) ==== |
|||
يمكن [[استقلاب]] [[التستوستيرون]] بواسطة [[أروماتاز]] إلى [[استراديول]]، وكذلك يمكن استقلاب العديد من الستيرويدات الأخرى إلى المستقلبات الإستروجينية المقابلة. على سبيل المثال، يتم تحويل 17α-ألكيلاتد ميثيلتستوستيرون وميتاندينون بواسطة أروماتاز إلى ميثيلستراديول.<ref name="ThiemeHemmersbach2009">{{cite book|author1=Thieme, Detlef |author2=Hemmersbach, Peter |title=Doping in Sports|url=https://books.google.com/books?id=R-hIC-caIn8C&pg=PA470|date=18 December 2009|publisher=Springer Science & Business Media|isbn=978-3-540-79088-4|pages=470–}}</ref> والذي يكون ذي آثار إستروجينية أكبر بالمقارنة مع التستوستيرون. |
|||
التأثير الرئيسي للإيداق هو التثدي. تظهر الستيرويدات التي لديها قابلية عالية للإنزيم [[أروماتاز]] مثل التستوستيرون وخاصةً ميثيلتستوستيرون مخاطر عالية [[تثدي الرجل|للتثدي]]، في حين أن الستيرويدات التي لديها احتمالية منخفضة للأروماتاز مثل ناندرولون تُظهر خطر أقل بكثير (خطرها كبير بالجرعات العالية).<ref name="pmid18555683">{{cite journal | vauthors = Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR | title = Dimethandrolone (7,11β-dimethyl-19-nortestosterone) and 11β-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase | journal = The Journal of Steroid Biochemistry and Molecular Biology | volume = 110 | issue = 3–5 | pages = 214–22 | date = June 2008 | pmid = 18555683 | pmc = 2575079 | doi = 10.1016/j.jsbmb.2007.11.009 }}</ref> وبعض الستيرويدات الأخرى (على سبيل المثال، 11β-ميثيليتد 19-مشتقات نورتيستوستيرون)، ليس لديهم خطر التثدي.<ref name="Llewellyn2011">{{cite book|author=Llewellyn, William |title=Anabolics|url=https://books.google.com/books?id=afKLA-6wW0oC&pg=PT533|year=2011|publisher=Molecular Nutrition Llc|isbn=978-0-9828280-1-4|pages=533–}}</ref> بالإضافة إلى [[تثدي الرجل|التثدي]]، هذه الستيرويدات عالية الإيداق لديها نشاط زائد مضاد موجهة الغدد التناسلية، مما يؤدي إلى زيادة قوة قمع محور [[المهاد]] و[[الغدة النخامية]] و[[الغدد التناسلية]] وإنتاج [[التستوستيرون]] من [[الغدد التناسلية]]. |
|||
==== النشاط البروجستيروني ==== |
|||
العديد من مشتقات 19-نورتيستوستيرون، بما في ذلك ناندرولون، ترينبولون، إيثيل إسترينول (إيثيلناندرول)، ميتريبولون، تريستولون، ديميثاندرولون، وغيرها، هي منبهات قوية لمستقبلات هرمون [[البروجستيرون]].<ref name="pmid16497801">{{cite journal | vauthors = Attardi BJ, Hild SA, Reel JR | title = Dimethandrolone undecanoate: a new potent orally active androgen with progestational activity | journal = Endocrinology | volume = 147 | issue = 6 | pages = 3016–26 | date = June 2006 | pmid = 16497801 | doi = 10.1210/en.2005-1524 }}</ref> وكما في حالة النشاط الإستروجيني، يعمل النشاط البروجستيروني لهذه الأدوية على زيادة نشاط مضاد موجهة [[الغدد التناسلية]]. يؤدي هذا إلى زيادة فعالية الستيرويدات ك[[وسائل منع الحمل الهرمونية|موانع حمل]] ذكرية. |
|||
==== نشاط الستيرويدات المُتناوَلة عن طريق الفم وتسمم الكبد ==== |
|||
مشتقات [[التستوستيرون]] والتستوستيرون نفسه، وديهدروتستوستيرون، وناندرولون كلهم ضعيفي الحيوية البيولوجية عن طريق الفم نظرًا للمرور ب[[الأيض]] الكبدي أولًا، وبالتالي لا تكون نشطة. ومن الاستثناءات الملحوظة من هذا النوع هي أمهات الأندروجين أو طلائع [[الهرمونات]]، بما في ذلك ديهيدروبياندروستيرون، أندروستينديول، أندروستينيديون، بولديون، بولانديول، بولانديون، ديينديون، مينتابولان، و ميثوكسيدينون.<ref name="WarrenConstantini2000">{{cite book|author1=Warren, Michelle P. |author2=Constantini, Naama W. |title=Sports Endocrinology|url=https://books.google.com/books?id=HNJ9BwAAQBAJ&pg=PA458|date=1 May 2000|publisher=Springer Science & Business Media|isbn=978-1-59259-016-2|pages=458–}}</ref><ref name="GregoryTravis2015">{{cite book|author1=Haff, G. Gregory|author2=Triplett, N. Travis|title=Essentials of Strength Training and Conditioning 4th Edition|url=https://books.google.com/books?id=bfuXCgAAQBAJ&pg=PA233|date=23 September 2015|publisher=Human Kinetics|isbn=978-1-4925-0162-6|pages=233–}}</ref> تستخدم الستيرويدات غير النشطة عن طريق الفم حصرًا تقريبًا في شكل استرات تُعطى عن طريق [[الحقن العضلي]]، والتي تعمل كمقدمة دواء طويلة المفعول. وتشمل الأمثلة التستوستيرون، كسيبيونات التستوستيرون، وإينونثات التستوستيرون، وبروبيونات التستوستيرون، والناندرولون، كفينيلبروبيونات الناندرولون و ديكانوات الناندرولون. |
|||
بالإضافة إلى النشاط عن طريق الفم، تؤدي هذه الستيرويدات بشكلٍ عالٍ ل[[تسمم الكبد]]، وإن كان غير شائع ويكون فقط بعد الاستعمال لفترات طويلة.<ref name="MDDrummer2001">{{cite book|author1=Karch, Steven B. |author2=Drummer, Olaf |title=Karch's Pathology of Drug Abuse, Third Edition|url=https://books.google.com/books?id=AUTWJwn8uOwC&pg=PA489|date=26 December 2001|publisher=CRC Press|isbn=978-1-4200-4211-5|pages=489–}}</ref><ref name="pmid20153798">{{cite journal |vauthors=van Amsterdam J, Opperhuizen A, Hartgens F |title=Adverse health effects of anabolic-androgenic steroids |journal=Regul. Toxicol. Pharmacol. |volume=57 |issue=1 |pages=117–23 |year=2010 |pmid=20153798 |doi=10.1016/j.yrtph.2010.02.001 |url=}}</ref> في المقابل،<ref name="pmid3042375">{{cite journal | vauthors = Wilson JD | title = Androgen abuse by athletes | journal = Endocr. Rev. | volume = 9 | issue = 2 | pages = 181–99 | year = 1988 | pmid = 3042375 | doi = 10.1210/edrv-9-2-181 | url = }}</ref><ref name="JamesonGroot2015">{{cite book|author1=Jameson, J. Larry |author2=De Groot, Leslie J. |title=Endocrinology: Adult and Pediatric|url=https://books.google.com/books?id=xmLeBgAAQBAJ&pg=PA2391|date=25 February 2015|publisher=Elsevier Health Sciences|isbn=978-0-323-32195-2|pages=2391–}}</ref> لم ترتبط استرات [[هرمون التستوستيرون]] ب[[تسمم الكبد]]، على الرغم من أن الاستخدام على المدى الطويل قد يزيد من خطر التغيرات الكبدية.<ref name="NieschlagBehre2012">{{cite book|author1=Nieschlag, Eberhard |author2=Behre, Hermann M. |author3=Nieschlag, Susan |title=Testosterone: Action, Deficiency, Substitution|url=https://books.google.com/books?id=MkrAPaQ4wJkC&pg=PA374|date=26 July 2012|publisher=Cambridge University Press|isbn=978-1-107-01290-5|pages=374–}}</ref><ref name="CameronFeuer2012">{{cite book|author1=Cameron, Ross |author2=Feuer, George |author3=de la Iglesia, Felix |title=Drug-Induced Hepatotoxicity|url=https://books.google.com/books?id=xZf-CAAAQBAJ&pg=PA166|date=6 December 2012|publisher=Springer Science & Business Media|isbn=978-3-642-61013-4|pages=166–}}</ref> |
|||
==== نشاط الستيرويد العصبي ==== |
|||
ديهيدروتستوستيرون، عن طريق مستقلبه 3α-أندروستانديول (التي تنتجها نازعة هيدروجين 3α هيدروكسيستيرويد)، هو ستيرويد عصبي يعمل عن طريق تعديل إيجابي ل[[مستقبلات جابا|مستقبل جابا]]. يُنتج [[التستوستيرون]]، عن طريق التحول إلى ديهيدروتستوستيرون، أيضًا 3α-أندروستانديول كمستقلب، وهذا قد يساهم كآلية بديلة أو إضافية للآثار على [[الجهاز العصبي المركزي]] في [[المزاج]]، و[[القلق]]، و[[العدوان]]، و[[الرغبة الجنسية|الدافع الجنسي]].<ref name="pmid8858992">{{cite journal |vauthors=Masonis AE, McCarthy MP |title=Effects of the androgenic/anabolic steroid stanozolol on GABAA receptor function: GABA-stimulated <sup>36</sup>Cl<sup>−</sup> influx and [<sup>35</sup>S] TBPS binding |journal=J. Pharmacol. Exp. Ther. |volume=279 |issue=1 |pages=186–93 |year=1996 |pmid=8858992 |doi= |url=}}</ref> |
|||
== الكيمياء == |
|||
الستيرويدات الأندروجينية الابتنائية هي أندروستان أو إستران المنشطات ومشتقات [[التستوستيرون]] مع تعديلات مختلفة في التركيب. |
|||
=== الكشف في سوائل الجسم === |
|||
أكثر العينات الفسيولوجية البشرية المستخدمة للكشف عن استخدام الستيرويدات هو [[البول]]، على الرغم من أن كلًا من [[الدم]] و[[الشعر]] يحققان هذا الغرض. تخضع الستيرويدات سواء ذاتية أو خارجية، للتحول البيولوجي الكبدي واسع النطاق من قِبَل مجموعة متنوعة من المسارات الإنزيمية. يمكن أن تكون الأيضات البولية الأولية قابلة للكشف لمدة تصل إلى 30 يوم بعد الاستخدام الأخير، اعتمادًا على عوامل معينة مثل الجرعة وطريقة التناول. وهناك عدد من الأدوية لها مسارات [[أيض]] مشتركة، وقد يتداخل إفرازها مع المنشطات الذاتية، مما يجعل تفسير نتائج الاختبار تحديًا كبيرًا جدًا لل[[كيميائي|كيميائي التحليلي]]. عادة ما تشمل طرق الكشف عن المواد أو نواتج إفرازها في عينات البول على الاستشراب الغازي-مطياف الكتلة أو الاستشراب السائل-مطياف الكتلة.<ref name="pmid18570179">{{cite journal |vauthors=Mareck U, Geyer H, Opfermann G, Thevis M, Schänzer W |title=Factors influencing the steroid profile in doping control analysis |journal=J Mass Spectrom |volume=43 |issue=7 |pages=877–91 |date=July 2008 |pmid=18570179 |doi=10.1002/jms.1457}}</ref><ref name="pmid19429460">{{cite journal |vauthors=Fragkaki AG, Angelis YS, Tsantili-Kakoulidou A, Koupparis M, Georgakopoulos C |title=Schemes of metabolic patterns of anabolic androgenic steroids for the estimation of metabolites of designer steroids in human urine |journal=J. Steroid Biochem. Mol. Biol. |volume=115 |issue=1–2 |pages=44–61 |date=May 2009 |pmid=19429460 |doi=10.1016/j.jsbmb.2009.02.016}}</ref><ref name="pmid19465014">{{cite journal | vauthors = Blackledge RD |title=Bad science: the instrumental data in the Floyd Landis case |journal=Clin. Chim. Acta |volume=406 |issue=1–2 |pages=8–13 |date=August 2009 |pmid=19465014 |doi=10.1016/j.cca.2009.05.016}}</ref><ref>{{cite book |first1=Randall Clint |last1=Baselt |title=Disposition of Toxic Drugs and Chemicals in Man |edition=8th |publisher=Biomedical Publications |location=Foster City, CA |year=2008 |pages=95, 393, 403, 649, 695, 952, 962, 1078, 1156, 1170, 1442, 1501, 1581 |isbn=978-0-9626523-7-0}}</ref> |
|||
== التاريخ == |
|||
=== استخلاص الأندروجين من الغدد التناسلية === |
|||
سبق استخدام المنشطات من [[الغدد التناسلية]] تحديد هويتهم وعزلهم. بدأ الاستخدام الطبي لمستخرج [[خصيتين|الخصية]] في أواخر [[القرن التاسع عشر]] في حين أن آثاره على القوة لا تزال قيد الدراسة. ويمكن أن يرجع عزل المنشطات من الغدد التناسلية إلى عام [[1931]]، عندما قام أدولف بوتيناندت، وهو كيميائي من [[ماربورغ]]، بتنقية 15 ملليغرام من هرمون الذكور أندروستينون من عشرات آلاف اللترات من [[البول]]. تم تصنيع هذا الستيرويد في وقتً لاحق في عام 1934 من قِبَل ليوبولد روزيكا، كيميائي من [[زيوريخ]]. |
|||
في الثلاثينات، كان من المعروف بالفعل أن الخصيتين تحتويان على [[أندروجين]] أقوى من أندروستينون، وتسابقت ثلاث مجموعات من العلماء، بتمويل من شركات الأدوية المتنافسة في [[هولندا]] و[[ألمانيا]] و[[سويسرا]] لعزلها.<ref name = "PMID7817189">{{cite journal |vauthors=Hoberman JM, Yesalis CE |title=The history of synthetic testosterone |journal=Scientific American |volume=272 |issue=2 |pages=76–81 |year=1995 |pmid=7817189 |doi=10.1038/scientificamerican0295-76}}</ref><ref name = "PMID11176375">{{cite journal |vauthors=Freeman ER, Bloom DA, McGuire EJ |title=A brief history of testosterone |journal=Journal of Urology |volume=165 |issue=2 |pages=371–373 |year=2001 |pmid=11176375 |doi=10.1097/00005392-200102000-00004}}</ref><ref>{{cite journal |vauthors=David K, Dingemanse E, Freud J, Laqueur L |title=Uber krystallinisches mannliches Hormon aus Hoden (Testosteron) wirksamer als aus harn oder aus Cholesterin bereitetes Androsteron |journal=Hoppe Seylers Z Physiol Chem |volume=233 |pages=281–283 |year=1935 |doi=10.1515/bchm2.1935.233.5-6.281 |issue=5–6}}</ref><ref>{{cite journal |doi=10.1002/cber.19350680937 |title=Über die Umwandlung des Dehydro-androsterons in Δ4-Androsten-ol-(17)-0n-(3) (Testosteron); ein Weg zur Darstellung des Testosterons aus Cholesterin (Vorläuf. Mitteil.) |trans_title=On the conversion of dehydro-Δ4-androstene androsterons in-ol (17) 0n (3) (testosterone), a way to represent the testosterone from cholesterol (Vorläuf. msgs.) |language=de |year=1935 |vauthors=Butenandt A, Hanisch G |journal=Berichte der deutschen chemischen Gesellschaft (A and B Series) |volume=68 |issue=9 |pages=1859–62}}</ref><ref>{{cite journal |vauthors=Ruzicka L, Wettstein A |title=Sexualhormone VII. Uber die kunstliche Herstellung des Testikelhormons. Testosteron (Androsten-3-one-17-ol.) |trans_title=Sex hormones VII About the artificial production of testosterone Testikelhormons (androstene-3-one-17-ol) |language=de |journal=Helvetica Chimica Acta |volume=18 |pages=1264–75 |year=1935 |doi=10.1002/hlca.193501801176}}</ref> وقد تم تحديد هذا الهرمون لأول مرة بواسطة كارولي جيولا ديفيد، ودينجيمانز، و[[فرويد]] وإرنست لاكور في ورقة بحثية مايو [[1935]]. أسموا هرمون التستوستيرون "هرمون الذكورة البلوري من الخصيتين (التستوستيرون)". وقد تحقق التركيب الكيميائي للهرمون تستوستيرون في أغسطس من ذلك العام، عندما نشرت بوتيناندت وهانيش ورقة تصف "طريقة لإعداد هرمون التستوستيرون". بعد أسبوع واحد فقط، أعلنت المجموعة الثالثة، روزيكا وويتستين، عن طلب براءة في ورقة بعنوان "التحضير الاصطناعي لهرمون التستوستيرون الخصي". وقد عُرِض على روزيكا وبوتيناندت [[جائزة نوبل في الكيمياء]] لعام [[1939]] على عملهما، لكن الحكومة النازية أجبرت بوتيناندت على رفض شرف الجائزة، على الرغم من أنه قبل الجائزة بعد نهاية [[الحرب العالمية الثانية]]. |
|||
بدأت التجارب السريرية على البشر، التي تنطوي على جرعات عن طريق الفم من ميثيلتيستوستيرون أو حقن هرمون بروبيونات التستوستيرون، في وقت مبكر من عام [[1937]]. وكثيرًا ما وردت تقارير عن شائعات بأن الجنود الألمان كانوا يتعاطون الستيرويدات الأندروجينية الابتنائية خلال الحرب العالمية الثانية، بهدف زيادة عدوانهم وقدرتهم على التحمل، ولكن لم يثبت هذا حتى الآن. حُقِن [[أدولف هتلر]] نفسه،<ref name=Taylor>{{cite book | vauthors = Taylor WN |title=Anabolic Steroids and the Athlete |publisher=McFarland & Company |date=January 1, 2009 |location= |page=181 |doi= |isbn=0-7864-1128-7}}</ref> وِفقًا لطبيبه، بمشتقات التستوستيرون لعلاج أمراض مختلفة. استُخدمت الستيرويدات في التجارب التي أجراها النازيون على سجناء معسكرات الاعتقال، وفي وقتٍ لاحق من قِبل الحلفاء الذين حاولوا علاج الضحايا الذين يعانون من [[سوء التغذية]] بعد أن نجوا من المخيمات النازية. وكان الرئيس [[جون كينيدي]] يتلقى الستيرويدات قبل وأثناء رئاسته.<ref name=NewsHour>{{cite web |url=http://www.pbs.org/newshour/bb/health/july-dec02/jfk_11-18.html |title=President Kennedy's Health Secrets |vauthors = Suarez R,((Senior Correspondent)), Kelman J,((physician)) |date=2002-11-18 |work=PBS NewsHour |publisher=Public Broadcasting System}}</ref> |
|||
=== تطوير الستيرويدات الأندروجينية الابتنائية الاصطناعية === |
|||
تم تطوير خصائص بناء [[العضلات]] للتستوستيرون في الأربعينات، في [[الاتحاد السوفيتي]] وفي بلدان الكتلة الشرقية مثل [[ألمانيا الشرقية]]، حيث استُخدمت برامج الستيرويد لتعزيز الأداء الأولمبي وغيرها من رافعي الأثقال. واستجابة لنجاح رافعي الأثقال الروس، عمل طبيب الفريق الأولمبي [[جون زيجلر]] مع الكيميائيين لتطوير ستيرويدات اصطناعية ذات آثار أندروجينية مُخفَّضة.<ref name="pedsreview">{{cite journal |vauthors=Calfee R, Fadale P |title=Popular ergogenic drugs and supplements in young athletes |journal=Pediatrics |volume=117 |issue=3 |pages=e577–89 |year=2006 |pmid=16510635 |doi=10.1542/peds.2005-1429}}</ref><ref>Justin Peters [http://www.slate.com/id/2113752/ The Man Behind the Juice], ''Slate'' Friday, Feb. 18, 2005. Retrieved 29 April 2008</ref> أدى عمل زيغلر إلى إنتاج ميثاندروستينولون، والذي سوقته سيبا للأدوية كديانابول. تمت الموافقة على الستيرويد الجديد للاستخدام في [[الولايات المتحدة]] من قبل [[إدارة الغذاء والدواء]] في عام [[1958]]. وكان الأكثر شيوعًا استخدامه لضحايا الحرق و[[كبار السن]]. وكان أغلب المستخدمين دون وصف الطبيب من لاعبي [[كمال الأجسام]] ورافعي الأثقال. على الرغم من وصف زيغلر لجرعات صغيرة فقط للرياضيين، وقال أنه سرعان ما اكتشف أن أولئك الذين يسيئون ديانابول عانوا من توسع [[البروستاتا]] وضمور الخصيتين. تم وضع الستيرويدات الأندروجينية الابتنائية على قائمة المواد المحظورة في [[اللجنة الأولمبية الدولية]] في عام [[1976]]، وبعد عقد من الزمان أضافت اللجنة اختبارات المنشطات "خارج المنافسة" لأن العديد من الرياضيين يستخدمونها في فترة التدريب بدلًا من أثناء المنافسة. |
|||
== مراجع == |
== مراجع == |
||
نسخة 00:40، 16 أبريل 2017
| ستِيرُويد ابْتِنائيّ أنْدرُوجِينيّ | |
|---|---|
| صنف دوائي | |
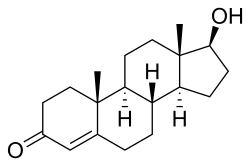 التركيب الكيميائي للستيرويد الابتنائي الأندروجيني الطبيعي التستوستيرون. | |
| معرفات الصنيف | |
| المرادفات | Anabolic steroids; Androgens |
| رمز ATC | A14A |
| المستهدف الحيوي | مستقبلات الأندروجين |
| تصنيف كيميائي | ستيرويدs; Androstanes; Estranes |
| معلومات سريرية | |
| Drugs.com | أصناف الدواء |
| روابط خارجية | |
| ن.ف.م.ط | D045165 |
| في ويكي بيانات | |
المُنشِّطات البِنائِيَّة، المعروفة أيضًا بالمُنشِّطات الابْتنائيَّة الأنْدرُوجِينيَّة،[1] هي الأندروجينات الستيرويدية التي تشمل الأندروجينات الطبيعية مثل التستوستيرون، وكذلك المواد الاصطناعية التي لها آثار مماثلة لهرمون التستوستيرون. تعمل هذه المنشطات على زيادة البروتين داخل الخلايا، وخاصة في العضلات والهيكل العظمي. ولها أيضًا درجات متفاوتة من الآثار الأندروجينية والمنشطة للذكورة، بما في ذلك تحفيز تطوُّر الخصائص الجنسية الثانوية الذكورية مثل نمو الحبال الصوتية وشعر الجسم. تأتي كلمة ابتنائية من الكلمة اليونانية ἀναλήολή، وهي واحدة من ثلاثة أنواع من ناهضات هرمونات الجنس، والبعض الآخر هرمونات استروجينية مثل استراديول وبروجستيرونات مثل البروجسترون.
صُنِّعت المنشطات الابتنائية في ثلاثينيات القرن العشرين، وتستخدم الآن علاجيًا في الطب لتحفيز نمو العضلات ولفتح الشهية، وتحفيز البلوغ في الذكور وعلاج الحالات المرتبطة بالهزال المزمن، مثل السرطان والإيدز. تعترف الكلية الأمريكية للطب الرياضي بأن المنشطات الابتنائية، في وجود نظام غذائي كاف، يمكن أن تسهم في زيادة في وزن الجسم، وأن الزيادات في القوة العضلية التي تتحقق من خلال ممارسة تدريبات مكثفة ونظام غذائي سليم يمكن أن تزيد أيضًا من خلال استخدام المنشطات في بعض الأفراد.[2]
ويمكن أن تنتج مخاطر صحية عند استخدام المنشطات على المدى الطويل أو بجرعات مفرطة.[3][4] وتشمل هذه الآثار تغيرات ضارة في مستويات الكوليسترول (زيادة البروتين الدهني منخفض الكثافة وانخفاض البروتين الدهني عالي الكثافة)، وحب الشباب، وارتفاع ضغط الدم، وتلف الكبد (بشكل رئيسي مع المنشطات المستخدمة عن طريق الفم)، وتغيرات خطيرة في هيكل البطين الأيسر من القلب.[5] قد تكون الحالات المتعلقة بالاختلالات الهرمونية مثل التثدي وتقلص حجم الخصية ناتجة أيضًا عن استخدام المنشطات.
استخدام المنشطات للإمداد بالطاقة كعقاقير مُحسِّنة للأداء في الرياضة والسباقات، وكمال الأجسام مثير للجدل بسبب آثارها السلبية وإمكانية الحصول على ميزة غير عادلة في المسابقات البدنية التنافسية. لذا يحظر استخدامها من قبل معظم الهيئات الرياضية الكبرى. لسنوات عديدة، كانت المنشطات الابتنائية الأندروجينية إلى حد كبير أكثر مواد يُكشَف عنها في المختبرات المعتمدة من اللجنة الأولمبية الدولية.[6] وفي البلدان التي تكون فيها هذه المواد خاضعة للمراقبة، كثيرًا ما توجد سوق سوداء تُباع فيها العقاقير المُهرَّبة أو المُصنَّعة سرًا أو حتى المُزيفة إلى المستخدمين.
الاستخدامات
الاستخدامات الطبية
منذ اكتشاف وتصنيع التستوستيرون في ثلاثينيات القرن العشرين، استُخدِمت الستيرويدات الابتنائية من قِبَل الأطباء لأغراض عديدة، بدرجات متفاوتة من النجاح، مثل:
- تحفيز نخاع العظام: على مدى عقود، كانت الستيرويدات الابتنائية الدعامة الأساسية لعلاج فقر الدم بسبب سرطان الدم أو الفشل الكلوي، وخاصة فقر الدم اللاتنسجي.[7] وقد تم استبدال الستيرويدات الابتنائية إلى حد كبير في هذا الإعداد بالهرمونات البروتينية الاصطناعية (مثل إيبوتين ألفا) التي تحفز بشكل انتقائي نمو خلايا الدم الأم.
- تحفيز النمو: يمكن استخدامها من قِبَل أطباء الغدد الصماء لعلاج الأطفال الذين يعانون من فشل النمو.[8] ومع ذلك، فإن توافر هرمون النمو الاصطناعي، والذي له آثار جانبية أقل، يجعل هذا العلاج ثانويًا.
- تحفيز الشهية والحفاظ على كتلة العضلات وزيادتها: أُعطيت الستيرويدات للأشخاص الذين يعانون من حالات الهزال المزمن مثل السرطان والإيدز.[9][10]
- تحفيز البلوغ في الذكور: يُعطى الأندروجين لكثير من الصبية الذين يعانون من تأخر شديد في البلوغ. وحاليًا تقريبًا التستوستيرون هو الأندروجين الوحيد المستخدم لهذا الغرض، وقد تبين أثره في زيادة الطول والوزن، والكتلة الخالية من الدهون في حالات تأخر البلوغ.[11]
- إمكانية استخدامها في المستقبل القريب كوسيلة منع حمل ذكرية، في شكل إينونثات التستوستيرون. باعتبارها وسيلة لمنع الحمل آمنة وموثوق بها وغير دائمة.[12]
- تحفيز كتلة الجسم النحيل والوقاية من تشرب العظم في الرجال المسنين،[13][14][15] كما أنها فعالة في تحسين الرغبة الجنسية لكبار السن من الذكور الذين يعانون من نقص هرمون التستوستيرون.[16][17][18][19]
- زيادة ضغط الشهيق الأقصى: وجدت دراسة في "البحث في الطب الرياضي" أن الجمع بين تدريب المقاومة وتَلَقّي المنشطات يُنتج زيادة كبيرة في ضغط الشهيق في مجموعة من مستخدمي الستيرويدات الابتنائية على المدى الطويل.[20]
تحسين الأداء

معظم مستخدمي الستيرويد ليسوا من الرياضيين.[21] ويُعتقد أن ما بين مليون و3 ملايين من الأشخاص (1 في المائة من السكان) أساءوا استخدام الستيرويدات الأندروجينية الابتنائية في الولايات المتحدة.[22] وقد أظهرت الدراسات في الولايات المتحدة أن المستخدمين في الغالب رجال شواذ من الطبقة المتوسطة مع متوسط عمر حوالي 25 وهم من غير الرياضيين وإنما يستخدمون العقاقير لأغراض تجميلية.[23] وقالت الدراسة التي أجرتها شركة بلو كروس بلو شيلد أن "استخدام الستيرويدات والعقاقير المماثلة ارتفع من 25 الى 17 عامًا من عام 1999 إلى عام 2000 وقال 20 في المئة أنهم يستخدمونها للمظهر وليس الرياضة".[24] ووجدت دراسة أخرى أن الاستخدام غير الطبي للستيرويدات بين طلاب الجامعات كان أقل من 1٪. في حين ذُكرت حوالي 13٪ من ممارسات الحقن غير الآمنة مثل إعادة استخدام الإبر، ومشاركة الإبر.[25] يميل مستخدمو الستيرويدات إلى البحث عن الأدوية التي يتناولونها أكثر من غيرهم من مستخدمي المواد الخاضعة للرقابة؛ ومع ذلك، فإن المصادر الرئيسية التي تم استشارتها من قِبَل مستخدمي الستيرويد تشمل الأصدقاء والكتيبات غير الطبية، والمنتديات على شبكة الإنترنت، ومجلات اللياقة البدنية، والتي يمكن أن توفر معلومات مشكوك فيها أو غير دقيقة.[26]
أظهرت دراسة حديثة أيضًا أن المستخدمين على المدى الطويل كانوا أكثر عرضة لأعراض تشوه العضلات.[27] وأظهرت دراسة حديثة في مجلة علم النفس الصحي أن العديد من المستخدمين يعتقدون أن المنشطات المُستخدَمة باعتدال آمنة.[28]
استخدم الرجال والنساء الستيرويدات الأندروجينية الابتنائية في العديد من الألعاب الرياضية المهنية لتحقيق ميزة تنافسية أو للمساعدة في الشفاء من الإصابة. وتشمل هذه الرياضة كمال الأجسام، ورفع الأثقال، وركوب الدراجات، والبيسبول، والمصارعة، وفنون القتال المختلطة، والملاكمة، وكرة القدم، والكريكيت. وهذا الاستخدام محظور بموجب قواعد الهيئات الرئاسية لمعظم الألعاب الرياضية. ويشيع استخدام هذه المنشطات بين المراهقين، ولا سيما من يشاركون في الألعاب الرياضية التنافسية.[29]
الأشكال المتاحة

هناك أربعة أشكال شائعة لاستخدام الستيرويدات: حبوب منع الحمل عن طريق الفم، والمنشطات عن طريق الحقن، والكريمات الموضعية، واللاصقات الجلدية. التناول عن طريق الفم هو الأكثر ملاءمة، يتم امتصاص التستوستيرون بسرعة، ولكن يتم تحويله بشكل كبير إلى الأيض غير النشط، ويبقى فقط حوالي 1/6 متاح في شكلٍ نشط. ومن أجل أن يظل نشطًا بما فيه الكفاية عندما يُعطى عن طريق الفم، تكون مشتقات التستوستيرون قلوية عند الموضع 17، على سبيل المثال: ميثيلتستوستيرون وفلوكسي ميسترون. يقلل هذا التعديل من قدرة الكبد على تكسير هذه المركبات قبل أن تصل إلى الدورة الدموية النظامية.
يمكن إعطاء التستوستيرون بالحقن، ولكن لديه وقت امتصاص لفترات طويلة وأقل انتظامًا ونشاط أكثر في العضلات في شكل إينونثات، وندكانويت، أو استرات سيبيونات. تتحلل هذه المشتقات لتطلق التستوستيرون الحر في موقع الحقن. يختلف معدل الامتصاص (وبالتالي الجدول الزمني للحقن) بين الاسترات المختلفة، ولكن يتم الحقن الطبي عادة في أي مكان بمعدل نصف أسبوعي إلى مرة واحدة كل 12 أسبوع. قد يكون من المُستحسن إعطاء كميات أكبر من أجل الحفاظ على مستوى أكثر استقرارًا من الهرمون في النظام. وعادة ما تُعطَى المنشطات عن طريق الحقن في العضلات، وليس في الوريد، لتجنب التغيرات المفاجئة في كمية الدواء في مجرى الدم. وبالإضافة إلى ذلك، لأن هرمون التستوستيرون يذوب في الزيت، يكون الحقن في الوريد لديه القدرة على إحداث انسداد خطير (جلطة) في مجرى الدم.
ويمكن أن تُستخدم لاصقات الجلد لإطلاق جرعة ثابتة من خلال الجلد إلى مجرى الدم. وتتوفر أيضًا الكريمات التي تحتوي على التستوستيرون والتي يتم تطبيقها يوميًا على الجلد، ولكن امتصاصها غير فعال (ما يقرب من 10٪، وتختلف بين الأفراد) وتُعدّ هذه العلاجات أكثر تكلفة. الأطفال والنساء حساسون للغاية لهرمون التستوستيرون ويمكن أن يعانوا من الذكورة والآثار الصحية السلبية، حتى من جرعات صغيرة.
ليس للطرق التقليدية للتعاطي آثارًا مختلفة على فعالية الدواء. ولكن قد تسبب الأشكال المتاحة من الستيرويدات عبر الفم بجرعات عالية تلف الكبد.[30][31]
أمثلة

الأكثر استخدامًا في الطب: التستوستيرون واستراته المختلفة (ولكن الأكثر شيوعًا وندكانويت التستوستيرون، وإينونثات التستوستيرون، وسيبيونات التستوستيرون، وبروبيونات هرمون التستوستيرون)،[32] وناندرولون (الأكثر شيوعًا، ديكانوات ناندرولون أو فينيلبروبيونات ناندرولون)، وستانوزولول، وميتاندينون (ميثاندروستينولون). تُستخدم أنواع أخرى ولكن بشكل أقل مثل ميثيلتيستوستيرون، وأوكساندرولون، وميستيرولون، وأوكسيميثولون، وكذلك بروبيونات دروستانولون (بروبيونات دروموستانولون)، وميتينولون (ميثيلاندروستينولون)، وفلوكسيسترون. وتُستخدم وندسيلنات بولدينون وخلات ترينبولون في الطب البيطري.
الآثار السلبية

الآثار العصبية والنفسية
تبين من مراجعة أُجريت عام 2005 في مجال العقاقير العصبية أن "الأعراض النفسية الهامة بما في ذلك العدوان والعنف والهوس وأقل شيوعًا الذهان والانتحار قد ارتبطت بإساءة استخدام الستيرويد، وقد يظهر على متعاطي الستيرويد على المدى الطويل أعراض الاعتماد والانسحاب عند التوقف عن استخدام الستيرويدات الأندروجينية الابتنائية".[34] تُنتج التركيزات العالية من الستيرويدات، بالمقارنة مع تلك التي يُحتمل أن تكون مستدامة من قِبَل العديد من مستخدمي الستيرويدات ترفيهيًا، تأثيرات موت الخلايا المبرمج على الخلايا العصبية، رافعةً خطر السمية العصبية والذي ربما لا علاج له.
يبدو أن استخدام الستيرويدات ترفيهيًا يرتبط مع مجموعة من الآثار النفسية المحتملة لفترات طويلة، بما في ذلك متلازمات الاعتماد، واضطرابات المزاج، والتقدم إلى أشكال أخرى من الإدمان، ولكن لايزال انتشار وشدة هذه الآثار المختلفة غير مفهومًا.[35] لا يوجد دليل على حدوث الاعتماد على الستيرويد من الاستخدام العلاجي لعلاج الاضطرابات الطبية، ولكن تم الإبلاغ عن حالات الاعتماد بين رافعي الأثقال ولاعبي كمال الأجسام الذين يتناولون جرعات كبيرة بشكل مزمن.[36] ومن المرجح أن تكون الاضطرابات المزاجية (مثل الاكتئاب، والهوس، والذهان) معتمدة على الجرعة والدواء، ولكن لا يحدث الاعتماد أو آثار الانسحاب إلا في عدد قليل من مستخدمي الستيرويدات.
ولا تتوافر حاليًا دراسات طويلة المدى على نطاق واسع للآثار النفسية على مستخدمي الستيرويدات الأندروجينية الابتنائية. تشير دراسة استمرت 13 شهر، والتي نُشرت في عام 2006 وشملت 320 من لاعبي كمال الأجسام والرياضيين، إلى أن مجموعة واسعة من الآثار الجانبية النفسية الناجمة عن استخدام الستيرويدات ترتبط بالإفراط في الاستخدام.[37]
الآثار الفسيولوجية
اعتمادًا على طول فترة تعاطي الدواء، هناك فرصة لإمكانية تلف الجهاز المناعي. تعتمد معظم هذه الآثار الجانبية على الجرعة، والأكثر شيوعًا ارتفاع ضغط الدم، وخاصةً في أولئك الذين يعانون من ارتفاع ضغط الدم الموجود من قبل.[38] بالإضافة إلى التغيرات المورفولوجية الدائمة للقلب والتي قد تؤدي إلى عدم كفاءة القلب والأوعية الدموية.
وقد تبين أن الستيرويدات تغير اختبارات السكر في الدم.[39][40][41] يزيد التستوستيرون أيضًا من خطر الإصابة بأمراض القلب والأوعية الدموية أو مرض الشريان التاجي. ويشيع كذلك ظهور حب الشباب، يرجع ذلك إلى تحفيز الغدد الدهنية عن طريق زيادة مستويات هرمون التستوستيرون.[42] يمكن أن يؤدي تحويل التستوستيرون إلى ديهدروتستوستيرون إلى زيادة معدل الصلع المبكر في الذكور ذوي الاستعداد الوراثي، ولكن التستوستيرون نفسه يمكن أن يُنتج الصلع في الإناث.[43]
يمكن أن يحدث عدد من الآثار الجانبية الشديدة في المراهقين. على سبيل المثال، قد يُوقِف إطالة العظام قبل الأوان (التحام مُشاشيّ سابق لأوانه من خلال زيادة مستويات نواتج أيض هرمون الإستروجين)، مما يؤدي إلى توقف النمو. وتشمل الآثار الأخرى، تسارُع نمو العظام، وزيادة وتيرة ومدة الانتصاب، والنمو الجنسي المبكر. ويرتبط استخدام الستريويدات الأندروجينية الابتنائية في مرحلة المراهقة أيضًا مع حالات صحية أخطر.[44]
السرطان
تضع الوكالة الدولية لبحوث السرطان الستيرويدات تحت المجموعة (2A): أي أنها ربما تكون مُسرطِنة للبشر.[45]
القلب والأوعية الدموية
يمكن أن تشمل الآثار الجانبية الأخرى تغييرات في بنية القلب، مثل توسع وسماكة البطين الأيسر، مما يضعف الانقباض والاسترخاء.[46][47][48] الآثار المحتملة لهذه التغيرات في القلب هي ارتفاع ضغط الدم، وعدم انتظام ضربات القلب، وقصور القلب الاحتقاني، والنوبات القلبية، والموت القلبي المفاجئ. تُرى هذه التغييرات أيضًا في الرياضيين الذين لا يستخدمون الدواء، ولكن استخدام الستيرويد قد يُسرِّع هذه العملية. ومع ذلك، لازال التنازع قائمًا على كُلٍّ من العلاقة بين التغييرات في هيكل البطين الأيسر وانخفاض وظيفة القلب، واستخدام الستيرويد.[49][50]
يمكن أن يسبب استخدام الستيرويدات الأندروجينية الابتنائية تغيرات ضارة في مستويات الكوليسترول: تسبب بعض المنشطات زيادةً في LDL "الكولسترول السيئ" وانخفاضًا في HDL "الكولسترول الجيد". [51]وبالإضافة إلى ذلك، تحفِّز المنشطات زيادة سريعة في وزن الجسم وما يصاحبه من ارتفاع في ضغط الدم، وكلاهما جعل المستخدمين أكثر عرضة لإصابة القلب والأوعية الدموية.
عيوب النمو
يسرِّع استخدام المنشطات في المراهقين نمو العظام ويقلل من طول البالغين بالجرعات العالية. وتُستخدم جرعات منخفضة من المنشطات مثل أوكساندرولون في علاج قصر القامة مجهول السبب.[52]
استئناث

هناك أيضًا آثار جانبية تبعًا للجنس. قد يحدث تطور أنسجة الثدي في الذكور، وهي حالة تسمى التثدي (والتي عادة ما تكون بسبب مستويات عالية من الاستراديول)، بسبب زيادة تحويل التستوستيرون إلى استراديول من قبل إنزيم أروماتاز.[53] يمكن أن يحدث أيضًا في الذكور انخفاض الوظيفة الجنسية والعقم المؤقت.[54][55][56] وهناك تأثير جانبي آخر على الذكور هو ضمور الخصية، والناجم عن قمع مستويات هرمون التستوستيرون الطبيعية، مما يمنع إنتاج الحيوانات المنوية (تعمل معظم كتلة الخصيتين على نمو الحيوانات المنوية). هذا التأثير الجانبي مؤقت؛ عادةً ما يعود حجم الخصيتين إلى وضعه الطبيعي في غضون أسابيع قليلة من التوقف عن استخدام الستيرويدات الأندروجينية الابتنائية وكذلك إنتاج عادي للحيوانات المنوية.[57]
إذكار
تشمل الآثار الجانبية الخاصة بالنساء زيادة شعر الجسم، وتعميق دائم للصوت، وتضخم البظر، وانخفاض مؤقت في دورات الطمث. ويمكن أيضًا أن يحدث في الإناث تغير الخصوبة وتكيسات المبيض.[58] عندما تؤخذ خلال فترة الحمل، يمكن أن تؤثر على تطور الجنين عن طريق التسبب في تطوير خصائص الذكور في الجنين المؤنث وخصائص الإناث في الجنين المذكر.[59]
مشاكل في الكلى
كشفت اختبارات الكلى أن تسعة من عشرة من مستخدمي الستيرويد أُصيبُوا بحالة تسمى تصلُّب الكبيبات البُؤريّ، وهو نوع من الندبات داخل الكلى. يشبه تلف الكلى في لاعبي كمال الأجسام التلف في المرضى الذين يعانون من السمنة المفرطة، ولكن يبدو أكثر حدة.[60]
مشاكل الكبد
يمكن أن تسبب الجرعات العالية من الستيرويدات الأندروجينية عن طريق الفم تلف الكبد. وكذلك تحدث الفرفرية الكبدية بشكل متزايد.
علم العقاقير
آلية العمل
تختلف الديناميكا الدوائية للستيرويدات الأندروجينية الابتنائية عن هرمونات الببتيد. إذ لا يمكن أن تخترق هرمونات الببتيد القابلة للذوبان في الماء غشاء الخلية الدهنية، وتؤثر بشكل غير مباشر فقط على نواة الخلايا المستهدفة من خلال تفاعلها مع مستقبلات سطح الخلية. ومع ذلك، مثل الهرمونات القابلة للذوبان في الدهون، تنفذ الستيرويدات عبر الغشاء وتؤثر على نواة الخلايا مباشرةً. يبدأ العمل الدوائي عندما يخترق الهرمون الخارجي غشاء الخلية المستهدفة ويرتبط بمستقبلات الأندروجين الموجودة في سيتوبلازم تلك الخلية. ومن هناك، ينتقل مركب المستقبل والهرمون إلى النواة، حيث يغير التعبير عن الجينات[62] أو ينشط العمليات التي ترسل إشارات إلى أجزاء أخرى من الخلية.[63] ترتبط أنواع مختلفة من الستيرويدات إلى مستقبلات الأندروجين بكفاءات مختلفة، اعتمادًا على هيكلها الكيميائي. يرتبط بعضها مثل ميتاندينون بشكل ضعيف لهذه المستقبلات في المختبر، ولكن لا تزال تظهر آثار المستقبل الأندروجيني في الجسم الحي. ولا يزال سبب هذا التناقض غير معروف.[64]
يحدث تأثير الستيرويدات على كتلة العضلات باثنين على الأقل من الطرق:[65] أولًا، أنها تزيد من إنتاج البروتينات. وثانيًا، أنها تقلل من وقت الانتعاش عن طريق منع آثار هرمون الإجهاد "الكورتيزول" على الأنسجة العضلية، فيتقلص تكسير العضلات إلى حد كبير.[66] وقد افتُرض أن هذا الانخفاض في انهيار العضلات قد يحدث من خلال تثبيطها عمل الهرمونات الستيرويدية الأخرى التي تسمى جلايكورتيكودات والتي تعزز انهيار العضلات. تؤثر الستيرويدات أيضًا على عدد الخلايا التي تتحول إلى خلايا تخزين الدهون، عن طريق تفضيل التمايز الخلوي إلى خلايا العضلات. يمكن أيضًا أن تقلل الدهون عن طريق زيادة معدل الأيض الأساسي، نتيجة زيادة كتلة العضلات.[67]
الآثار الابتنائية والذكورية
| المركب | النسبة |
|---|---|
| تستوستيرون | 1:1 |
| سيبيونات التستوستيرون | 1:1 |
| إنانثات التستوستيرون | 1:1 |
| ميثيل تستوستيرون | 1:1 |
| فلوكسيميسترون | 1:2 |
| أوكسيميثولون | 1:3 |
| أوكساندرولون | 1:3–1:13 |
| ديكانويت ناندرولون | 1:2.5–1:4 |
للستيرويدات الأندروجينية الابتنائية ، كما يوحي اسمها، نوعان مختلفان ولكن متداخلان من الآثار: ابتنائي، وهذا يعني أنها تعزز عملية الأيض (نمو الخلايا)، و أندروجيني (أو ذكوري)، وهذا يعني أنها تؤثر على نمو الخصائص الذكورية والحفاظ عليها.
بعض الأمثلة على الآثار الابتنائية لهذه الهرمونات هي زيادة تخليق البروتين من الأحماض الأمينية، وزيادة الشهية، وزيادة إعادة تشكيل ونمو العظام، وتحفيز نخاع العظام، مما يزيد من إنتاج خلايا الدم الحمراء. ومن خلال عدد من الآليات، تحفِّز تشكيل خلايا العضلات، وبالتالي تسبب زيادة في حجم العضلات الهيكلية، مما يؤدي إلى زيادة القوة.[68][69][70]
الآثار الذكورية عديدة. اعتمادًا على طول فترة الاستخدام، يمكن أن تكون الآثار الجانبية للستيرويد دائمة. وتشمل العمليات المتضررة: البلوغ، وإنتاج زيت الغدد الدهنية، والجنس (وخاصة في نمو الجنين). بعض الأمثلة على الآثار الذكورية هي نمو البظر في الإناث والقضيب في الأطفال الذكور (بينما لا يتغير في الكبار بسبب المنشطات)، وزيادة حجم الأحبال الصوتية، وزيادة الرغبة الجنسية، وقمع الهرمونات الجنسية الطبيعية، وضعف إنتاج الحيوانات المنوية.[71] وتشمل الآثار على النساء: تعميق الصوت، ونمو شعر الوجه، وربما نقص حجم الثدي.[72]
النسبة الابتنائية:الأندروجينية للستيرويدات هي عامل مهم عند تحديد التطبيق السريري لهذه المركبات. فالمركبات ذات النسبة العالية من الآثار الأندروجينية إلى الآثار الابتنائية هي الدواء المفضل في علاج الاستبدال بالأندروجين (على سبيل المثال، علاج قصور الغدد التناسلية لدى الذكور)، في حين أن المركبات منخفضة النسبة هي المفضلة لعلاج فقر الدم وهشاشة العظام، ولتعويض فقد البروتين التالي للإصابة، والجراحة، أو عدم الحركة لفترات طويلة. يتم تحديد النسبة عادة في الدراسات الحيوانية، الأمر الذي أدى إلى تسويق بعض المركبات بادعاء أن لها نشاط ابتنائي مع آثار ذكورية ضعيفة. وهذا الانفصال أقل وضوحًا في البشر، إذ أن جميعها لها آثار أندروجينية كبيرة.[73]
استخدم بروتوكول شائع لتحديد النسبة الأندروجينية:الابتنائية، يعود تاريخه إلى خمسينات القرن العشرين، الأوزان النسبية للبروستاتا البطنية والعضلات الرافعة للشرج في ذكور الفئران. يشير وزن البروستاتا البطنية للتأثير الذكوري، في حين أن وزن العضلات الرافعة للشرج مؤشر على التأثير الابتنائي. وفي أوائل عام 2000، تم الاتفاق على هذا الإجراء وعُمِّم في جميع أنحاء منظمة التعاون والتنمية في ما يعرف الآن بمقايسة هيرشبيرجر.
تحسين القوة وتكوين الجسم
قد يزيد وزن الجسم في الرجال 2-5 كجم نتيجة استخدام الستيرويدات لفترة قصيرة (<10 أسابيع)، ووجدت الدراسات الحيوانية أيضا أن كتلة الدهون انخفضت، ولكن معظم الدراسات في البشر فشلت في توضيح كميات الدهون. وقد تبين أن الآثار على كتلة الجسم تعتمد على الجرعة. ولوحظ تضخم العضلات وتشكُّل ألياف جديدة للعضلات.
المنطقة العليا من الجسم (الصدر والرقبة والكتفين والجزء العلوي من الذراع) أكثر عرضة لظهور آثار الستيرويدات من مناطق الجسم الأخرى بسبب غلبة المستقبلات الأندروجينية في الجزء العلوي من الجسم. لوحظ الفرق في حجم الألياف العضلية بين مستخدمي الستيرويدات وغير المستخدمين في ألياف العضلة شبه المنحرفة نتيجة تناول هذه العقاقير لفترة طويلة. وبعد توقف التناول، تتلاشى الآثار ببطء، ولكن قد تستمر لأكثر من 6-12 أسبوع.
تكون تحسينات القوة في نطاق 5-20٪ من أساس القوة، اعتمادًا إلى حد كبير على الجرعة المستخدمة وكذلك فترة التعاطي. ولوحظت التحسينات الأكثر أهمية في عضلات الصدر. على مدى ما يقرب من عقدين من الزمان، كان من المفترض أن تكون الآثار الكبيرة فقط في الرياضيين ذوي القوة والخبرة.[74][75] ومع ذلك، أظهرت تجربة عشوائية أنه يمكن تحسين القوة حتى في الرياضيين المبتدئين، عن طريق برنامج تدريب القوة لمدة 10 أسابيع مع تناول إينونثات التستوستيرون 600 ملغ/أسبوع.
الانفصال بين الآثار الابتنائية والأندروجينية
تقوم الستيرويدات الأندروجينة الابتنائية الذاتية أو الطبيعية مثل التستوستيرون و ديهدروتستوستيرون والستيرويدات الاصطناعية بعملها من خلال الارتباط بمستقبلات الأندروجين وتفعيلها. على أساس الاختبارات الحيوية الحيوانية، تم تقسيم آثار هذه العوامل إلى نوعين منفصلين جزئيًا: ابتنائية وأندروجينية. ويُلاحظ الاختلاف بين نسب هذين النوعين من الآثار في الاختبارات البيولوجية على الجرذان بالتستوستيرون. تشمل التفسيرات لهذا الانفصال الاختلافات في عملية التمثيل الغذائي داخل الخلايا، والانتقائية الوظيفية، والآليات غير الجينومية. الدعم للتفسيرين الأخيرين محدود وافتراضي، ولكن هناك قدرًا كبيرًا من الدعم للتفسير القائم على اختلاف الأيض داخل الخلايا.
التفاعل مع مستقبلات غابا
تقوم بعض الستيرويدات مثل التستوستيرون، وديهدروتستوسترون، وستانوزولول، وميثيلتستوستيرون بتعديل مستقبلات غابا على غرار الستيرويدات العصبية الذاتية مثل ألوبريغنانولون، 3α-أندروستانديول، كبريتات ديهيدروبياندروستيرون، وكبريتات بريغنينولون. وقد اقترح أن هذا يمكن أن يسهم كآلية بديلة أو إضافية للآثار العصبية والسلوكية للستيرويدات الأندروجينية الابتنائية.[76][77][78][79][80]
مقارنة الستيرويدات الأندروجينية الابتنائية
5α-ريدكتاز (إنزيم مختزِل) والآثار التذكيرية
يمكن تحويل التستوستيرون بقوة بواسطة 5α-ريدكتاز إلى ديهدروتستوسترون في ما يسمى بالأنسجة المذكرة مثل الجلد وفروة الرأس والبروستاتا والحويصلات المنوية، ولكن ليس في العضلات أو العظام، إذ لا يتم التعبير فيها عن 5α-ريدكتاز.
تُعدّ القدرة على الاستقلاب بواسطة 5α-ريدكتاز ونشاط المستقبلات الأندروجينية لنواتج الأيض الناتجة واحدة من أهم محددات النسبة الأندروجينية-الابتنائية لستيرويد معين. الستيرويدات التي لا تُقوَّى بواسطة 5α-ريدكتاز أو التي ضُعِّفت من قِبَل 5α-ريدكتاز في الأنسجة الأندروجينية لديها نسبة خطر أقل للآثار الجانبية الذكورية مثل حب الشباب، والصلع الأندروجيني (نمط الصلع في الذكور)، والشعرانية (نمو الشعر المفرط بالنمط الذكوري) ، وتضخم البروستاتا الحميد، وسرطان البروستاتا، في حين لايوجد فرق في حدوث ومدى ضخامة الآثار الأخرى مثل تضخم العضلات، وتغيرات العظام،[81] وتعميق الصوت، والتغيرات في الرغبة الجنسية.[82]
أروماتاز والآثار الإستروجينية (الإيداق)
يمكن استقلاب التستوستيرون بواسطة أروماتاز إلى استراديول، وكذلك يمكن استقلاب العديد من الستيرويدات الأخرى إلى المستقلبات الإستروجينية المقابلة. على سبيل المثال، يتم تحويل 17α-ألكيلاتد ميثيلتستوستيرون وميتاندينون بواسطة أروماتاز إلى ميثيلستراديول.[83] والذي يكون ذي آثار إستروجينية أكبر بالمقارنة مع التستوستيرون.
التأثير الرئيسي للإيداق هو التثدي. تظهر الستيرويدات التي لديها قابلية عالية للإنزيم أروماتاز مثل التستوستيرون وخاصةً ميثيلتستوستيرون مخاطر عالية للتثدي، في حين أن الستيرويدات التي لديها احتمالية منخفضة للأروماتاز مثل ناندرولون تُظهر خطر أقل بكثير (خطرها كبير بالجرعات العالية).[84] وبعض الستيرويدات الأخرى (على سبيل المثال، 11β-ميثيليتد 19-مشتقات نورتيستوستيرون)، ليس لديهم خطر التثدي.[85] بالإضافة إلى التثدي، هذه الستيرويدات عالية الإيداق لديها نشاط زائد مضاد موجهة الغدد التناسلية، مما يؤدي إلى زيادة قوة قمع محور المهاد والغدة النخامية والغدد التناسلية وإنتاج التستوستيرون من الغدد التناسلية.
النشاط البروجستيروني
العديد من مشتقات 19-نورتيستوستيرون، بما في ذلك ناندرولون، ترينبولون، إيثيل إسترينول (إيثيلناندرول)، ميتريبولون، تريستولون، ديميثاندرولون، وغيرها، هي منبهات قوية لمستقبلات هرمون البروجستيرون.[86] وكما في حالة النشاط الإستروجيني، يعمل النشاط البروجستيروني لهذه الأدوية على زيادة نشاط مضاد موجهة الغدد التناسلية. يؤدي هذا إلى زيادة فعالية الستيرويدات كموانع حمل ذكرية.
نشاط الستيرويدات المُتناوَلة عن طريق الفم وتسمم الكبد
مشتقات التستوستيرون والتستوستيرون نفسه، وديهدروتستوستيرون، وناندرولون كلهم ضعيفي الحيوية البيولوجية عن طريق الفم نظرًا للمرور بالأيض الكبدي أولًا، وبالتالي لا تكون نشطة. ومن الاستثناءات الملحوظة من هذا النوع هي أمهات الأندروجين أو طلائع الهرمونات، بما في ذلك ديهيدروبياندروستيرون، أندروستينديول، أندروستينيديون، بولديون، بولانديول، بولانديون، ديينديون، مينتابولان، و ميثوكسيدينون.[87][88] تستخدم الستيرويدات غير النشطة عن طريق الفم حصرًا تقريبًا في شكل استرات تُعطى عن طريق الحقن العضلي، والتي تعمل كمقدمة دواء طويلة المفعول. وتشمل الأمثلة التستوستيرون، كسيبيونات التستوستيرون، وإينونثات التستوستيرون، وبروبيونات التستوستيرون، والناندرولون، كفينيلبروبيونات الناندرولون و ديكانوات الناندرولون. بالإضافة إلى النشاط عن طريق الفم، تؤدي هذه الستيرويدات بشكلٍ عالٍ لتسمم الكبد، وإن كان غير شائع ويكون فقط بعد الاستعمال لفترات طويلة.[89][90] في المقابل،[91][92] لم ترتبط استرات هرمون التستوستيرون بتسمم الكبد، على الرغم من أن الاستخدام على المدى الطويل قد يزيد من خطر التغيرات الكبدية.[93][94]
نشاط الستيرويد العصبي
ديهيدروتستوستيرون، عن طريق مستقلبه 3α-أندروستانديول (التي تنتجها نازعة هيدروجين 3α هيدروكسيستيرويد)، هو ستيرويد عصبي يعمل عن طريق تعديل إيجابي لمستقبل جابا. يُنتج التستوستيرون، عن طريق التحول إلى ديهيدروتستوستيرون، أيضًا 3α-أندروستانديول كمستقلب، وهذا قد يساهم كآلية بديلة أو إضافية للآثار على الجهاز العصبي المركزي في المزاج، والقلق، والعدوان، والدافع الجنسي.[95]
الكيمياء
الستيرويدات الأندروجينية الابتنائية هي أندروستان أو إستران المنشطات ومشتقات التستوستيرون مع تعديلات مختلفة في التركيب.
الكشف في سوائل الجسم
أكثر العينات الفسيولوجية البشرية المستخدمة للكشف عن استخدام الستيرويدات هو البول، على الرغم من أن كلًا من الدم والشعر يحققان هذا الغرض. تخضع الستيرويدات سواء ذاتية أو خارجية، للتحول البيولوجي الكبدي واسع النطاق من قِبَل مجموعة متنوعة من المسارات الإنزيمية. يمكن أن تكون الأيضات البولية الأولية قابلة للكشف لمدة تصل إلى 30 يوم بعد الاستخدام الأخير، اعتمادًا على عوامل معينة مثل الجرعة وطريقة التناول. وهناك عدد من الأدوية لها مسارات أيض مشتركة، وقد يتداخل إفرازها مع المنشطات الذاتية، مما يجعل تفسير نتائج الاختبار تحديًا كبيرًا جدًا للكيميائي التحليلي. عادة ما تشمل طرق الكشف عن المواد أو نواتج إفرازها في عينات البول على الاستشراب الغازي-مطياف الكتلة أو الاستشراب السائل-مطياف الكتلة.[96][97][98][99]
التاريخ
استخلاص الأندروجين من الغدد التناسلية
سبق استخدام المنشطات من الغدد التناسلية تحديد هويتهم وعزلهم. بدأ الاستخدام الطبي لمستخرج الخصية في أواخر القرن التاسع عشر في حين أن آثاره على القوة لا تزال قيد الدراسة. ويمكن أن يرجع عزل المنشطات من الغدد التناسلية إلى عام 1931، عندما قام أدولف بوتيناندت، وهو كيميائي من ماربورغ، بتنقية 15 ملليغرام من هرمون الذكور أندروستينون من عشرات آلاف اللترات من البول. تم تصنيع هذا الستيرويد في وقتً لاحق في عام 1934 من قِبَل ليوبولد روزيكا، كيميائي من زيوريخ.
في الثلاثينات، كان من المعروف بالفعل أن الخصيتين تحتويان على أندروجين أقوى من أندروستينون، وتسابقت ثلاث مجموعات من العلماء، بتمويل من شركات الأدوية المتنافسة في هولندا وألمانيا وسويسرا لعزلها.[100][101][102][103][104] وقد تم تحديد هذا الهرمون لأول مرة بواسطة كارولي جيولا ديفيد، ودينجيمانز، وفرويد وإرنست لاكور في ورقة بحثية مايو 1935. أسموا هرمون التستوستيرون "هرمون الذكورة البلوري من الخصيتين (التستوستيرون)". وقد تحقق التركيب الكيميائي للهرمون تستوستيرون في أغسطس من ذلك العام، عندما نشرت بوتيناندت وهانيش ورقة تصف "طريقة لإعداد هرمون التستوستيرون". بعد أسبوع واحد فقط، أعلنت المجموعة الثالثة، روزيكا وويتستين، عن طلب براءة في ورقة بعنوان "التحضير الاصطناعي لهرمون التستوستيرون الخصي". وقد عُرِض على روزيكا وبوتيناندت جائزة نوبل في الكيمياء لعام 1939 على عملهما، لكن الحكومة النازية أجبرت بوتيناندت على رفض شرف الجائزة، على الرغم من أنه قبل الجائزة بعد نهاية الحرب العالمية الثانية.
بدأت التجارب السريرية على البشر، التي تنطوي على جرعات عن طريق الفم من ميثيلتيستوستيرون أو حقن هرمون بروبيونات التستوستيرون، في وقت مبكر من عام 1937. وكثيرًا ما وردت تقارير عن شائعات بأن الجنود الألمان كانوا يتعاطون الستيرويدات الأندروجينية الابتنائية خلال الحرب العالمية الثانية، بهدف زيادة عدوانهم وقدرتهم على التحمل، ولكن لم يثبت هذا حتى الآن. حُقِن أدولف هتلر نفسه،[105] وِفقًا لطبيبه، بمشتقات التستوستيرون لعلاج أمراض مختلفة. استُخدمت الستيرويدات في التجارب التي أجراها النازيون على سجناء معسكرات الاعتقال، وفي وقتٍ لاحق من قِبل الحلفاء الذين حاولوا علاج الضحايا الذين يعانون من سوء التغذية بعد أن نجوا من المخيمات النازية. وكان الرئيس جون كينيدي يتلقى الستيرويدات قبل وأثناء رئاسته.[106]
تطوير الستيرويدات الأندروجينية الابتنائية الاصطناعية
تم تطوير خصائص بناء العضلات للتستوستيرون في الأربعينات، في الاتحاد السوفيتي وفي بلدان الكتلة الشرقية مثل ألمانيا الشرقية، حيث استُخدمت برامج الستيرويد لتعزيز الأداء الأولمبي وغيرها من رافعي الأثقال. واستجابة لنجاح رافعي الأثقال الروس، عمل طبيب الفريق الأولمبي جون زيجلر مع الكيميائيين لتطوير ستيرويدات اصطناعية ذات آثار أندروجينية مُخفَّضة.[107][108] أدى عمل زيغلر إلى إنتاج ميثاندروستينولون، والذي سوقته سيبا للأدوية كديانابول. تمت الموافقة على الستيرويد الجديد للاستخدام في الولايات المتحدة من قبل إدارة الغذاء والدواء في عام 1958. وكان الأكثر شيوعًا استخدامه لضحايا الحرق وكبار السن. وكان أغلب المستخدمين دون وصف الطبيب من لاعبي كمال الأجسام ورافعي الأثقال. على الرغم من وصف زيغلر لجرعات صغيرة فقط للرياضيين، وقال أنه سرعان ما اكتشف أن أولئك الذين يسيئون ديانابول عانوا من توسع البروستاتا وضمور الخصيتين. تم وضع الستيرويدات الأندروجينية الابتنائية على قائمة المواد المحظورة في اللجنة الأولمبية الدولية في عام 1976، وبعد عقد من الزمان أضافت اللجنة اختبارات المنشطات "خارج المنافسة" لأن العديد من الرياضيين يستخدمونها في فترة التدريب بدلًا من أثناء المنافسة.
مراجع
- ^ Kicman، A T (2008). "Pharmacology of anabolic steroids". British Journal of Pharmacology. ج. 154 ع. 3: 502–521. DOI:10.1038/bjp.2008.165. PMC:2439524. PMID:18500378.
- ^ Powers، Michael (2011). Houglum، Joel؛ Harrelson، Gary L. (المحررون). Performance-Enhancing Drugs (ط. 2nd). SLACK Incorporated. ص. 345. ISBN:978-1-55642-901-9.
{{استشهاد بكتاب}}:|work=تُجوهل (مساعدة) والوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Barrett-Connor EL (1995). "Testosterone and risk factors for cardiovascular disease in men". Diabete Metab. ج. 21 ع. 3: 156–61. PMID:7556805.
- ^ Yamamoto Y، Moore R، Hess HA، Guo GL، Gonzalez FJ، Korach KS، Maronpot RR، Negishi M (2006). "Estrogen receptor alpha mediates 17alpha-ethynylestradiol causing hepatotoxicity". J Biol Chem. ج. 281 ع. 24: 16625–31. DOI:10.1074/jbc.M602723200. PMID:16606610.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ De Piccoli B، Giada F، Benettin A، Sartori F، Piccolo E (1991). "Anabolic steroid use in body builders: an echocardiographic study of left ventricle morphology and function". Int J Sports Med. ج. 12 ع. 4: 408–12. DOI:10.1055/s-2007-1024703. PMID:1917226.
- ^ Hartgens F، Kuipers H (2004). "Effects of androgenic-anabolic steroids in athletes". Sports Med. ج. 34 ع. 8: 513–54. DOI:10.2165/00007256-200434080-00003. PMID:15248788.
- ^ Basaria S، Wahlstrom JT، Dobs AS (نوفمبر 2001). "Clinical review 138: Anabolic-androgenic steroid therapy in the treatment of chronic diseases". J. Clin. Endocrinol. Metab. ج. 86 ع. 11: 5108–17. DOI:10.1210/jcem.86.11.7983. PMID:11701661.
- ^ Ranke MB، Bierich JR (1986). "Treatment of growth hormone deficiency". Clinics in endocrinology and metabolism. ج. 15 ع. 3: 495–510. DOI:10.1016/S0300-595X(86)80008-1. PMID:2429792.
- ^ Grunfeld C، Kotler DP، Dobs A، Glesby M، Bhasin S (2006). "Oxandrolone in the treatment of HIV-associated weight loss in men: a randomized, double-blind, placebo-controlled study". J. Acquir. Immune Defic. Syndr. ج. 41 ع. 3: 304–14. DOI:10.1097/01.qai.0000197546.56131.40. PMID:16540931.
- ^ Berger JR، Pall L، Hall CD، Simpson DM، Berry PS، Dudley R (1996). "Oxandrolone in AIDS-wasting myopathy". AIDS. ج. 10 ع. 14: 1657–62. DOI:10.1097/00002030-199612000-00010. PMID:8970686.
- ^ Arslanian S، Suprasongsin C (1997). "Testosterone treatment in adolescents with delayed puberty: changes in body composition, protein, fat, and glucose metabolism". J. Clin. Endocrinol. Metab. ج. 82 ع. 10: 3213–20. DOI:10.1210/jc.82.10.3213. PMID:9329341.
- ^ Aribarg A، Sukcharoen N، Chanprasit Y، Ngeamvijawat J، Kriangsinyos R (1996). "Suppression of spermatogenesis by testosterone enanthate in Thai men". Journal of the Medical Association of Thailand = Chotmaihet thangphaet. ج. 79 ع. 10: 624–9. PMID:8996996.
- ^ Kenny AM، Prestwood KM، Gruman CA، Marcello KM، Raisz LG (2001). "Effects of transdermal testosterone on bone and muscle in older men with low bioavailable testosterone levels". J. Gerontol. A Biol. Sci. Med. Sci. ج. 56 ع. 5: M266–72. DOI:10.1093/gerona/56.5.M266. PMID:11320105.
- ^ Baum NH، Crespi CA (2007). "Testosterone replacement in elderly men". Geriatrics. ج. 62 ع. 9: 14–8. PMID:17824721.
- ^ Francis RM (2001). "Androgen replacement in aging men". Calcif. Tissue Int. ج. 69 ع. 4: 235–8. DOI:10.1007/s00223-001-1051-9. PMID:11730258.
- ^ Shah K، Montoya C، Persons RK (أبريل 2007). "Clinical inquiries. Do testosterone injections increase libido for elderly hypogonadal patients?". J Fam Pract. ج. 56 ع. 4: 301–3. PMID:17403329.
- ^ Yassin AA، Saad F (مارس 2007). "Improvement of sexual function in men with late-onset hypogonadism treated with testosterone only". J Sex Med. ج. 4 ع. 2: 497–501. DOI:10.1111/j.1743-6109.2007.00442.x. PMID:17367445.
- ^ Arver S، Dobs AS، Meikle AW، Caramelli KE، Rajaram L، Sanders SW، Mazer NA (ديسمبر 1997). "Long-term efficacy and safety of a permeation-enhanced testosterone transdermal system in hypogonadal men". Clin. Endocrinol. (Oxf). ج. 47 ع. 6: 727–37. DOI:10.1046/j.1365-2265.1997.3071113.x. PMID:9497881.
- ^ Nieschlag E، Büchter D، Von Eckardstein S، Abshagen K، Simoni M، Behre HM (ديسمبر 1999). "Repeated intramuscular injections of testosterone undecanoate for substitution therapy in hypogonadal men". Clin. Endocrinol. (Oxf). ج. 51 ع. 6: 757–63. DOI:10.1046/j.1365-2265.1999.00881.x. PMID:10619981.
- ^ Gething AD، Grace FM، Davies B، Baker JS (أكتوبر–ديسمبر 2011). "Effects of Long-Term Anabolic Androgenic Steroid Administration on Respiratory Function". Research in Sports Medicine. ج. 19 ع. 4: 231–244. DOI:10.1080/15438627.2011.608034. PMID:21988266.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|doi_brokendate=تم تجاهله يقترح استخدام|doi-broken-date=(مساعدة) - ^ "Most steroid users are not athletes: study". Reuters. 21 نوفمبر 2007. اطلع عليه بتاريخ 2014-01-03.
- ^ Sjöqvist F، Garle M، Rane A (مايو 2008). "Use of doping agents, in particular anabolic steroids, in sports and society". Lancet. ج. 371 ع. 9627: 1872–82. DOI:10.1016/S0140-6736(08)60801-6. PMID:18514731.
- ^ Yesalis CE، Kennedy NJ، Kopstein AN، Bahrke MS (1993). "Anabolic-androgenic steroid use in the United States". JAMA. ج. 270 ع. 10: 1217–21. DOI:10.1001/jama.270.10.1217. PMID:8355384.
- ^ McCabe SE، Brower KJ، West BT، Nelson TF، Wechsler H (2007). "Trends in non-medical use of anabolic steroids by U.S. college students: Results from four national surveys". Drug and Alcohol Dependence. ج. 90 ع. 2–3: 243–51. DOI:10.1016/j.drugalcdep.2007.04.004. PMC:2383927. PMID:17512138.
- ^ Parkinson AB، Evans NA (أبريل 2006). "Anabolic androgenic steroids: a survey of 500 users". Med Sci Sports Exerc. ج. 38 ع. 4: 644–51. DOI:10.1249/01.mss.0000210194.56834.5d. PMID:16679978.
- ^ Copeland J، Peters R، Dillon P (مارس 1998). "A study of 100 anabolic-androgenic steroid users". Med. J. Aust. ج. 168 ع. 6: 311–2. PMID:9549549.
- ^ Kanayama G، Barry S، Hudson JI، Pope HG (أبريل 2006). "Body image and attitudes toward male roles in anabolic-androgenic steroid users". Am J Psychiatry. ج. 163 ع. 4: 697–703. DOI:10.1176/appi.ajp.163.4.697. PMID:16585446.
- ^ Grogan S، Shepherd S، Evans R، Wright S، Hunter G (نوفمبر 2006). "Experiences of Anabolic Steroid Use". Journal of Health Psychology. ج. 11 ع. 6: 845–856. DOI:10.1177/1359105306069080. PMID:17035257.
- ^ Hickson RC، Czerwinski SM، Falduto MT، Young AP (1990). "Glucocorticoid antagonism by exercise and androgenic-anabolic steroids". Medicine and science in sports and exercise. ج. 22 ع. 3: 331–40. DOI:10.1249/00005768-199006000-00010. PMID:2199753.
- ^ Kicman AT، Gower DB (يوليو 2003). "Anabolic steroids in sport: biochemical, clinical and analytical perspectives". Ann. Clin. Biochem. ج. 40 ع. Pt 4: 321–56. DOI:10.1258/000456303766476977. PMID:12880534.

- ^ Mutzebaugh C (1998). "Does the choice of alpha-AAS really make a difference?". HIV Hotline. ج. 8 ع. 5–6: 10–1. PMID:11366379.
- ^ Becker، Kenneth L. (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. ص. 1185–1186. ISBN:978-0-7817-1750-2.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Nutt D، King LA، Saulsbury W، Blakemore C (مارس 2007). "Development of a rational scale to assess the harm of drugs of potential misuse". Lancet. ج. 369 ع. 9566: 1047–53. DOI:10.1016/S0140-6736(07)60464-4. PMID:17382831.
- ^ Trenton AJ، Currier GW (2005). "Behavioural manifestations of anabolic steroid use". CNS Drugs. ج. 19 ع. 7: 571–95. DOI:10.2165/00023210-200519070-00002. PMID:15984895.
- ^ Kanayama G، Hudson JI، Pope HG (نوفمبر 2008). "Long-Term Psychiatric and Medical Consequences of Anabolic-Androgenic Steroid Abuse: A Looming Public Health Concern?". Drug Alcohol Depend. ج. 98 ع. 1–2: 1–12. DOI:10.1016/j.drugalcdep.2008.05.004. PMC:2646607. PMID:18599224.
- ^ Brower KJ (أكتوبر 2002). "Anabolic steroid abuse and dependence". Curr Psychiatry Rep. ج. 4 ع. 5: 377–87. DOI:10.1007/s11920-002-0086-6. PMID:12230967.
- ^ Pagonis TA، Angelopoulos NV، Koukoulis GN، Hadjichristodoulou CS (2006). "Psychiatric side effects induced by supraphysiological doses of combinations of anabolic steroids correlate to the severity of abuse". Eur. Psychiatry. ج. 21 ع. 8: 551–62. DOI:10.1016/j.eurpsy.2005.09.001. PMID:16356691.
- ^ Grace F، Sculthorpe N، Baker J، Davies B (2003). "Blood pressure and rate pressure product response in males using high-dose anabolic-androgenic steroids (AAS)". J Sci Med Sport. ج. 6 ع. 3: 307–12. DOI:10.1016/S1440-2440(03)80024-5. PMID:14609147.
- ^ "DailyMed: About DailyMed". Dailymed.nlm.nih.gov. اطلع عليه بتاريخ 2008-11-03.
- ^ Bagatell CJ، Knopp RH، Vale WW، Rivier JE، Bremner WJ (1992). "Physiologic testosterone levels in normal men suppress high-density lipoprotein cholesterol levels". Annals of Internal Medicine. ج. 116 ع. 12 Pt 1: 967–73. DOI:10.7326/0003-4819-116-12-967. PMID:1586105.
- ^ Mewis C، Spyridopoulos I، Kühlkamp V، Seipel L (1996). "Manifestation of severe coronary heart disease after anabolic drug abuse". Clinical Cardiology. ج. 19 ع. 2: 153–5. DOI:10.1002/clc.4960190216. PMID:8821428.
- ^ Melnik B، Jansen T، Grabbe S (2007). "Abuse of anabolic-androgenic steroids and bodybuilding acne: an underestimated health problem". Journal der Deutschen Dermatologischen Gesellschaft = Journal of the German Society of Dermatology : JDDG. ج. 5 ع. 2: 110–7. DOI:10.1111/j.1610-0387.2007.06176.x. PMID:17274777.
- ^ Vierhapper H، Maier H، Nowotny P، Waldhäusl W (يوليو 2003). "Production rates of testosterone and of dihydrotestosterone in female pattern hair loss". Metab. Clin. Exp. ج. 52 ع. 7: 927–9. DOI:10.1016/S0026-0495(03)00060-X. PMID:12870172.
- ^ Irving LM، Wall M، Neumark-Sztainer D، Story M (2002). "Steroid use among adolescents: findings from Project EAT". The Journal of Adolescent Health. ج. 30 ع. 4: 243–52. DOI:10.1016/S1054-139X(01)00414-1. PMID:11927236.
- ^ "Known and Probable Human Carcinogens". American Cancer Society. 29 يونيو 2011.
- ^ Sullivan ML، Martinez CM، Gallagher EJ (1999). "Atrial fibrillation and anabolic steroids". The Journal of emergency medicine. ج. 17 ع. 5: 851–7. DOI:10.1016/S0736-4679(99)00095-5. PMID:10499702.
- ^ Dickerman RD، Schaller F، McConathy WJ (1998). "Left ventricular wall thickening does occur in elite power athletes with or without anabolic steroid Use". Cardiology. ج. 90 ع. 2: 145–8. DOI:10.1159/000006834. PMID:9778553.
- ^ George KP، Wolfe LA، Burggraf GW (1991). "The 'athletic heart syndrome'. A critical review". Sports medicine (Auckland, N.Z.). ج. 11 ع. 5: 300–30. DOI:10.2165/00007256-199111050-00003. PMID:1829849.
- ^ Dickerman RD، Schaller F، Zachariah NY، McConathy WJ (1997). "Left ventricular size and function in elite bodybuilders using anabolic steroids". Clin J Sport Med. ج. 7 ع. 2: 90–3. DOI:10.1097/00042752-199704000-00003. PMID:9113423.
- ^ Salke RC، Rowland TW، Burke EJ (1985). "Left ventricular size and function in body builders using anabolic steroids". Medicine and science in sports and exercise. ج. 17 ع. 6: 701–4. DOI:10.1249/00005768-198512000-00014. PMID:4079743.
- ^ Tokar، Steve (فبراير 2006). "Liver Damage And Increased Heart Attack Risk Caused By Anabolic Steroid Use". University of California – San Francisco. اطلع عليه بتاريخ 2007-04-24.
- ^ Wit JM، Oostdijk W (2015). "Novel approaches to short stature therapy". Best Practice & Research. Clinical Endocrinology & Metabolism. ج. 29 ع. 3: 353–66. DOI:10.1016/j.beem.2015.01.003. PMID:26051296.
- ^ Marcus R، Korenman SG (1976). "Estrogens and the human male". Annu Rev Med. ج. 27: 357–70. DOI:10.1146/annurev.me.27.020176.002041. PMID:779604.
- ^ Matsumoto AM (1990). "Effects of chronic testosterone administration in normal men: safety and efficacy of high dosage testosterone and parallel dose-dependent suppression of luteinizing hormone, follicle-stimulating hormone, and sperm production". J. Clin. Endocrinol. Metab. ج. 70 ع. 1: 282–7. DOI:10.1210/jcem-70-1-282. PMID:2104626.
- ^ Hoffman JR، Ratamess NA (1 يونيو 2006). "Medical Issues Associated with Anabolic Steroid Use: Are they Exaggerated?" (PDF). Journal of Sports Science and Medicine. مؤرشف من الأصل (PDF) في 2007-06-20. اطلع عليه بتاريخ 2007-05-08.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Meriggiola MC، Costantino A، Bremner WJ، Morselli-Labate AM (2002). "Higher testosterone dose impairs sperm suppression induced by a combined androgen-progestin regimen". J. Androl. ج. 23 ع. 5: 684–90. PMID:12185103.
- ^ Alén M، Reinilä M، Vihko R (1985). "Response of serum hormones to androgen administration in power athletes". Medicine and science in sports and exercise. ج. 17 ع. 3: 354–9. DOI:10.1249/00005768-198506000-00009. PMID:2991700.
- ^ Franke، W. W.؛ Berendonk، B (1997). "Hormonal doping and androgenization of athletes: A secret program of the German Democratic Republic government". Clinical chemistry. ج. 43 ع. 7: 1262–79. PMID:9216474.
- ^ Manikkam M، Crespi EJ، Doop DD، Herkimer C، Lee JS، Yu S، Brown MB، Foster DL، Padmanabhan V (فبراير 2004). "Fetal programming: prenatal testosterone excess leads to fetal growth retardation and postnatal catch-up growth in sheep". Endocrinology. ج. 145 ع. 2: 790–8. DOI:10.1210/en.2003-0478. PMID:14576190.
- ^ Herlitz، Leal C.؛ Markowitz، Glen S.؛ Farris، Alton B.؛ Schwimmer، Joshua A.؛ Stokes، Michael B.؛ Kunis، Cheryl؛ Colvin، Robert B.؛ D'Agati، Vivette D. (29 أكتوبر 2009). Development of FSGS Following Anabolic Steroid Use in Bodybuilders (PDF). 42nd Annual Meeting and Scientific Exposition of the American Society of Nephrology. "Bodybuilding With Steroids Damages Kidneys".
{{استشهاد بمنشورات مؤتمر}}: الوسيط غير المعروف|laydate=تم تجاهله (مساعدة)، الوسيط غير المعروف|laysource=تم تجاهله (مساعدة)، الوسيط غير المعروف|laysummary=تم تجاهله (مساعدة)، والوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Pereira de Jésus-Tran K، Côté PL، Cantin L، Blanchet J، Labrie F، Breton R (2006). "Comparison of crystal structures of human androgen receptor ligand-binding domain complexed with various agonists reveals molecular determinants responsible for binding affinity". Protein Sci. ج. 15 ع. 5: 987–99. DOI:10.1110/ps.051905906. PMC:2242507. PMID:16641486.
- ^ Lavery DN، McEwan IJ (2005). "Structure and function of steroid receptor AF1 transactivation domains: induction of active conformations". Biochem. J. ج. 391 ع. Pt 3: 449–64. DOI:10.1042/BJ20050872. PMC:1276946. PMID:16238547.
- ^ Cheskis BJ (2004). "Regulation of cell signalling cascades by steroid hormones". J. Cell. Biochem. ج. 93 ع. 1: 20–7. DOI:10.1002/jcb.20180. PMID:15352158.
- ^ Roselli CE (1998). "The effect of anabolic-androgenic steroids on aromatase activity and androgen receptor binding in the rat preoptic area". Brain Res. ج. 792 ع. 2: 271–6. DOI:10.1016/S0006-8993(98)00148-6. PMID:9593936.
- ^ Brodsky IG، Balagopal P، Nair KS (1996). "Effects of testosterone replacement on muscle mass and muscle protein synthesis in hypogonadal men—a clinical research center study". J. Clin. Endocrinol. Metab. ج. 81 ع. 10: 3469–75. DOI:10.1210/jc.81.10.3469. PMID:8855787.
- ^ Hickson RC، Czerwinski SM، Falduto MT، Young AP (1990). "Glucocorticoid antagonism by exercise and androgenic-anabolic steroids". Med Sci Sports Exerc. ج. 22 ع. 3: 331–40. DOI:10.1249/00005768-199006000-00010. PMID:2199753.
- ^ Singh R، Artaza JN، Taylor WE، Gonzalez-Cadavid NF، Bhasin S (2003). "Androgens stimulate myogenic differentiation and inhibit adipogenesis in C3H 10T1/2 pluripotent cells through an androgen receptor-mediated pathway". Endocrinology. ج. 144 ع. 11: 5081–8. DOI:10.1210/en.2003-0741. PMID:12960001.
- ^ Schroeder ET، Vallejo AF، Zheng L، Stewart Y، Flores C، Nakao S، Martinez C، Sattler FR (2005). "Six-week improvements in muscle mass and strength during androgen therapy in older men". J Gerontol a Biol Sci Med Sci. ج. 60 ع. 12: 1586–92. DOI:10.1093/gerona/60.12.1586. PMID:16424293.
- ^ Grunfeld C، Kotler DP، Dobs A، Glesby M، Bhasin S (2006). "Oxandrolone in the treatment of HIV-associated weight loss in men: a randomized, double-blind, placebo-controlled study". J Acquir Immune Defic Syndr. ج. 41 ع. 3: 304–14. DOI:10.1097/01.qai.0000197546.56131.40. PMID:16540931.
- ^ Giorgi A، Weatherby RP، Murphy PW (1999). "Muscular strength, body composition and health responses to the use of testosterone enanthate: a double blind study". Journal of science and medicine in sport / Sports Medicine Australia. ج. 2 ع. 4: 341–55. DOI:10.1016/S1440-2440(99)80007-3. PMID:10710012.
- ^ Kuhn CM (2002). "Anabolic steroids". Recent Prog. Horm. Res. ج. 57: 411–34. DOI:10.1210/rp.57.1.411. PMID:12017555.
- ^ "How Anabolic Steroids Alter Both Men And Women". casapalmera.com. اطلع عليه بتاريخ 2014-01-02.
{{استشهاد ويب}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Chrousos، George P. (2012). "The Gonadal Hormones & Inhibitors". في Katzung، Bertram G. (المحرر). Basic & Clinical Pharmacology. New York London: McGraw-Hill Medical McGraw-Hill distributor. ISBN:0071764011.
- ^ Hervey GR، Hutchinson I، Knibbs AV، Burkinshaw L، Jones PR، Norgan NG، Levell MJ (أكتوبر 1976). ""Anabolic" effects of methandienone in men undergoing athletic training". Lancet. ج. 2 ع. 7988: 699–702. DOI:10.1016/S0140-6736(76)90001-5. PMID:61389.

- ^ Hervey GR، Knibbs AV، Burkinshaw L، Morgan DB، Jones PR، Chettle DR، Vartsky D (أبريل 1981). "Effects of methandienone on the performance and body composition of men undergoing athletic training". Clin. Sci. ج. 60 ع. 4: 457–61. PMID:7018798.
- ^ Bitran D، Kellogg CK، Hilvers RJ (1993). "Treatment with an anabolic-androgenic steroid affects anxiety-related behavior and alters the sensitivity of cortical GABAA receptors in the rat". Horm Behav. ج. 27 ع. 4: 568–83. DOI:10.1006/hbeh.1993.1041. PMID:8294123.
- ^ Masonis AE، McCarthy MP (1995). "Direct effects of the anabolic/androgenic steroids, stanozolol and 17α-methyltestosterone, on benzodiazepine binding to the γ-aminobutyric acidA receptor". Neurosci. Lett. ج. 189 ع. 1: 35–8. DOI:10.1016/0304-3940(95)11445-3. PMID:7603620.
- ^ Rivera-Arce JC، Morales-Crespo L، Vargas-Pinto N، Velázquez KT، Jorge JC (2006). "Central effects of the anabolic steroid 17alpha methyltestosterone in female anxiety". Pharmacol. Biochem. Behav. ج. 84 ع. 2: 275–81. DOI:10.1016/j.pbb.2006.05.009. PMID:16814373.
- ^ Henderson LP (2007). "Steroid modulation of GABAA receptor-mediated transmission in the hypothalamus: effects on reproductive function". Neuropharmacology. ج. 52 ع. 7: 1439–53. DOI:10.1016/j.neuropharm.2007.01.022. PMC:1985867. PMID:17433821.
- ^ Schwartzer JJ، Ricci LA، Melloni RH (2009). "Interactions between the dopaminergic and GABAergic neural systems in the lateral anterior hypothalamus of aggressive AAS-treated hamsters". Behav. Brain Res. ج. 203 ع. 1: 15–22. DOI:10.1016/j.bbr.2009.04.007. PMID:19376158.
- ^ Orwoll, Eric S.؛ Bilezikian, John P.؛ Vanderschueren, Dirk (30 نوفمبر 2009). Osteoporosis in Men: The Effects of Gender on Skeletal Health. Academic Press. ص. 296–. ISBN:978-0-08-092346-8.
- ^ Fillit, Howard M.؛ Rockwood, Kenneth؛ Woodhouse, Kenneth (10 مايو 2010). Brocklehurst's Textbook of Geriatric Medicine and Gerontology. Elsevier Health Sciences. ص. 166–167. ISBN:1-4377-2075-7.
- ^ Thieme, Detlef؛ Hemmersbach, Peter (18 ديسمبر 2009). Doping in Sports. Springer Science & Business Media. ص. 470–. ISBN:978-3-540-79088-4.
- ^ Attardi BJ، Pham TC، Radler LC، Burgenson J، Hild SA، Reel JR (يونيو 2008). "Dimethandrolone (7,11β-dimethyl-19-nortestosterone) and 11β-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase". The Journal of Steroid Biochemistry and Molecular Biology. ج. 110 ع. 3–5: 214–22. DOI:10.1016/j.jsbmb.2007.11.009. PMC:2575079. PMID:18555683.
- ^ Llewellyn, William (2011). Anabolics. Molecular Nutrition Llc. ص. 533–. ISBN:978-0-9828280-1-4.
- ^ Attardi BJ، Hild SA، Reel JR (يونيو 2006). "Dimethandrolone undecanoate: a new potent orally active androgen with progestational activity". Endocrinology. ج. 147 ع. 6: 3016–26. DOI:10.1210/en.2005-1524. PMID:16497801.
- ^ Warren, Michelle P.؛ Constantini, Naama W. (1 مايو 2000). Sports Endocrinology. Springer Science & Business Media. ص. 458–. ISBN:978-1-59259-016-2.
- ^ Haff, G. Gregory؛ Triplett, N. Travis (23 سبتمبر 2015). Essentials of Strength Training and Conditioning 4th Edition. Human Kinetics. ص. 233–. ISBN:978-1-4925-0162-6.
- ^ Karch, Steven B.؛ Drummer, Olaf (26 ديسمبر 2001). Karch's Pathology of Drug Abuse, Third Edition. CRC Press. ص. 489–. ISBN:978-1-4200-4211-5.
- ^ van Amsterdam J، Opperhuizen A، Hartgens F (2010). "Adverse health effects of anabolic-androgenic steroids". Regul. Toxicol. Pharmacol. ج. 57 ع. 1: 117–23. DOI:10.1016/j.yrtph.2010.02.001. PMID:20153798.
- ^ Wilson JD (1988). "Androgen abuse by athletes". Endocr. Rev. ج. 9 ع. 2: 181–99. DOI:10.1210/edrv-9-2-181. PMID:3042375.
- ^ Jameson, J. Larry؛ De Groot, Leslie J. (25 فبراير 2015). Endocrinology: Adult and Pediatric. Elsevier Health Sciences. ص. 2391–. ISBN:978-0-323-32195-2.
- ^ Nieschlag, Eberhard؛ Behre, Hermann M.؛ Nieschlag, Susan (26 يوليو 2012). Testosterone: Action, Deficiency, Substitution. Cambridge University Press. ص. 374–. ISBN:978-1-107-01290-5.
- ^ Cameron, Ross؛ Feuer, George؛ de la Iglesia, Felix (6 ديسمبر 2012). Drug-Induced Hepatotoxicity. Springer Science & Business Media. ص. 166–. ISBN:978-3-642-61013-4.
- ^ Masonis AE، McCarthy MP (1996). "Effects of the androgenic/anabolic steroid stanozolol on GABAA receptor function: GABA-stimulated 36Cl− influx and [35S] TBPS binding". J. Pharmacol. Exp. Ther. ج. 279 ع. 1: 186–93. PMID:8858992.
- ^ Mareck U، Geyer H، Opfermann G، Thevis M، Schänzer W (يوليو 2008). "Factors influencing the steroid profile in doping control analysis". J Mass Spectrom. ج. 43 ع. 7: 877–91. DOI:10.1002/jms.1457. PMID:18570179.
- ^ Fragkaki AG، Angelis YS، Tsantili-Kakoulidou A، Koupparis M، Georgakopoulos C (مايو 2009). "Schemes of metabolic patterns of anabolic androgenic steroids for the estimation of metabolites of designer steroids in human urine". J. Steroid Biochem. Mol. Biol. ج. 115 ع. 1–2: 44–61. DOI:10.1016/j.jsbmb.2009.02.016. PMID:19429460.
- ^ Blackledge RD (أغسطس 2009). "Bad science: the instrumental data in the Floyd Landis case". Clin. Chim. Acta. ج. 406 ع. 1–2: 8–13. DOI:10.1016/j.cca.2009.05.016. PMID:19465014.
- ^ Baselt، Randall Clint (2008). Disposition of Toxic Drugs and Chemicals in Man (ط. 8th). Foster City, CA: Biomedical Publications. ص. 95, 393, 403, 649, 695, 952, 962, 1078, 1156, 1170, 1442, 1501, 1581. ISBN:978-0-9626523-7-0.
- ^ Hoberman JM، Yesalis CE (1995). "The history of synthetic testosterone". Scientific American. ج. 272 ع. 2: 76–81. DOI:10.1038/scientificamerican0295-76. PMID:7817189.
- ^ Freeman ER، Bloom DA، McGuire EJ (2001). "A brief history of testosterone". Journal of Urology. ج. 165 ع. 2: 371–373. DOI:10.1097/00005392-200102000-00004. PMID:11176375.
- ^ David K، Dingemanse E، Freud J، Laqueur L (1935). "Uber krystallinisches mannliches Hormon aus Hoden (Testosteron) wirksamer als aus harn oder aus Cholesterin bereitetes Androsteron". Hoppe Seylers Z Physiol Chem. ج. 233 ع. 5–6: 281–283. DOI:10.1515/bchm2.1935.233.5-6.281.
- ^ Butenandt A, Hanisch G (1935). "Über die Umwandlung des Dehydro-androsterons in Δ4-Androsten-ol-(17)-0n-(3) (Testosteron); ein Weg zur Darstellung des Testosterons aus Cholesterin (Vorläuf. Mitteil.)". Berichte der deutschen chemischen Gesellschaft (A and B Series) (بالألمانية). 68 (9): 1859–62. DOI:10.1002/cber.19350680937.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|trans_title=تم تجاهله يقترح استخدام|عنوان مترجم=(help) - ^ Ruzicka L, Wettstein A (1935). "Sexualhormone VII. Uber die kunstliche Herstellung des Testikelhormons. Testosteron (Androsten-3-one-17-ol.)". Helvetica Chimica Acta (بالألمانية). 18: 1264–75. DOI:10.1002/hlca.193501801176.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|trans_title=تم تجاهله يقترح استخدام|عنوان مترجم=(help) - ^ Taylor WN (1 يناير 2009). Anabolic Steroids and the Athlete. McFarland & Company. ص. 181. ISBN:0-7864-1128-7.
- ^ Suarez R، Senior Correspondent، Kelman J، physician (18 نوفمبر 2002). "President Kennedy's Health Secrets". PBS NewsHour. Public Broadcasting System.
- ^ Calfee R، Fadale P (2006). "Popular ergogenic drugs and supplements in young athletes". Pediatrics. ج. 117 ع. 3: e577–89. DOI:10.1542/peds.2005-1429. PMID:16510635.
- ^ Justin Peters The Man Behind the Juice, Slate Friday, Feb. 18, 2005. Retrieved 29 April 2008
| في كومنز صور وملفات عن: ستيرويد ابتنائي |
