حمض نووي ريبوزي: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
جينومات الرنا |
لا ملخص تعديل |
||
| سطر 1: | سطر 1: | ||
{{قيد التطوير}} |
{{قيد التطوير}} |
||
[[ملف:RNA-comparedto-DNA thymineAndUracilCorrected.png|يسار|تصغير|290بك|شكل (1): صورة توضح '''الآر إن إيه''' مع قواعده النيتروجينية في اليسار. و[[الدي أن إيه]] في اليمين.]] |
|||
[[ملف:Pre-mRNA-1ysv-tubes.png|thumb|200px|left|شكل (2): شريط آر إن إيه أحادي متحد بنفسه نتيجة وجود التكامل ال[[نيوكليوتيد]]ي]] |
[[ملف:Pre-mRNA-1ysv-tubes.png|thumb|200px|left|شكل (2): شريط آر إن إيه أحادي متحد بنفسه نتيجة وجود التكامل ال[[نيوكليوتيد]]ي]] |
||
'''الحمض النووي الريبوزي''' {{إنج|Ribonucleic acid}}، اختصاره آر إن إيه '''حمض نووي ريبوزي''' أو ('''آر أن إيه''') عبارة عن [[بوليمر]] [[حمض نووي|حمضي نووي]] مؤلف من ارتباط تكافئي لمجموعة من [[نيوكليوتيد|النيكليوتيدات]]. الحمض النووي الريبوزي هو واحد من ثلاثة جزيئات ضخمة بيولوجية تُعتبر أساسيّة لكل أشكال الحياة (مع الحمض النووي الريبوزي منقوص الأوكسجين والبروتينات). معتقد أساسي مُتّصل بالبيولوجيا الجزيئية يفيد بأن تدفق المعلومات الوراثية في الخلية يتكون من الدي أن إيه الذي يصنع الآر أن إيه والذي بدوره يصنع [[البروتينات]]. البروتينات هي حصان العمل في الخلية حيث تلعب دوراً رئيسياُ في الخلية كإنزيمات، كمكوّنات هيكلية، أو في إشارات الخلية، على سبيل المثال لا الحصر. يلعب الدي أن إيه دوراً أساسيّاً كمخطط في الخلية، حيث يحمل كل المعلومات الوراثيّة اللازمة لنمو الخلية، للحصول على المواد الغذائية والتكاثر. هنا يكمن دور الآر أن إيه في [[الخلية]] عندما تحتاج إنتاج بروتين معيّن، حيث أنّه يقوم بتفعيل [[جين]] البروتين (جزء من الدي أن إيه يُشفِّر ويرمز لذلك البروتين) وإنتاج نسخ متعددة منه على شكل [[حمض نووي ريبوزي رسول]]. تلك النسخ تُستخدم لترجمة [[الشفرة الجينية]] من أجل صنع البروتين عن طريق [[الرايبوسومات]]. يستطيع الآر أن إيه بمعنى آخر أن يزيد من كمية بروتين معين يمكن صنعه في مرحلة واحدة من جين معين كما أنه يشكل نقطة تحكم مهمة من أجل تنظيم وقت وكمية إنتاج بروتين مُحدد <ref>[https://www.rnasociety.org/about/what-is-rna/ What is RNA? | RNA Society<!-- عنوان مولد بالبوت -->] {{Webarchive|url=http://web.archive.org/web/20171008191440/https://www.rnasociety.org/about/what-is-rna/ |date=08 أكتوبر 2017}}</ref> |
'''الحمض النووي الريبوزي''' {{إنج|Ribonucleic acid}}، اختصاره آر إن إيه '''حمض نووي ريبوزي''' أو ('''آر أن إيه''') عبارة عن [[بوليمر]] [[حمض نووي|حمضي نووي]] مؤلف من ارتباط تكافئي لمجموعة من [[نيوكليوتيد|النيكليوتيدات]]. الحمض النووي الريبوزي هو واحد من ثلاثة جزيئات ضخمة بيولوجية تُعتبر أساسيّة لكل أشكال الحياة (مع الحمض النووي الريبوزي منقوص الأوكسجين والبروتينات). معتقد أساسي مُتّصل بالبيولوجيا الجزيئية يفيد بأن تدفق المعلومات الوراثية في الخلية يتكون من الدي أن إيه الذي يصنع الآر أن إيه والذي بدوره يصنع [[البروتينات]]. البروتينات هي حصان العمل في الخلية حيث تلعب دوراً رئيسياُ في الخلية كإنزيمات، كمكوّنات هيكلية، أو في إشارات الخلية، على سبيل المثال لا الحصر. يلعب الدي أن إيه دوراً أساسيّاً كمخطط في الخلية، حيث يحمل كل المعلومات الوراثيّة اللازمة لنمو الخلية، للحصول على المواد الغذائية والتكاثر. هنا يكمن دور الآر أن إيه في [[الخلية]] عندما تحتاج إنتاج بروتين معيّن، حيث أنّه يقوم بتفعيل [[جين]] البروتين (جزء من الدي أن إيه يُشفِّر ويرمز لذلك البروتين) وإنتاج نسخ متعددة منه على شكل [[حمض نووي ريبوزي رسول]]. تلك النسخ تُستخدم لترجمة [[الشفرة الجينية]] من أجل صنع البروتين عن طريق [[الرايبوسومات]]. يستطيع الآر أن إيه بمعنى آخر أن يزيد من كمية بروتين معين يمكن صنعه في مرحلة واحدة من جين معين كما أنه يشكل نقطة تحكم مهمة من أجل تنظيم وقت وكمية إنتاج بروتين مُحدد <ref>[https://www.rnasociety.org/about/what-is-rna/ What is RNA? | RNA Society<!-- عنوان مولد بالبوت -->] {{Webarchive|url=http://web.archive.org/web/20171008191440/https://www.rnasociety.org/about/what-is-rna/ |date=08 أكتوبر 2017}}</ref> |
||
| سطر 57: | سطر 56: | ||
* تنظيم التعبير الجيني: تلعب بعض جزيئات [[رنا غير مشفر|الرنا غير المشفرة]] دورا في تثبيط التعبير عن بعض الجينات أو مجموعة من الجينات كما هو الحال لدى [[رنا مضاد للدلالة|الرنا المضاد للاتجاه]] الذي يترابط مع رنا مستهدف يمنع ترجمته إلى بروتين. |
* تنظيم التعبير الجيني: تلعب بعض جزيئات [[رنا غير مشفر|الرنا غير المشفرة]] دورا في تثبيط التعبير عن بعض الجينات أو مجموعة من الجينات كما هو الحال لدى [[رنا مضاد للدلالة|الرنا المضاد للاتجاه]] الذي يترابط مع رنا مستهدف يمنع ترجمته إلى بروتين. |
||
* يقوم [[الرنا الناقل]] أثناء [[ترجمة (وراثة)|عملية الترجمة]] بنقل وتوجيه [[الأحماض الأمينية]] للارتباط بالبروتين الناتج. |
* يقوم [[الرنا الناقل]] أثناء [[ترجمة (وراثة)|عملية الترجمة]] بنقل وتوجيه [[الأحماض الأمينية]] للارتباط بالبروتين الناتج. |
||
جينوم بعض الفيروسات مكون بشكل حصري من الرنا وليس الدنا ومن الأمثلة على ذلك: فيروس ال[[إنفلونزا]]، [[فيروس العوز المناعي البشري]]، فيروس [[التهاب الكبد C]]، [[فيروسة سنجابية|فيروس شلشل الأطفال]] و[[فيروس إيبولا]]، تضاعف الفيروسات في هذه الحالة يمكن أن يمر بمرحلة دنا وسطية ([[فيروس راجع]])، لكن يمكن أن يتم مباشرة من الرنا. |
|||
== أنواع الرنا == |
== أنواع الرنا == |
||
{{مفصلة|قائمة بأنواع الرنا}} |
{{مفصلة|قائمة بأنواع الرنا}} |
||
| سطر 133: | سطر 129: | ||
لدى [[فيروس راجع|الفيروسات الراجعة]] جينوم ذو سلسلة رنا أحادية لكنها لا تعتبر من فيروسات الرنا لأنها تستخدم دنا وسيط للتضاعف. يحوِّل إنزيم [[منتسخة عكسية|النسخ العكسي]] الفيروسي -الذي يأتي من الفيروس نفسه بعد أن يزيل كسائه البروتيني- الرنا الفيروسي إلى سلسلة دنا مكملة والتي تُنسخ بدورها لتكوين جزيئة دنا فيروسية مزدوجة السلاسل. بعد ذلك يقوم [[إنزيم مدمج|إنزيم الدمج]] بدمج سلسلة الدنا المزدوجة هذه في جينوم المضيف، التعبير عن الجينات الفيروسية المدمجة قد يقود إلى نشوء فيروسات جديدة.<ref>{{cite journal | vauthors = Kalendar R, Vicient CM, Peleg O, Anamthawat-Jonsson K, Bolshoy A, Schulman AH | title = Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes | journal = Genetics | volume = 166 | issue = 3 | pages = 1437–50 | date = March 2004 | pmid = 15082561 | pmc = 1470764 | doi = 10.1534/genetics.166.3.1437 }}</ref> |
لدى [[فيروس راجع|الفيروسات الراجعة]] جينوم ذو سلسلة رنا أحادية لكنها لا تعتبر من فيروسات الرنا لأنها تستخدم دنا وسيط للتضاعف. يحوِّل إنزيم [[منتسخة عكسية|النسخ العكسي]] الفيروسي -الذي يأتي من الفيروس نفسه بعد أن يزيل كسائه البروتيني- الرنا الفيروسي إلى سلسلة دنا مكملة والتي تُنسخ بدورها لتكوين جزيئة دنا فيروسية مزدوجة السلاسل. بعد ذلك يقوم [[إنزيم مدمج|إنزيم الدمج]] بدمج سلسلة الدنا المزدوجة هذه في جينوم المضيف، التعبير عن الجينات الفيروسية المدمجة قد يقود إلى نشوء فيروسات جديدة.<ref>{{cite journal | vauthors = Kalendar R, Vicient CM, Peleg O, Anamthawat-Jonsson K, Bolshoy A, Schulman AH | title = Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes | journal = Genetics | volume = 166 | issue = 3 | pages = 1437–50 | date = March 2004 | pmid = 15082561 | pmc = 1470764 | doi = 10.1534/genetics.166.3.1437 }}</ref> |
||
== فرضية عالم الرنا == |
== فرضية عالم الرنا == |
||
| ⚫ | |||
=== الرنا الرسول === |
|||
| ⚫ | |||
اقتٌرِح استخدام جزيئات رنا رسول كاملة الطول منذ بداية حقبة [[تقانة حيوية|التقانة الحيوية]]، لكنها لم تلق اهتماما حتى العقد 2010، حين أُسِست شركة "مودرنا ثريبيوتيكا" وتمكنت من جمع مليار دولار تقريبا لتمويل المشروع خلال الأعوام الثلاثة الأولى.<ref name=Xconomy2012>{{cite web|author=Gregory Huang|date=December 6, 2012|title=Moderna, $40M in Tow, Hopes to Reinvent Biotech with "Make Your Own Drug"|publisher=Xconomy|url=http://www.xconomy.com/boston/2012/12/06/moderna-40m-in-tow-hopes-to-reinvent-biotech-with-new-protein-drugs/}}</ref><ref name=genemed>{{cite journal | vauthors = Kaczmarek JC, Kowalski PS, Anderson DG | title = Advances in the delivery of RNA therapeutics: from concept to clinical reality | journal = Genome Medicine | volume = 9 | issue = 1 | pages = 60 | date = June 2017 | pmid = 28655327 | pmc = 5485616 | doi = 10.1186/s13073-017-0450-0 }}</ref><ref>{{cite news|last1=Crow|first1=David | name-list-format = vanc |title=Moderna pledge sets investor pulses racing; Biotech group promises to rewrite rules of drug development - though sceptics say $5bn valuation is undeserved|url=https://www.ft.com/content/ab138504-8c2e-11e7-a352-e46f43c5825d|work=Financial Times|date=7 September 2017}}</ref><ref>{{cite news|last1=Adams|first1=Ben| name-list-format = vanc |title=Moderna changes up R&D model, posts cancer, CV trial updates|url=http://www.fiercebiotech.com/biotech/moderna-changes-up-r-d-model-posts-cancer-cv-trial-updates|work=FierceBiotech|date=September 14, 2017|language=en}}</ref> نظريا جزيئات الرنا الرسول المعدلة يمكن أن تترجمها الخلية إلى [[بروتين]]ات يمكنها معالجة الأمراض أو استخدامها كلقاحات، أو حتى أن تقود البروتينات [[خلية جذعية|الخلايا الجذعية]] الأصلية إلى التمايز بالطريقة المرغوب فيها.<ref name=NatRevMat>{{cite journal| vauthors = Hajj KA, Whitehead KA |title=Tools for translation: non-viral materials for therapeutic mRNA delivery|journal=Nature Reviews Materials|date=12 September 2017|volume=2|issue=10|pages=17056|doi=10.1038/natrevmats.2017.56}}</ref><ref name="GEN">{{cite news| vauthors = Gousseinov E, Kozlov M, Scanlan C |title=RNA-Based Therapeutics and Vaccines|url=https://www.genengnews.com/gen-exclusives/rna-based-therapeutics-and-vaccines/77900520|work=Genetic Engineering News|date=September 15, 2015}}</ref> لكن الإشكال الأساسي للعلاج بالرنا يتركز حول توصيل الرنا إلى الخلايا المستهدفة، أكثر من تركيزه على التسلسل الذي سيتم توصيله.<ref name="genemed"/> الرنا غير المعدل سيتم تفكيكه طبيعيا بعد تحضيره، وقد يثير [[جهاز مناعي|النظام المناعي]] للجسم ليهاجمه كسجم دخيل، بالإضافة إلى أنه غير قابل للنفاذ عبر [[الغشاء الخلوي]].<ref name="GEN"/> وحين يكون داخل الخلية يجب أن يغادر آلية النقل ليقوم بعمله في ال[[سيتوبلازم]] أين توجد ال[[ريبوسوم]]ات التي تترجمه إلى بروتينات.<ref name=NatRevMat/> |
|||
=== الرنا الصغير المتدخل === |
|||
يُستخدم الرنا اليوم في العديد من التطبيقات في علم الأحياء الجزيئي، وبشكل خاص عبر عملية [[تداخل الرنا]] والتي يتم فيها إدراج جزيئات رنا قصيرة مزدوجة السلاسل تسمى [[حمض نووي ريبوزي متداخل صغير|الرنا الصغير المتدخل]] (siRNA) داخل خلايا حقيقيات النوى. تُستخدم جزيئات الرنا هذه التي طولها حوالي 20 زوج قاعدي بواسطة آلية خلوية قادرة على تفكيك الرنا بشكل محدد. لا يتم تفكيك سوى جزيئات الرنا الرسول التي تحوي تسلسلا مماثلا للرنا المتدخل، وهذا يتيح إمكانية تخفيض التعبير عن البروتينات بشكل محدد.<ref>{{article|langue=en|périodique=[[Nature (revue)|Nature]]|volume=391|pages=806-811|année=1998|titre= Potent and specific genetic interference by double-stranded RNA in ''Caenorhabditis elegans''.|nom1=Fire|prénom1=A.|nom2=Xu|prénom2=S.|nom3=Montgomery|prénom3=M.|nom4=Kostas|prénom4=S.|nom5=Driver|prénom5=S.|nom6=Mello|prénom6=C.}}</ref> هذا النهج التقني أكثر بساطة وسرعة من تحضير سلالات {{وإو|فئران معدلة جينية|Knockout mouse}} ويسمى knock down. التجارب التي تستخدم هذه التقنية لأغراض علاجية هي في مرحلة الدراسة، على سبيل المثال: تُدرس إمكانية استهداف الجينات الفيروسية لمحاربة العدوى والأمراض، أو [[جين ورمي|الجينات الورمية]] للقضاء على السرطان.<ref>{{article| titre=Les promesses de l'ARN thérapeutique = Genetic interference by RNA. | périodique=Le Concours Médical | année=2002 | volume=124 | pages=2550-2552 | nom1=Hélène|prénom1=Claude}}</ref> لكن يتطلب ذلك جعل جزيئات الرنا المتدخل مستقرة لمنع تحليلها بواسطة الريبونوكليازات وتوجيه نشاطها نحو الخلايا المستهدفة. |
|||
== التاريخ == |
== التاريخ == |
||
اكتشفت الأحماض النووية عام [[1868]] من قبل [[يوهان]] مسمياً إياها بداية (النووين) {{إنج|Nuclein}} بما أنه وجده بداية ضمن النواة الخلوية. لكن لاحقاً سرعان ما اكتشف أن الخلايا طلائعية النواة التي لا تحتوي نواة حقيقية تحوي أيضا ضمن الستوبلازم الحموض النووية. بدأ البحث في دور RNA في اصطناع البروتينات في عام 1939 على أساس تجارب أجريت من قبل العالم السويدي [[كاسبيرسون]] (Torbjörn Caspersson) والعالم البلجيكي [[جان براشيه]] {{فرن|Jean Brachet}} و[[جاك شولتز]] {{إنج|Jack Schultz}}. |
اكتشفت الأحماض النووية عام [[1868]] من قبل [[يوهان]] مسمياً إياها بداية (النووين) {{إنج|Nuclein}} بما أنه وجده بداية ضمن النواة الخلوية. لكن لاحقاً سرعان ما اكتشف أن الخلايا طلائعية النواة التي لا تحتوي نواة حقيقية تحوي أيضا ضمن الستوبلازم الحموض النووية. بدأ البحث في دور RNA في اصطناع البروتينات في عام 1939 على أساس تجارب أجريت من قبل العالم السويدي [[كاسبيرسون]] (Torbjörn Caspersson) والعالم البلجيكي [[جان براشيه]] {{فرن|Jean Brachet}} و[[جاك شولتز]] {{إنج|Jack Schultz}}. |
||
نسخة 14:11، 23 مايو 2019
هذه مقالة أو قسم تخضع حاليًّا للتوسيع أو إعادة هيكلة جذريّة. إذا كانت لديك استفسارات أو ملاحظات حول عملية التطوير؛ فضلًا اطرحها في صفحة النقاش قبل إجراء أيّ تعديلٍ عليها. فضلًا أزل القالب لو لم تُجرَ أي تعديلات كبيرة على الصفحة في آخر شهر. لو كنت أنت المحرر الذي أضاف هذا القالب وتُحرر المقالة بشكلٍ نشطٍ حاليًّا، فضلًا تأكد من استبداله بقالب {{تحرر}} في أثناء جلسات التحرير النشطة. آخر من عدل المقالة كان Momas (نقاش | مساهمات) منذ 5 سنين (تحديث) |

الحمض النووي الريبوزي (بالإنجليزية: Ribonucleic acid)، اختصاره آر إن إيه حمض نووي ريبوزي أو (آر أن إيه) عبارة عن بوليمر حمضي نووي مؤلف من ارتباط تكافئي لمجموعة من النيكليوتيدات. الحمض النووي الريبوزي هو واحد من ثلاثة جزيئات ضخمة بيولوجية تُعتبر أساسيّة لكل أشكال الحياة (مع الحمض النووي الريبوزي منقوص الأوكسجين والبروتينات). معتقد أساسي مُتّصل بالبيولوجيا الجزيئية يفيد بأن تدفق المعلومات الوراثية في الخلية يتكون من الدي أن إيه الذي يصنع الآر أن إيه والذي بدوره يصنع البروتينات. البروتينات هي حصان العمل في الخلية حيث تلعب دوراً رئيسياُ في الخلية كإنزيمات، كمكوّنات هيكلية، أو في إشارات الخلية، على سبيل المثال لا الحصر. يلعب الدي أن إيه دوراً أساسيّاً كمخطط في الخلية، حيث يحمل كل المعلومات الوراثيّة اللازمة لنمو الخلية، للحصول على المواد الغذائية والتكاثر. هنا يكمن دور الآر أن إيه في الخلية عندما تحتاج إنتاج بروتين معيّن، حيث أنّه يقوم بتفعيل جين البروتين (جزء من الدي أن إيه يُشفِّر ويرمز لذلك البروتين) وإنتاج نسخ متعددة منه على شكل حمض نووي ريبوزي رسول. تلك النسخ تُستخدم لترجمة الشفرة الجينية من أجل صنع البروتين عن طريق الرايبوسومات. يستطيع الآر أن إيه بمعنى آخر أن يزيد من كمية بروتين معين يمكن صنعه في مرحلة واحدة من جين معين كما أنه يشكل نقطة تحكم مهمة من أجل تنظيم وقت وكمية إنتاج بروتين مُحدد [1]
تتميز نيكليوتيدات الآر إن إيه عن نيكليوتيدات الدي أن إيه بأنها تحوي حلقة ريبوز كما تضم يوراسيل، في حين تحوي نيكليوتيدات الدي أن إيه ريبوز منقوص الأكسجين (بالإنجليزية: حمض نووي ريبوزي منقوص الأكسجين) وثايمين. و على عكس الدي أن إيه فإن الحمض النووي الريبوزي يوجد كشريط أحادي (single strand)، مما يؤدي في الكثير من الأحيان إلى تشكله في تركيبات ثلاثية الأبعاد (3D structure) لوجود تكامل في التسلسل النيوكليوتيدي [2] (الشكل رقم2، 5).
يتم تكوين الحمض النووي الريبيوزي داخل النواة عن طريق عملية النسخ الوراثية اعتماداً على التسلسل الموجود في الدي أن إيه، و ذلك بوساطة أنزيمات تدعى أنزيمات بلمرة الحمض النووي الريبوزي (بوليميراز الحمض النووي الريبوزي)، ثم تقوم أنزيمات أخرى بإجراء تعديلات لتجهيز جزيء الآر إن إيه حسب نوعه، إما للمغادرة من النواة إلى السيتوبلازم [3]، أو البقاء للقيام بوظائف داخلها[4].
مقارنة مع الدنا
البنية الكيميائية للرنا مماثلة جدا لنظيرتها الخاصة بالدنا، لكن تختلف عنها في ثلاث أمور أساسية:
- على عكس الدنا مزدوج السلاسل، الرنا جزيء ذو سلسلة مفردة [5] في معظم وظائفه البيولوجية ويتكون من سلسلة أقصر بكثير من النوكليوتيدات.[6] إلا أنه يمكن للرنا -بواسطة الازدواج القاعدي المكمل- تكوين لوالب مزدوجة بسلسلته المفردة كما هو الحال في الرنا الناقل.
- يحتوي العمود الفقري للدنا المتكون من سكر-فوسفات على الريبوز منقوص الأكسجين، بينما يحتوي عمود الرنا الفقري على الريبوز.[7] للريبوز مجموعة هيدروكسيل OH- مرتبطة بحلقة البنتوز في الوضعية 2'، في حين أن الريبوز منزوع الأكسجين لا يملك مجموعة هيدروكسيل في تلك الوضعية. تجعل مجموعات الهيدروكسيل في ريبوز العمود الفقري الرنا أقل استقرارا من الدنا وذلك لأنه أكثر عرضة للحلمأة.
- القاعدة المكملة للأدينين في الدنا هي الثايمين، لكن في الرنا هي اليوراسيل وهي هيئة غير ممثيلة من الثايمين.[8]
مثل الدنا، تملك معظم أنواع الرنا النشطة بما في ذلك الرنا الرسول، الرنا الناقل، الرنا الريبوسومي، الرنا الصغير النووي، وغيرها من جزيئات الرنا غير المشفرة تسلسلات ذاتية مكملة تسمح لأجزاء من الرنا بالتطوي [9] والازدواج مع نفسه لتكوين لوالب مزدوجة. كشفت تحليلات لجزيئات الرنا هذه أنها منتظمة للغاية، وعلى عكس الدنا لا تتكون بُنى الرنا من لوالب مزدوجة طويلة بل مجموعة من اللوالب القصيرة المجمعة في بنى تشابه تلك الخاصة بالبروتينات، وعليه يمكن للرنا تنفيذ تحفيزات كيميائية (مثل الإنزيمات)، [10] فعلى سبيل المثال كَشَفَ تحديد بنية الريبوسوم -وهو مركب رنا-بروتين يقوم بتحفيز تكوين الروابط الببتيدية- أن الموقع النشط مكون بالكامل من الرنا.[11]
البنية

الرنا حمض نووي وذلك يعني أنه مكون من سلسلة من النوكليوتيدات، يتكون كل نوكليوتيد في الرنا من سكر ريبوز ذرات الكربون فيه مرقمة من 1' إلى 5'، قاعدة نووية (نيتروجينية) ومجموعة فوسفات. ترتبط القواعد النووية بالريبوز عبر رابطة غليكوسيدية بين ذرة الكربون 1' وذرة نيتروجين وهذه القواعد هي: أدينين [A]، ثايمين [T]، غوانين [G]، يوراسيل [U]، حيث أن الأدينين والغوانين بيورينات والسايتوسين واليوراسيل بيريميدينات. ترتبط مجموعة الفوسفور بالوضعية 3' في الريبوز الأول وبالوضعية 5' في الريبوز الثاني عبر روابط فوسفات ثنائية الإستر، لدى مجموعات الفوسفات شحنات سالبة وهذا يجعل الرنا جزيئا مشحونا (عديد الأنيون). تشكل القواعد روابط هيدروجينية بين السايتوسين والغوانين وبين الأدينين واليوراسيل.[12] استُبدِل الثايمين الخاص بالدنا باليوراسيل في الرنا،[13] والفرق بين هاتين القاعدتين هو استبدال مجموعة الميثيل في الوضعية الخامسة للثايمين بذرة هيدروجين في اليوراسيل، هذا التعديل في البنية لا يؤثر على خصائص الارتباط مع الأدنين.[14] [15] توجد تآثرت أخرى بين القواعد مثل ترابط مجموعة من قواعد الأدينين مع بعضها في انتباج،[16] أو الحلقة الرباعية GNRA التي يوجد فيها الزوج القاعدي غوانين-أدينين.[12]
الكيمياء الفراغية للريبوز


من الناحية التصاوغية، يؤثر تواجد ذرة أكسجين في الوضعية 2' في الريبوز على تصاوغ حلقة الفورانوز الخاصة بالريبوز. هذه الحلقة المغايرة المكونة من خمس ذرات ليست ذات مستوٍ واحد، ويوجد لها مصاوغات فراغية عديدة منها مصاوغين أساسيين هما: C'2-إندو وC'3-إندو. المصاوغ C'3-إندو تكون فيه الذرة رقم 3 في نفس الجانب الذي تتواجد فيه مجموعة الفوسفات والقاعدة النيتروجينية وتكون المسافة فيه بين مجموعتي الفوسفات هي الأقصر 5.9 أنغستروم (شكل2)، أما المصاوغ C'2-إندو فتكون فيه ذرة الكربون 2 في نفس جانب القاعدة النيتروجينية ومجموعة الفوسفات ومسافة مجموعتي الفوسفات فيها هي 7 أنغستروم (شكل1).[17] [18] في الرنا الذي يحتوي على ذرة أكسجين بالوضعية 2' يكون المصاوغ C'3-إندو مفضلا [19] ما يعني أن لوالب الرنا المزدوجة تكون من النوع أ وهي مختلفة عن لوالب الدنا المزدوجة الشائعة والتي تكون أغلبها من النوع ب الذي يكون فيها الريبوز منقوص الأكسجين على هيئة المصاوغ C'2-إندو.[20]
النوكليوتيدات المعدلة
يُنسخ الرنا بأربع قواعد فقط (أدينين، سايتوسين، غوانين واليوراسيل) [21] لكن يمكن لهذه القواعد والريبوزات المرتبطة بها أن تُعدَّل بطرق مختلفة مع نضوج الرنا، فمثلا في نوكليوتيد السودويوريدين (Ψ) يتغير الربط بين اليوراسيل والريبوز من رابطة C–N إلى رابطة C–C، تتواجد القاعدة المعدلة 5-ميثيل يوريدين (T) في أماكن عديدة (أكثرها شهرة تواجدها في الحلقة TΨC الخاصة بالرنا الناقل).[22] من القواعد المعدلة الشهيرة كذلك الهيبوزانتين، وهي أدنين منزوع الأمين يسمى نوكليوسيدها إينوسين ويلعب الإينوسين دورا مفتاحيا في نظرية ووبل الخاصة بالشيفرة الجينية.[23]
يوجد أزيد من 100 نوكليوسيد معدل يظهر طبيعيا.[24] وأكثر أنواع التعديلات البنيوية يمكن أن تتواجد في الرنا الناقل،[25] في حين أن السودويوريدين والنوكليوسيدات الممثيلة في أكسجين الذرة 2' المتواجدة في الرنا الريبوسومي هي الأكثر شيوعا.[26] وظائف العديد من هذه التعديلات في الرنا مازالت غير مفهومة كليا، إلا أنه يتجلى في الرنا الريبوسومي أن العديد من تعديلات ما بعد النسخ تحدث في مناطق عالية الوظيفية مثل مركز بيبتيديل ترانسفيراز وواجهة الوحدة الفرعية، ما يشير إلى أنها ضرورية للنشاط العادي.[27]
الرنا مزدوج السلاسل ولولب الرنا المزدوج

الرنا مزدوج السلاسل (dsRNA) هو رنا له سلسلتين متكاملتين، وهو مشابه للدنا الموجود في الخلايا لكن مع استبدال الثايمين باليوراسيل. يشكل الرنا مزدوج السلاسل المادة الجينية لبعض الفيروسات (الفيروسات الرنا مزدوج السلاسل). ويمكن لأنواع منه مثل الرنا الفيروسي أو الرنا الصغير المتداخل (siRNA) إثارة تداخل الرنا لدى حقيقيات النوى وكذلك استجابة إنترفيرون لدى الفقاريات.[30][31][32][33]
اللولب المزدوج من النوع أ الذي يتخذه الرنا له خصائص هندسية مختلفة عن النوع ب الشائع في الدنا، فعدد أزواج القواعد لكل دورة هو 11 بدل عشرة لدى النوع ب. مستوى الزوج القاعدي ليس عموديا على محور اللولب المزدوج بل يشكل زاوية 75° درجة معه.[34] [35] ونتيجة لذلك ينزاح محور للولب ويصبح غير مارٍ عبر مركز الزوج القاعدي بل داخل الثلم الكبير، وهذا يزيد قطر اللولب من 20 أنغستروم لدى النوع ب إلى 26 أنغستروم في النوع أ.[36] هندسة الثلمين تتغير كذلك بشكل كبير: الثلم الصغير يصبح قابلا للوصول بينما يصبح الثلم الكبير أكثر عمقا وحدة. وهذا له تأثير على كيفية تآثر لولب الرنا المزدوج مع البروتينات لأن حدة الثلم الكبير تصبح حاجزا أمام وصول الربائط البروتينية.[37]
البنية لدى الكائنات الحية
التخليق
يُحفَّز تخليق الرنا عادة بواسطة إنزيم بوليميراز الرنا باستخدام الدنا كقالب، وهي عملية تعرف بالنسخ. الشروع في النسخ يبدأ بارتباط الإنزيم بتسلسل محفز في الدنا (يتواجد عادة "عكس التيار" في الجين). يتم فك لولبة اللولب المزدوج بواسطة إنزيم الهيليكاز، ثم يمضي البوليميراز على طول السلسلة القالب في الاتجاه 3' إلى 5' مخلقًا جزيء رنا مكمل تكون فيه الاستطالة في الاتجاه 5' إلى 3'. يحدد تسلسل الدنا كذلك مكان الانتهاء من الترجمة.[38] تخضع النسخة الأولية للرنا لتعديلات ما بعد النسخ بواسطة إنزيمات، على سبيل المثال: يضاف ذيل عديد الأدينيلات وقبعة 5' إلى الرنا قبل الرسول الخاص بحقيقيات النوى وتُزال الإنترونات بواسطة جسيم التضفير.
يوجد كذلك العديد من بوليميرازات الرنا المعتمدة على الرنا التي تستخدم الرنا كقالب لها لتخليق سلاسل جديدة من الرنا، فمثلا: عدد من فيروسات الرنا (مثل الفيروسة السنجابية) تستخدم هذا النوع من الإنزيم لمضاعفة معلوماتها الجينية.[39] كذلك بوليميراز الرنا المعتمد على الرنا جزء من مسار تداخل الرنا في العديد من الكائنات.[40]
البدء والاستطالة
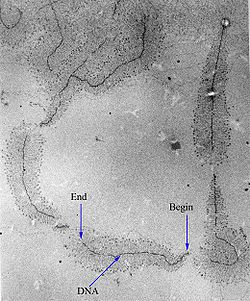
البدء في النسخ بواسطة بوليميراز الرنا يتم على مستوى تسلسل محدد على الدنا يسمى محفز، يشمل هذا المحفز عنصرا أو عدة عناصر ذات تسلسل محفوظ.[42] والتي ترتبط بها بروتينات محددة تسمى عوامل النسخ. يكون العنصر المجاور لموقع بداية النسخ في العادة غني بنوكليوتيدات T وA ولهذا يطلق عليه صندوق TATA [43] عند حقيقيات النوى أو صندوق بربنو لدى البكتيريا.[44] تقوم عوامل النسخ بتوظيف بوليميراز الرنا للقيام بالنسخ في المحفز وفك لولبة اللولب المزدوج، فينشأ ما يسمى فقاعة النسخ حين يُفتح الدنا ويتم الشروع في نسخ إحدى السلسلتين (السلسلة القالب).
بعد أن يرتبط بوليميراز الرنا بالمحفز وتتشكل فقاعة النسخ، يقوم البوليميراز بنسخ النوكليوتيدات الأولى بطريقة ساكنة دون أن يغادر تسلسل المحفز. بعد ذلك تفك عوامل النسخ ارتباطها ويبدأ إنزيم البوليميراز بالتقدم.[45] ويتم النسخ في الاتجاه 5' إلى 3' باستخدام إحدى السلسلتين كقالب والريبونوكليوتيدات ثلاثية الفوسفات (ATP وGTP وCTP وUTP) كمواد أولية. في الكائنات الحية، تبلغ سرعة الاستطالة لدى الإشريكية القولونية حوالي 50 إلى 90 نوكليوتيدة لكل ثانية.[46].
الإنهاء
آليات الإنهاء تختلف بشكل كامل بين البكتيريا وحقيقيات النوى، فلدى البكتيريا الآلية الرئيسية للإنهاء تكون بتدخل تسلسل خاص من الرنا يسمى المُنهي وهو مركب من ثلاث حلقات جذعية مستقرة متبوعة بسلسلة من وحدات اليوريدين (U). عندما يخلِّق بوليميراز الرنا هذا التسلسل يُحدث تطوي حلقة الرنا توقف البوليميراز.[47] بعد ذلك يقوم الرنا الذي لم يعد متصلا بالسلسلة القالب سوى بعدة أزواج قاعدية A-U ضعيفة بالانفصال من دون تدخل العوامل البروتينية الأخرى، يمكن أن يحدث الإنهاء كذلك بتدخل عامل بروتيني محدد يسمى رهو (Rho).[48]
لدى حقيقيات النوى إنهاء النسخ بواسطة بوليميراز الرنا 2 يكون مقترنا مع التذييل بعديد الأدينيلات. يقوم المنهي بإرسال إشارات تتعرف عليها بروتينات مصاحبة للبوليميراز 2 والتي تبدأ عملية الإنهاء بتوظيف بروتيني CPSF وCStF اللذان يتعرفان على إشارة التذييل بعديد الإدينيلات 5′-AAUAAA-3′ وإشارة قص الرنا، فيقومان بقص الرنا وعند انفصال البوليميراز 2 يقومان بتوظيف بوليميراز عديد الإدينيلات لإضافة ذيل عديد الإدينيلات.[49]
النضوج
وظيفة الرنا
للرنا عدة وظائف خلوية أساسية منها:
- نقل المعلومة الوراثية: تستخدم الخلية الرنا الرسول لنقل المعلومة الوراثية المتعلقة بجين خارج النواة، ثم ترجمتها لتخليق بروتينات.
- تحفيز التفاعلات كالإنزيمات: يمكن للرنا -مثل البروتينات- التطوي لبنية ثلاثية الأبعاد لتشكيل بنية مركبة، تسمح هذه البنى لبعض جزيئات الرنا المحددة بالتصرف كأنزيمات ومن الأمثلة على ذلك: الريبوزيم، الريبوسوم، الريبونوكلياز P وبعض الإنترونات هي ريبوزيمات كذلك. توجد حجج تشير بصفة غير مباشرة أن جسيم توصيل وقص الرنا الرسول (جسيم التضفير) هو ريبوزيم كذلك [50] رغم أن الإثبات الرسمي لم يتم تقريره بعد.
- توجيه الإنزيمات: تُستخدم بعض جزيئات الرنا كعوامل مرافقة للبروتينات لتمكِّنها من تحديد واستهداف تسلسلات معينة، ومن الأمثلة على ذلك الرنا الصغير النووي (snoARN) الذي يوجه إنزيمات تعديل الرنا الريبوسومي، الرنا التيلوميرازي وهو عامل مرافق لإنزيم التيلوميراز الذي ينشئ نهايات الصبغيات.
- تنظيم التعبير الجيني: تلعب بعض جزيئات الرنا غير المشفرة دورا في تثبيط التعبير عن بعض الجينات أو مجموعة من الجينات كما هو الحال لدى الرنا المضاد للاتجاه الذي يترابط مع رنا مستهدف يمنع ترجمته إلى بروتين.
- يقوم الرنا الناقل أثناء عملية الترجمة بنقل وتوجيه الأحماض الأمينية للارتباط بالبروتين الناتج.
أنواع الرنا

نظرة عامة
يقوم الرنا الرسول بنقل المعلومة من الدنا إلى الريبوسوم وهو موقع تخليق البروتين (الترجمة) في الخلية، ويحدد تشفير تسلسله تسلسل الأحماض الأمينية في البروتين الناتج.[51] مع ذلك العديد من جزيئات الرنا لا تشفر البروتين (حوالي 97% من جزيئات الرنا الناتجة عن النسخ غير مشفرة للبروتين لدى حقيقيات النوى.[52][53][54][55]). يمكن تخليق جزيئات الرنا غير المشفرة مباشرة من جيناتها في الدنا، ويمكن كذلك أن تنتج من إنترونات الرنا الرسول.[56] من أشهر الأمثلة على جزيئات الرنا غير المشفرة: الرنا الناقل والرنا الريبوسومي وكلاهما له دور في عملية الترجمة.[8] يقوم الرنا غير المشفر بتنظيم التعبير الجيني ومعالجة الرنا وأدوار أخرى، بعض جزيئات الرنا قادرة على تحفيز تفاعلات كيميائية مثل القص والارتباط بجزيئات رنا أخرى،[57] وتحفيز تكوين الرابطة الببتيدية في الريبوسوم.[11]
الرنا الرسول
لا تُستخدم المعلومة الوراثية الموجودة في الدنا من طرف الخلية مباشرة لتخليق البروتينات، بل تُستخدم نسخٌ مؤقتة منها تسمى الرنا الرسول.[58] يحمل كل رنا رسول سيسترونا واحدا أو عدة سيسترونات أي نسخة من جين واحد أو عدة جينات (رنا رسول عديد السيسترونات).[59] لا يحتوى الرنا الرسول سوى على معلومة إحدى سلسلتي الدنا، أي السلسلة القالب ولا يحتوي على معلومة السلسلة المكملة. يختلف تسلسل الجين المتواجد في الدنا عن نظيره في الرنا الرسول الناضج الذي تعرض إلى تعديلات أهمها التضفير الذي يزيل المناطق غير المشفرة. يُخلَّقُ الرنا الرسول في نواة الخلية ثم ينتقل إلى السيتوبلازم ليُترجم بواسطة الريبوسوم إلى بروتين،[13] وعلى عكس الدنا الذي هو جزيء معمر يتواجد طوال فترة عمر الخلية، الرنا الرسول له فترة محدودة تتراوح بين عدة دقائق إلى عدة ساعة يتم بعدها تحليله وإعادة تدويره.
يتكون الرنا الرسول من ثلاث مناطق مميزة: منطقة 5' غير مترجمة (5′-UTR) تقع عكس التيار في السيسترون الذي يحملها، منطقة مشفرة، ومنطقة 3' غير مترجمة (3′-UTR).[13] تحتوى المنطقة 5' غير المترجمة على إشارات الترجمة التي تسمح بتوظيف الريبوسوم على السيسترون، يساهم الرنا الناقل في عملية الترجمة بنقل وإحضار الأحماض الأمينية الضرورية للتخليق الحيوي للبروتين. داخل الريبوسوم تقوم جزيئات الرنا الناقل باستخدام ضد الكودون الخاص بها للارتباط بثلاث قواعد -أو كودونات- من تسلسل الرنا الرسول، وحين يكون الارتباط كودون-ضد الكودون صحيحا يضيف الريبوسوم الحمض الأميني المحمول بواسطة الرنا الناقل إلى سلسلة البروتين التي في طور التخليق. العلاقة بين الكودونات والأحماض الأمينية تشكل الشيفرة الجينية.[60]

وظيفة الرنا الرسول متعددة، فهو يسمح بالحفاظ على مادة الدنا الأساسية من الاستخدام المباشر في الترجمة. يمنح تواجد الرنا الرسول للخلية آلية أساسية في تنظيم دورة إنتاج البروتين الذي يتغير الاحتياج الخلوي إليه حسب الوسط، نوع الخلية ومرحلة النمو، تنظيم نسخ الدنا إلى الرنا يتم بواسطة عوامل نسخ محددة تعمل على محفزات الجينات المستهدفة، فحين تبلغ كمية البروتين مستوى كافيا تُثبط عملية نسخ الرنا الرسول ويتم تحليله وتتوقف عملية إنتاج البروتين.

- بالأصفر: موقع ارتباط الحمض الأميني.
- بالبنفسجي: الجذع المستقبل. - بالأخضر: حلقة TΨC.
- بالأحمر: التفرع D. - بالبرتقالي: الحلقة المتغيرة.
- بالأزرق: حلقة الكودون المضاد. - بالرمادي: الكودون المضاد.
الرنا الناقل
الرنا الناقل هو أحد أنواع الرنا القصيرة ويتراوح طوله بين 70 و100 نوكليوتيدة ويقوم بنقل الأحماض الأمينية إلى الريبوسوم أثناء الترجمة.[62]. بنيته ثلاثية الأبعاد على شكل ورقة النفل وتتكون من أربع حلقات جذعية، تحتوي إحدى هذه الحلقات على الكودون المضاد وهو ثلاث نوكليوتيدات ترتبط بكودونٍ أثناء ترجمة الرنا الرسول في الريبوسوم.[63] الطرف المقابل لحلقة ضد الكودون يحمل الحمض الأميني الموافق للكودون ويكون مرتبطا بالرنا عبر رابطة إستر في النهاية 3′-OH. يُحفَّز تكوين رابطة الإستر هذه بواسطة إنزيمات خاصة تسمى مخلقات أمينوسيل الرنا الناقل. بمنظور ثلاثي الأبعاد، تتطوى بنية ورقة النفل الخاصة بالرنا الناقل على شكل حرف L يكون ضد الكودون في أحد الأطراف والحمض الأميني المؤستر في الطرف الآخر.[64]
جميع الخلايا الحية تمتلك مجموعة من جزيئات الرنا الناقل المختلفة التي تحمل عدة أحماض أمينية وقادرة على قراءة عدة كودونات. تعتبر جزيئات الرنا "موائمات" بين التسلسل الجيني والبروتيني، وكان فرنسيس كريك هو من اقترح وجود مثل هذه الموائمات قبل اكتشافها سنة 1958.[65]
الرنا المحفز أو الريبوزيم

اكتُشِف الرنا الذي يملك قدرات تحفيزية في العقد 1980 بواسطة فريق توماس تشيك الذي عمل على إنترونات جين الرنا الريبوسومي لكائن أولي مهدب يسمى رباعية الغشاء،[66] وبواسطة فريق سيدني ألتمان الذي درس الريبونزكلياز P وهو الإنزيم المسؤول عن نضوج الرنا الرسول.[67] وحصل تشيك وسيدني على جائزة نوبل في الكيمياء سنة 1989 تقديرا لاكتشافهم هذا.
في هاذين الاكتشافين، كان الرنا وحده قادرا على تحفيز عملية قص أو أسترة معينة بغياب البروتينات. سُميت جزيئات الرنا المحفزة هذه ريبوزيمات لكونها إنزيمات تتكون من حمض نووي ريبوزي. إنترون رباعية الغشاء قادرٌ على التضفير الذاتي وكان ركيزة نفسه، في حين أن الريبنوكلياز P هو إنزيم يعمل على عدة ركائز.
بعد هذه اكتشافات الأولية تم اكتشاف العديد من الريبوزيمات الطبيعية:
- الرنا الخاص بالفيرويدات أو الفيروسات الصغيرة (فيروسويدات) القادرة على قص نفسها.[68]
- توجد اليوم حجج قوية مبنية على صور ثلاثية الأبعاد تؤكد أن الريبوسوم في حد ذاته عبارة عن ريبوزيم.[69] الموقعان النشطان بالريبوسوم: مركز فك التشفير في الوحدة الفرعية الصغيرة ومركز بيبتيديل ترانسفيراز الذي يشكل الروابط الببتيدية مكونان حصريا من الرنا الريبوسومي.
- جسيم التضفير الذي يحفز قص الإنترونات ووصل الإكسونات في الرنا الرسول لدى حقيقيات النوى من الممكن كذلك أن يكون ريبوزيما.[50]
- بعض الريبوسويتشات -وهي مناطق تنظيمية في الرنا الرسول- تملك نشاطا إنزيميا في القص عند تواجد ربيطة.[70]
- توجد كذلك ريبوزيمات مصنعة، والتي يتم تصنيعها في المختبر بواسطة تقنيات مثل سيليكس.[71] حيث من الممكن تصنيع رنا تحفيزي قادر على تحفيز كمية كبيرة ومتنوعة من التفاعلات الكيميائية والارتباط بربائط مختلفة، وفُسر هذا الأمر على أنه حجة لصالح فرضية عالم الرنا. في بعض الأحيان تسمى جزيئات الرنا المصنعة هذه أبتمرات لأنها "قادرة، apte" على تنفيذ المهام الموكلة لها.[71]
بشكل عام، التطوي الخاص لهذه الريبوزيمات إلى بنى محددة هو ما يسمح لها بالتعرف على ركائزها وتحفيز تفاعلاتها، كما هو الحال عند الإنزيمات البروتينية.
رنا منظم
أول منظِّمات التعبير الجيني المعروفة كانت بروتينات تسمى مثبطات ومنشطات، وهي منظمات ذات مواقع ارتباط قصيرة محددة داخل مناطق المعزز بالقرب من الجينات المراد تنظيمها.[72] وُجد حديثا أن جزيئات الرنا تنظم التعبير الجيني كذلك، حيث توجد العديد من العمليات المعتمدة على الرنا لدى حقيقيات النوى تنظم التعبير الجيني في مختلف المراحل، مثل تداخل الرنا الذي يثبط الجينات بعد عملية النسخ، الرنا الطويل غير المشفر الذي يكبت تخليق مناطق من الكروماتين والرنا المُعزِّز الذي يزيد مقدار التعبير الجيني.[73] فضلا عن هذه الآليات لدى حقيقيات النوى، وُجد أن كلا من البكتيريا والعتائق تستخدم جزيئات رنا معدلة على نطاق واسع. الرنا الصغير البكتيري ونظام كريسبر أمثلة على أنظمة الرنا المعدلة لدى بدائيات النوى.[74] حصل فاير وميلو على جائزة نوبل في الطب أو علم وظائف الأعضاء سنة 2006 لاكتشافهما الرنا الميكروي (miRNA) وهو جزيء رنا قصير يمكنه الترابط قاعديا مع جزيئات الرنا الرسول.[75]

- تداخل الرنا بواسطة الرنا الميكروي: مستويات التعبير عن العديد من الجينات بعد النسخ يمكن التحكم فيها بواسطة تداخل الرنا والذي تترابط فيه جزيئات الرنا الميكروي قاعديا مع مناطق من الرنا الرسول وتستهدفه ليتم تحليله (الصورة).[76] هذه العملية المبنية على تضاد الاتجاه تتكون من مراحل أولها معالجة الرنا الميكروي لكي يتمكن من الترابط قاعديا مع مناطق من الرنا الرسول. وحين يحدث الترابط تقوم بروتينات أخرى بتوجيه الرنا الرسول ليتم تفكيكه بواسطة النوكلياز.
- الرنا النويي الصغير: (snoARN) وهي جزيئات رنا قصيرة داخل نوية خلايا حقيقيات النوى تقوم بتنظيم التعديلات على الرنا الريبوسومي، وبشكل خاص مثيلة أكسجين الذرة 2 بواسطة الرنا النويي C/D وتعديل اليوريدين بواسطة الرنا النويي H/ACA56. تسمح هذه الآلية بالتعديل المحدد لعدة مناطق في الرنا الريبوسومي بواسطة إنزيم واحد فقط باستخدام العديد من جزيئات الرنا النويي كموجهات. في الغالب يتم تشفير سلالسل الرنا النووي بواسطة تسلسلات الإنترونات.[77]
- رنا طويل غير مشفر: (lncRNA) هو رنا يزيد طوله عن 200 نوكليوتيدة ولا تتم ترجمته إلى بروتين.[78] دوره في البداية كان غامضا وكان يُعرف بأن Xist وجزيئات رنا طويلة غير مشفرة أخرى مسؤولة عن تعطيل الصبغي X، ثم أظهرت جيني لي وآخرون أنه يقوم بتثبيط كتل من الكروماتين عبر توظيف مركب عديد الأقماع لكي لا يتم نسخ الرنا الرسول منها.[79] تساهم جزيئات رنا طويلة أخرى في تنظيم تعدد قدرات الخلية الجذعية وانقسام الخلية.[78] يسمح طول الرنا الكبير له باتخاذ بنى ثلاثية الأبعاد معقدة تسمح له بالتآثر مع مختلف العوامل المرافقة مثل hnRNP-K وPRC2 (وهما مثبطان للنسخ) يتم توجيه هذه المركبات بفضل الرنا الطويل نحو تسلسلات التنظيم الخاصة بالجينات ليتم تثبيط التعبير عنها. علاقة الرنا الطويل مع الدنا تستلزم ترابطا قاعديا بينهما وهذا يعني تشكل لولب ثلاثي دنا-دنا-رنا.[80].
- الرنا المكون للتيلوميراز: (TERC ) وحدة الرنا الفرعية الخاصة بالتيلوميراز تحتوي على رنا له علاقة بالنسخ العكسي الذي يُخلِّق القسيمات الطرفية في نهاية الصبغيات. يحتوي هذا الرنا على تسلسل يعمل كركيزة للتيلوميراز ليخلق دنا متكامل التسلسل.[81]
- رنا معزز: لم يتضح بعد إن كان الرنا المُعزِّز فئة مستقلة من الرنا ذات أطوال مختلفة أم فئة خاصة من الرنا الطويل. في كلا الحالتين فإن نسخه يتم من تسلسل المعزز وهي تسلسلات تنتظيمية في الدنا بالقرب من الجينات التي تنظمها.[78][82] تقوم هذه الجزيئات بتظيم نسخ الجين بزيادته عند الحاجة وذلك تحت رقابة المعزز الذي تم نسخها منه.[78][83]
رنا منظم لدى بدائيات النوى
اعتُقد في البداية أن الرنا المنظِم خاصٌ بحقيقيات النوى فقط، وكان ذلك جزءا من تفسير ملاحظةِ أن النسخ لدى الكائنات العليا كان أكثر من المتوقع، لكن بمجرد بدء البحث عن الرنا المنظِم في البكتيريا اكتشف أنه موجود لديها كذلك.[74] حاليا، الوفرة الطبيعية لآليات تنظيم التعبير الجيني بالرنا تُناقش على أنها حجة لصالح فرضية عالم الرنا .[73][84] يعمل الرنا الصغير البكتيري عبر الترابط عكس الاتجاه مع الرنا الرسول لتنظيم الترجمة بإنقاصها، سواء بالتأثير على استقرارية الرنا الرسول أو قابلية الإرتباط مقرون.[73] اكتشفت الريبوسويتشات كذلك لدى البكتيريا، وهي تسلسلات رنا تعمل على التنظيم تفارغيا، حيث تغير شكلها عند الارتباط بالمستقلبات لكي يكسبوا أو يفقدوا القدرة على التنظيم الجيني.[85][86]. لدى العتائق أيضا آليات تنظيم بالرنا،[87] نظام كريسبر -الذي يُستخدم حديثا لتعديل الدنا في الموقع- يعمل بواسطة جزيئات رنا منظمة في العتائق والبكتيريا لتوفير حماية ضد الفيروسات الغازية.[73][88]
الرنا الدائري

الرنا الدائري ويرمز له (circRNA) هو أحد أنواع الرنا منفردة السلاسل والتي تشكل -على عكس الرنا الخطي الشائع- حلقة تساهمية مغلقة تكون فيها النهايتان 3' و5' مترابطتان مع بعظهما. تمنح هذه الميزة العديد من الخصائص للرنا الدائري، والعديد من هذه الخائص لم تيم اكتشافها إلا حديثا.
تنشأ جزيئات الرنا الدائرية من جينات مشفرة للبروتين، وقد صنفت على أنها رنا غير مشفر لكن ظهر حديثا أنها تفشر البروتينات.[89][90] بعض الرنا الدائري أظهر إمكانيةً لكونه رنا منظم، ومثل العديد المصاوغات غير الشفرة، الوظيفة البيولوجية لمعظم جزيئات الرنا الدائري غير واضحة.
لأن الرنا الدائري لا يملك النهايتين 5' و3' فهو مقاوم للتفكك بواسطة النوكلياز الخارجي، ويفترض أنه أكثر استقرار من معظم الرنا الخطي المتواجد في الخلايا.[91]
جينومات الرنا

مثل الدنا يمكن للرنا حمل وتخزين المعلومة الوراثية، فيروسات الرنا لها جينومات مكونة حصريا من الرنا مثل فيروس الإنفلونزا، فيروس العوز المناعي البشري، فيروس التهاب الكبد C، فيروس شلشل الأطفال وفيروس إيبولا وتقوم بتشفير بعض البروتينات. يتضاعف الجينوم الفيروسي بواسطة بعض هذه البروتينات في حين تقوم البروتينات الأخرى بحماية الفيروس أثناء انتقاله إلى خلايا مضيفة أخرى. الفيرويدات هي نوع آخر من الممرضات، ;تتكون من الرنا فقط ولا تشفر أية بروتينات وتتضاعف بواسطة بوليميراز خلية النبات المضيفة.[92]
تنقسم فيروسات الرنا حسب طريقة تضاعفها إلى ثلاث أنواع:
- الرنا مزدوج السلاسل: ويحتوي من واحد إلى عدة أنواع من جزيئات الرنا، كل واحد منها يشفر بروتينا أو عدة بروتينات.[93]
- رنا أحادي السلسلة موجب الاتجاه: يستخدم جينومها مباشرة كرنا رسول، تترجمه ريبوسومات المضيف إلى بروتين وحيد يتم تعديله بواسطة بروتينات المضيف والفيروس لتشكيل مختلف البروتينات المطلوبة للتضاعف. أحد هذه البروتينات هو بوليميراز الرنا المعتمد على الرنا (منتسخة الرنا)، الذي ينسخ الرنا الفيروسي لتشكيل نسخة مزدوجة السلاسل. بدورها توجه هذه النسخة المزدوجة تكوين جزيئات رنا جديدة.[94]
- رنا أحادي السلسلة سالب الاتجاه: يتطلب نسخ جينومه بواسطة منتسخة الرنا لتشكيل رنا موجب الاتجاه، وهذا يعني أن على الفيروس إحضار إنزيم نسخ الرنا معه. بعدها يعمل جزيء الرنا موجب الاتجاه كرنا رسول ويترجم إلى بروتينات بواسطة الريبوسوم.[95]
لدى الفيروسات الراجعة جينوم ذو سلسلة رنا أحادية لكنها لا تعتبر من فيروسات الرنا لأنها تستخدم دنا وسيط للتضاعف. يحوِّل إنزيم النسخ العكسي الفيروسي -الذي يأتي من الفيروس نفسه بعد أن يزيل كسائه البروتيني- الرنا الفيروسي إلى سلسلة دنا مكملة والتي تُنسخ بدورها لتكوين جزيئة دنا فيروسية مزدوجة السلاسل. بعد ذلك يقوم إنزيم الدمج بدمج سلسلة الدنا المزدوجة هذه في جينوم المضيف، التعبير عن الجينات الفيروسية المدمجة قد يقود إلى نشوء فيروسات جديدة.[96]
فرضية عالم الرنا
استعمالات علاجية
الرنا الرسول
اقتٌرِح استخدام جزيئات رنا رسول كاملة الطول منذ بداية حقبة التقانة الحيوية، لكنها لم تلق اهتماما حتى العقد 2010، حين أُسِست شركة "مودرنا ثريبيوتيكا" وتمكنت من جمع مليار دولار تقريبا لتمويل المشروع خلال الأعوام الثلاثة الأولى.[97][98][99][100] نظريا جزيئات الرنا الرسول المعدلة يمكن أن تترجمها الخلية إلى بروتينات يمكنها معالجة الأمراض أو استخدامها كلقاحات، أو حتى أن تقود البروتينات الخلايا الجذعية الأصلية إلى التمايز بالطريقة المرغوب فيها.[101][102] لكن الإشكال الأساسي للعلاج بالرنا يتركز حول توصيل الرنا إلى الخلايا المستهدفة، أكثر من تركيزه على التسلسل الذي سيتم توصيله.[98] الرنا غير المعدل سيتم تفكيكه طبيعيا بعد تحضيره، وقد يثير النظام المناعي للجسم ليهاجمه كسجم دخيل، بالإضافة إلى أنه غير قابل للنفاذ عبر الغشاء الخلوي.[102] وحين يكون داخل الخلية يجب أن يغادر آلية النقل ليقوم بعمله في السيتوبلازم أين توجد الريبوسومات التي تترجمه إلى بروتينات.[101]
الرنا الصغير المتدخل
يُستخدم الرنا اليوم في العديد من التطبيقات في علم الأحياء الجزيئي، وبشكل خاص عبر عملية تداخل الرنا والتي يتم فيها إدراج جزيئات رنا قصيرة مزدوجة السلاسل تسمى الرنا الصغير المتدخل (siRNA) داخل خلايا حقيقيات النوى. تُستخدم جزيئات الرنا هذه التي طولها حوالي 20 زوج قاعدي بواسطة آلية خلوية قادرة على تفكيك الرنا بشكل محدد. لا يتم تفكيك سوى جزيئات الرنا الرسول التي تحوي تسلسلا مماثلا للرنا المتدخل، وهذا يتيح إمكانية تخفيض التعبير عن البروتينات بشكل محدد.[103] هذا النهج التقني أكثر بساطة وسرعة من تحضير سلالات فئران معدلة جينية [الإنجليزية] ويسمى knock down. التجارب التي تستخدم هذه التقنية لأغراض علاجية هي في مرحلة الدراسة، على سبيل المثال: تُدرس إمكانية استهداف الجينات الفيروسية لمحاربة العدوى والأمراض، أو الجينات الورمية للقضاء على السرطان.[104] لكن يتطلب ذلك جعل جزيئات الرنا المتدخل مستقرة لمنع تحليلها بواسطة الريبونوكليازات وتوجيه نشاطها نحو الخلايا المستهدفة.
التاريخ
اكتشفت الأحماض النووية عام 1868 من قبل يوهان مسمياً إياها بداية (النووين) (بالإنجليزية: Nuclein) بما أنه وجده بداية ضمن النواة الخلوية. لكن لاحقاً سرعان ما اكتشف أن الخلايا طلائعية النواة التي لا تحتوي نواة حقيقية تحوي أيضا ضمن الستوبلازم الحموض النووية. بدأ البحث في دور RNA في اصطناع البروتينات في عام 1939 على أساس تجارب أجريت من قبل العالم السويدي كاسبيرسون (Torbjörn Caspersson) والعالم البلجيكي جان براشيه (بالفرنسية: Jean Brachet) وجاك شولتز (بالإنجليزية: Jack Schultz). اما هوبرت كانترين فهو أول من تحدث عن دور RNA كناقل للأحماض النووية إلى الريبوسومات لإتمام عملية تكوين البروتين.
اقرأ أيضا
المراجع
- ^ What is RNA? | RNA Society نسخة محفوظة 08 أكتوبر 2017 على موقع واي باك مشين.
- ^ DNA versus RNA نسخة محفوظة 19 نوفمبر 2016 على موقع واي باك مشين.
- ^ الحمض النووي الريبوزي المرسال
- ^ آر إن إيه نووي
- ^ "RNA: The Versatile Molecule". جامعة يوتا. 2015.
- ^ "Nucleotides and Nucleic Acids" (PDF). جامعة كاليفورنيا (لوس أنجلوس).
- ^ Shukla RN (2014). Analysis of Chromosomes. ISBN:978-93-84568-17-7.
- ^ ا ب Berg JM، Tymoczko JL، Stryer L (2002). Biochemistry (ط. 5th). WH Freeman and Company. ص. 118–19, 781–808. ISBN:978-0-7167-4684-3. OCLC:179705944.
- ^ Tinoco I، Bustamante C (أكتوبر 1999). "How RNA folds". Journal of Molecular Biology. ج. 293 ع. 2: 271–81. DOI:10.1006/jmbi.1999.3001. PMID:10550208.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|last-author-amp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Higgs PG (أغسطس 2000). "RNA secondary structure: physical and computational aspects". Quarterly Reviews of Biophysics. ج. 33 ع. 3: 199–253. DOI:10.1017/S0033583500003620. PMID:11191843.
- ^ ا ب Nissen P، Hansen J، Ban N، Moore PB، Steitz TA (أغسطس 2000). "The structural basis of ribosome activity in peptide bond synthesis". Science. ج. 289 ع. 5481: 920–30. Bibcode:2000Sci...289..920N. DOI:10.1126/science.289.5481.920. PMID:10937990.
- ^ ا ب Lee JC، Gutell RR (ديسمبر 2004). "Diversity of base-pair conformations and their occurrence in rRNA structure and RNA structural motifs". Journal of Molecular Biology. ج. 344 ع. 5: 1225–49. DOI:10.1016/j.jmb.2004.09.072. PMID:15561141.
- ^ ا ب ج H.، Lodish (2005). Biologie moléculaire de la cellule (ط. 3). Bruxelles: de Boeck. ISBN:978-2804148027.
- ^ Wolfram, Saenger (1984). Principles of nucleic acid structure (بالإنجليزية). Springer. ISBN:0-387-90762-9.
- ^ Jan, Barciszewski (1999). RNA biochemistry and biotechnology (بالإنجليزية). Springer. ISBN:0-7923-5862-7.
- ^ Barciszewski J، Frederic B، Clark C (1999). RNA biochemistry and biotechnology. Springer. ص. 73–87. ISBN:978-0-7923-5862-6. OCLC:52403776.
- ^ Nucleic Acid Architecture-Conformational considerations-Ribose ring pucker نسخة محفوظة 17 مايو 2018 على موقع واي باك مشين.
- ^ Sugar pucker correlates with phosphorus-base distance نسخة محفوظة 01 أغسطس 2018 على موقع واي باك مشين.
- ^ (بالإنجليزية) M. Sudaralingam, « Stereochemistry of nucleic acids and their constituents. IV. Allowed and preferred conformations of nucleosides, nucleoside mono-, di-, tri-, tetraphosphates, nucleic acids and polynucleotides », في Biopolymers, vol. 7, no 6, 1969, ص. 821-860 [النص الكامل]
- ^ (بالإنجليزية) R. Langridge et P.J. Gomatos, « The Structure of RNA. Reovirus RNA and transfer RNA have similar three-dimensional structures, which differ from DNA. », في Science, vol. 141, no 4, 1963, ص. 694-698 [lien PMID]
- ^ Jankowski JA، Polak JM (1996). Clinical gene analysis and manipulation: Tools, techniques and troubleshooting. Cambridge University Press. ص. 14. ISBN:978-0-521-47896-0. OCLC:33838261.
- ^ Yu Q، Morrow CD (مايو 2001). "Identification of critical elements in the tRNA acceptor stem and T(Psi)C loop necessary for human immunodeficiency virus type 1 infectivity". Journal of Virology. ج. 75 ع. 10: 4902–06. DOI:10.1128/JVI.75.10.4902-4906.2001. PMC:114245. PMID:11312362.
- ^ Elliott MS، Trewyn RW (فبراير 1984). "Inosine biosynthesis in transfer RNA by an enzymatic insertion of hypoxanthine". The Journal of Biological Chemistry. ج. 259 ع. 4: 2407–10. PMID:6365911.
- ^ Cantara WA، Crain PF، Rozenski J، McCloskey JA، Harris KA، Zhang X، Vendeix FA، Fabris D، Agris PF (يناير 2011). "The RNA Modification Database, RNAMDB: 2011 update". Nucleic Acids Research. ج. 39 ع. Database issue: D195–201. DOI:10.1093/nar/gkq1028. PMC:3013656. PMID:21071406.
- ^ Söll D، RajBhandary U (1995). TRNA: Structure, biosynthesis, and function. ASM Press. ص. 165. ISBN:978-1-55581-073-3. OCLC:183036381.
- ^ Kiss T (يوليو 2001). "Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs". The EMBO Journal. ج. 20 ع. 14: 3617–22. DOI:10.1093/emboj/20.14.3617. PMC:125535. PMID:11447102.
- ^ King TH، Liu B، McCully RR، Fournier MJ (فبراير 2003). "Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center". Molecular Cell. ج. 11 ع. 2: 425–35. DOI:10.1016/S1097-2765(03)00040-6. PMID:12620230.
- ^ (بالإنجليزية) H.R. Drew, R.M. Wing, T. Tanako, C Broka, S Tanaka, K Itakura et R.E. Dickerson, « Structure of a B-DNA dodecamer: conformation and dynamics. », في Proc. Natl. Acad. Sci. USA, vol. 78, no 4, avril 1981, ص. 2179-2183 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) Peter S. Klosterman, Sapan A. Shah et Thomas A. Steitz, « Crystal structures of two plasmid copy control related RNA duplexes: An 18 base pair duplex at 1.20 A resolution and a 19 base pair duplex at 1.55 A resolution. », في Biochemistry, vol. 38, no 45, 1999, ص. 14784-14792 [النص الكامل, lien PMID]
- ^ Blevins T، Rajeswaran R، Shivaprasad PV، Beknazariants D، Si-Ammour A، Park HS، Vazquez F، Robertson D، Meins F، Hohn T، Pooggin MM (2006). "Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing". Nucleic Acids Research. ج. 34 ع. 21: 6233–46. DOI:10.1093/nar/gkl886. PMC:1669714. PMID:17090584.
- ^ Jana S، Chakraborty C، Nandi S، Deb JK (نوفمبر 2004). "RNA interference: potential therapeutic targets". Applied Microbiology and Biotechnology. ج. 65 ع. 6: 649–57. DOI:10.1007/s00253-004-1732-1. PMID:15372214.
- ^ Schultz U، Kaspers B، Staeheli P (مايو 2004). "The interferon system of non-mammalian vertebrates". Developmental and Comparative Immunology. ج. 28 ع. 5: 499–508. DOI:10.1016/j.dci.2003.09.009. PMID:15062646.
- ^ Whitehead KA، Dahlman JE، Langer RS، Anderson DG (2011). "Silencing or stimulation? siRNA delivery and the immune system". Annual Review of Chemical and Biomolecular Engineering. ج. 2: 77–96. DOI:10.1146/annurev-chembioeng-061010-114133. PMID:22432611.
- ^ (بالإنجليزية) J.M. Rosenberg, N.C. Seeman, J.J. Kim, F.L. Suddath, H.B. Nicholas et A. Rich, « Double helix at atomic resolution. », في Nature, vol. 243, no 5403, 1973, ص. 150-154 [النص الكامل, lien PMID (pages consultées le 6 novembre 2009)]
- ^ (بالإنجليزية) R.O. Day, N.C. Seeman, J.M. Rosenberg et A. Rich, « A Crystalline Fragment of the Double Helix: The Structure of the Dinucleoside Phosphate Guanylyl-3',5'-Cytidine. », في Proc. Natl. Acad. Sci. USA, vol. 70, no 3, Mars 1973, ص. 849-853 [النص الكامل, lien PMID (pages consultées le 6 novembre 2009)]
- ^ (بالإنجليزية) Alexander Rich et David R. Davies, « A new two stranded helical structure: Polyadenylic acid and polyuridylic acid », في J. Am. Chem. Soc., vol. 78, no 14, 1956, ص. 3548-3549 [النص الكامل (pages consultées le 6 novembre 2009)]
- ^ (بالإنجليزية) D.E. Draper, « Protein-RNA recognition », في Annu. Rev. Biochem., vol. 64, 1995, ص. 593-620 [النص الكامل, lien PMID (pages consultées le 6 novembre 2009)]
- ^ Nudler E، Gottesman ME (أغسطس 2002). "Transcription termination and anti-termination in E. coli". Genes to Cells. ج. 7 ع. 8: 755–68. DOI:10.1046/j.1365-2443.2002.00563.x. PMID:12167155.
- ^ Hansen JL، Long AM، Schultz SC (أغسطس 1997). "Structure of the RNA-dependent RNA polymerase of poliovirus". Structure. ج. 5 ع. 8: 1109–22. DOI:10.1016/S0969-2126(97)00261-X. PMID:9309225.
- ^ Ahlquist P (مايو 2002). "RNA-dependent RNA polymerases, viruses, and RNA silencing". Science. ج. 296 ع. 5571: 1270–73. Bibcode:2002Sci...296.1270A. DOI:10.1126/science.1069132. PMID:12016304.
- ^ (بالإنجليزية) B.A. Hamkalo et O.L. Miller, « Electronmicroscopy of genetic activity », في Annu. Rev. Biochem., vol. 42, 1973, ص. 376-396 [lien PMID]
- ^ (بالإنجليزية) S.T. Smale et J.T. Kadonaga, « The RNA polymerase II core promoter », في Ann. Rev. Biochem., vol. 72, 2003, ص. 449-479 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) R.P. Lifton, M.L. Goldberg, R.W. Karp et D.S. Hogness, « The organization of the histone genes in Drosophila melanogaster: functional and evolutionary implications », في Cold Spring Harb. Symp. Quant. Biol., vol. 42, 1978, ص. 1047-1051 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) D. Pribnow, « Nucleotide sequence of an RNA polymerase binding site at an early T7 promoter », في Proc. Natl. Acad. Sci. USA, vol. 72, 1975, ص. 784-788 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) W.R. McClure et Y. Chow, « The kinetics and processivity of nucleic acid polymerases », في Methods Enzymol., vol. 64, 1980, ص. 277-297 [النص الكامل, lien PMID]
- ^ (الإنجليزية) H. Bremer et P.P. Dennis, « Modulation of chemical composition and other parameters of the cell by growth rate », dans F.C Neidhardt, R Curtiss, III, J.L Ingraham, E.C.C Lin, K.B Low, B Magasanik, W.S Reznikoff, M Riley, M Schaechter et H.E Umbarger, Escherichia coli and Salmonella typhimurium Cellular and Molecular Biology, Washington, DC, ASM Press, (ISBN 0-914826-89-1, lire en ligne), p. 1553-1569
- ^ (بالإنجليزية) S. Adhya et M. Gottesman, « Control of transcription termination », في Annu. Rev. Biochem., vol. 47, 1978, ص. 967-996 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) M.S. Ciampi, « Rho-dependent terminators and transcription termination », في Microbiology, vol. 152, 2006, ص. 2515-2528 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) M. Edmonds, « A history of poly A sequences: from formation to factors to function », في Prog. Nucleic Acid res. Mol. Biol., vol. 71, 2002, ص. 285-389 [النص الكامل, lien PMID]
- ^ ا ب (بالإنجليزية) S. Valadkhan, A. Mohammadi, Y. Jaladat et S. Geisler, « Protein-free small nuclear RNAs catalyze a two-step splicing reaction. », في Proc. Natl. Acad. Sci. USA, vol. 106, 2009, ص. 11901-11906 [lien PMID]
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعThe_Cell - ^ Mattick JS، Gagen MJ (سبتمبر 2001). "The evolution of controlled multitasked gene networks: the role of introns and other noncoding RNAs in the development of complex organisms". Molecular Biology and Evolution. ج. 18 ع. 9: 1611–30. DOI:10.1093/oxfordjournals.molbev.a003951. PMID:11504843.
- ^ Mattick JS (نوفمبر 2001). "Non-coding RNAs: the architects of eukaryotic complexity". EMBO Reports. ج. 2 ع. 11: 986–91. DOI:10.1093/embo-reports/kve230. PMC:1084129. PMID:11713189.
- ^ Mattick JS (أكتوبر 2003). "Challenging the dogma: the hidden layer of non-protein-coding RNAs in complex organisms" (PDF). BioEssays. ج. 25 ع. 10: 930–9. CiteSeerX:10.1.1.476.7561. DOI:10.1002/bies.10332. PMID:14505360. مؤرشف من الأصل (PDF) في 2009-03-06.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|deadurl=تم تجاهله (مساعدة) - ^ Mattick JS (أكتوبر 2004). "The hidden genetic program of complex organisms". Scientific American. ج. 291 ع. 4: 60–7. Bibcode:2004SciAm.291d..60M. DOI:10.1038/scientificamerican1004-60. PMID:15487671.[وصلة مكسورة]
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعtranscriptome - ^ Rossi JJ (يوليو 2004). "Ribozyme diagnostics comes of age". Chemistry & Biology. ج. 11 ع. 7: 894–5. DOI:10.1016/j.chembiol.2004.07.002. PMID:15271347.
- ^ (بالإنجليزية) S. Brenner, F. Jacob et M. Meselson, « An unstable intermediate carrying information from genes to ribosomes for protein synthesis. », في Nature, vol. 190, 1961, ص. 576-581
- ^ (بالإنجليزية) B.N. Ames et R.G. Martin, « Biochemical aspects of genetics: The operon. », في Annu. Rev. Biochem., vol. 33, 1964, ص. 235-258 [lien PMID]
- ^ (بالإنجليزية) C. Yanofsky, « Establishing the triplet nature of the genetic code. », في Cell, vol. 128, 2007, ص. 815-818 [lien PMID]
- ^ (بالإنجليزية) Huijing Shi et Peter B. Moore, « The crystal structure of yeast phenylalanine tRNA at 1.93 Å resolution: A classic structure revisited », في RNA, vol. 6, no 8, août 2000, ص. 1091-1105 [النص الكامل, lien PMID, lien DOI (pages consultées le 30 août 2014)]
- ^ (بالإنجليزية) M.B. Hoagland, M.L Stephenson, J.F. Scott, H.I. Hecht et P.C. Zamecnik, « A soluble ribonucleic acid intermediate in protein synthesis », في J. Biol. Chem., vol. 231, 1958, ص. 241-257 [lien PMID]
- ^ (بالإنجليزية) R.W. Holley, J. Apgar, G.A. Everett, J.T. Madison, M. Marquisee, S.H. Merrill, J.R. Penswick et A. Zamir, « Structure of a ribonucleic acid », في Science, vol. 147, 1965, ص. 1462-1465 [lien PMID]
- ^ (بالإنجليزية) J.D. Robertus, J.E. Ladner, J.T. Finch, D. Rhodes, R.S. Brown, B.F. Clark et A. Klug, « Structure of yeast phenylalanine tRNA at 3 A resolution. », في Nature, vol. 250, 1974, ص. 546–551 [lien PMID], (بالإنجليزية) S.H. Kim, F.L. Suddath, G.J. Quigley, A. McPherson, J.L. Sussman, A.H. Wang, N.C. Seeman et A. Rich, « Three-dimensional tertiary structure of yeast phenylalanine transfer RNA. », في Science, vol. 250, 1974, ص. 546–551 [lien PMID]
- ^ (بالإنجليزية) Francis H. Crick, « On protein synthesis », في Symp. Soc. Exp. Biol., vol. 12, 58, ص. 138-163 [النص الكامل, lien PMID]
- ^ (بالإنجليزية) K. Kruger, P.J. Grabowski, A.J. Zaug, J. Sands, D.E. Gottschling et T.R. Cech, « Self-splicing RNA: autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahymena. », في Cell, vol. 31, 1982, ص. 147-157 [lien PMID]
- ^ (بالإنجليزية) C. Guerrier-Takada, K. Gardiner, T. Marsh, N. Pace et S. Altman, « The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme. », في Cell, vol. 35, 1983, ص. 849-857 [lien PMID]
- ^ (بالإنجليزية) A.C. Forster, Davies, C.J. Hutchins et R.H. Symons, « Characterization of self-cleavage of viroid and virusoid RNAs. », في Methods Enzymol., vol. 181, 1990, ص. 583-607 [lien PMID]
- ^ (بالإنجليزية) T.R. Cech, « Structural biology. The ribosome is a ribozyme. », في Science, vol. 289, 2000, ص. 878-879 [lien PMID]
- ^ (بالإنجليزية) J.E. Barrick, K.A. Corbino, W.C. Winkler, A. Nahvi, M. Mandal, J. Collins, M. Lee, A. Roth, N. Sudarsan, I. Jona, J.K. Wickiser et R.R. Breaker, « New RNA motifs suggest an expanded scope for riboswitches in bacterial genetic control. », في Proc. Natl. Acad. Sci. USA, vol. 101, 2004, ص. 6421-6426 [lien PMID]
- ^ ا ب (بالإنجليزية) A.D. Ellington et J.W. Szostak, « In vitro selection of RNA molecules that bind specific ligands. », في Nature, vol. 346, 1990, ص.
818-822 [lien PMID]
(بالإنجليزية) C. Tuerk et L. Gold, « Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. », في Science, vol. 249, 1990, ص. 505-510 [lien PMID] - ^ F Jacob and J Monod (1961) "Genetic Regulatory Mechanisms in the Synthesis of Proteins. Journal of Molecular Biology 3: 318–56.
- ^ ا ب ج د Kevin Morris and John Mattick. (2014) “The rise of regulatory RNA” Nature Reviews Genetics15:423–37.
- ^ ا ب S. Gottesman (2005) “Micros for microbes: non-coding regulatory RNAs in bacteria.” Trends in Genetics 21,399–404.
- ^ "The Nobel Prize in Physiology or Medicine 2006". Nobelprize.org. Nobel Media AB 2014. Web. 6 Aug 2018. <http://www.nobelprize.org/nobel_prizes/medicine/laureates/2006/>
- ^ Fire et al. 1998 “Potent and Specific Genetic Interference by double stranded RNA in Ceanorhabditis elegans” Nature 391:806–11.
- ^ (بالإنجليزية) J. Liu, « Novel intron-encoded small nucleolar RNAs. », في Cell, vol. 75, 1993, ص. 403-405 [lien PMID]
- ^ ا ب ج د John L. Rinn and Howard Y. Chang. (2012) “Genome regulation by long noncoding RNAs” Annu. Rev. Biochem 81:1–25. دُوِي:10.1146/annurev-biochem-051410-092902
- ^ J Zhao, BK Sun, JA Erwin, JJ Song, and JT Lee. (2008) “Polycomb proteins targeted by a short repeat RNA to the mouse X chromosome.” Science 322:750–56. [PubMed: 18974356],
- ^ (بالإنجليزية) M. Huarte, T. Jacks et J.L. Rinn, « A Large Intergenic Noncoding RNA Induced by p53 Mediates Global Gene Repression in the p53 Response », في Cell, vol. 142, 2010, ص. 409-419 [lien PMID]
- ^ (بالإنجليزية) D. Shippen-Lentz et E.H. Blackburn, « Functional evidence for an RNA template in telomerase. », في Science, vol. 247, 1990, ص. 546-552 [lien PMID]
- ^ RJ Taft, CD Kaplan., C Simons, and JS Mattick, (2009). Evolution, biogenesis and function of promoter- associated RNAs. Cell Cycle 8, 2332–38.
- ^ UA Orom, T Derrien, M Beringer, K Gumireddy, A. Gardini, et al.(2010) ‘Long noncoding RNAs with enhancer-like function in human cells.” Cell 143:46–58. [PubMed: 20887892]
- ^ J.W. Nelson, R.R. Breaker (2017) "The lost language of the RNA World."Sci. Signal.10,eaam8812 1–11.
- ^ WC Winklef. (2005) “Riboswitches and the role of noncoding RNAs in bacterial metabolic control. “Curr. Opin. Chem. Biol. 9, 594–602.
- ^ BJ Tucker and RR Breaker (2005). “Riboswitches as versatile gene control elements.”Curr. Opin. Struct. Biol. 15, 342–48.
- ^ FJ Mojica, C Diez-Villasenor, E Soria, and G Juez, (2000) “Biological significance of a family of regularly spaced repeats in the genomes of archaea, bacteria and mitochondria.”Mol. Microbiol. 36, 244–46.
- ^ S Brouns, MM Jore, M Lundgren, E Westra, R Slijkhuis, A Snijders, M Dickman, K. Makarova, E. Koonin, J Van Der Oost. (2008) “Small CRISPR RNAs guide antiviral defense in prokaryotes” Science 321, 960–64. دُوِي:10.1126/science.1159689.
- ^ "New study shows circular RNA can encode for proteins". ساينس ديلي. 23 مارس 2017. اطلع عليه بتاريخ 2018-05-03.
- ^ Pamudurti، Nagarjuna Reddy؛ Bartok، Osnat؛ Jens، Marvin؛ وآخرون (أبريل 2017). "Translation of CircRNAs". Molecular Cell. ج. 66 ع. 1: 9–21.e7. DOI:10.1016/j.molcel.2017.02.021. PMC:5387669. PMID:28344080.

- ^ Jeck، WR؛ Sorrentino، JA؛ Wang، K؛ وآخرون (فبراير 2013). "Circular RNAs are abundant, conserved, and associated with ALU repeats". RNA. ج. 19 ع. 2: 141–57. DOI:10.1261/rna.035667.112. PMC:3543092. PMID:23249747.
- ^ Daròs JA، Elena SF، Flores R (يونيو 2006). "Viroids: an Ariadne's thread into the RNA labyrinth". EMBO Reports. ج. 7 ع. 6: 593–8. DOI:10.1038/sj.embor.7400706. PMC:1479586. PMID:16741503.
- ^ Gibrat JF، Mariadassou M، Boudinot P، Delmas B (2013). "Analyses of the radiation of birnaviruses from diverse host phyla and of their evolutionary affinities with other double-stranded RNA and positive strand RNA viruses using robust structure-based multiple sequence alignments and advanced phylogenetic methods". BMC Evol. Biol. ج. 13: 154. DOI:10.1186/1471-2148-13-154. PMC:3724706. PMID:23865988.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Francki، R.I.B؛ Fauquet، C. M.؛ Knudson، D. L.؛ Brown، F. (1991). Classification and nomenclature of viruses. Fifth report of the International Committee on Taxonomy of Viruses, Archives of Virology (Suppl. 2). ISBN:978-3-7091-9163-7.
- ^ Li CX, Shi M, Tian JH, Lin XD, Kang YJ, Chen LJ, Qin XC, Xu J, Holmes EC, Zhang YZ (2015) Unprecedented genomic diversity of RNA viruses in arthropods reveals the ancestry of negative-sense RNA viruses. Elife 4. doi: 10.7554/eLife.05378.
- ^ Kalendar R، Vicient CM، Peleg O، Anamthawat-Jonsson K، Bolshoy A، Schulman AH (مارس 2004). "Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes". Genetics. ج. 166 ع. 3: 1437–50. DOI:10.1534/genetics.166.3.1437. PMC:1470764. PMID:15082561.
- ^ Gregory Huang (6 ديسمبر 2012). "Moderna, $40M in Tow, Hopes to Reinvent Biotech with "Make Your Own Drug"". Xconomy.
- ^ ا ب Kaczmarek JC، Kowalski PS، Anderson DG (يونيو 2017). "Advances in the delivery of RNA therapeutics: from concept to clinical reality". Genome Medicine. ج. 9 ع. 1: 60. DOI:10.1186/s13073-017-0450-0. PMC:5485616. PMID:28655327.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Crow، David (7 سبتمبر 2017). "Moderna pledge sets investor pulses racing; Biotech group promises to rewrite rules of drug development - though sceptics say $5bn valuation is undeserved". Financial Times.
{{استشهاد بخبر}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Adams, Ben (14 Sep 2017). "Moderna changes up R&D model, posts cancer, CV trial updates". FierceBiotech (بالإنجليزية).
{{استشهاد بخبر}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(help) - ^ ا ب Hajj KA، Whitehead KA (12 سبتمبر 2017). "Tools for translation: non-viral materials for therapeutic mRNA delivery". Nature Reviews Materials. ج. 2 ع. 10: 17056. DOI:10.1038/natrevmats.2017.56.
- ^ ا ب Gousseinov E، Kozlov M، Scanlan C (15 سبتمبر 2015). "RNA-Based Therapeutics and Vaccines". Genetic Engineering News.
- ^ (بالإنجليزية) A. Fire, S. Xu, M. Montgomery, S. Kostas, S. Driver et C. Mello, « Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. », في Nature, vol. 391, 1998, ص. 806-811
- ^ Claude Hélène, « Les promesses de l'ARN thérapeutique = Genetic interference by RNA. », في Le Concours Médical, vol. 124, 2002, ص. 2550-2552
| في كومنز صور وملفات عن: حمض نووي ريبوزي |

