رابطة هيدروجينية


الرابطة الهيدروجينية أو الترابط الهيدروجيني هو ترابط يحدث بين الجزيئات التي تحتوي على رابطة تساهمية قطبية يشترط فيها تواجد إحدى الذرات ذات الكهروسالبية العالية مثل فلور، اوكسجين أو نيتروجين مرتبط إلى الهيدروجين، ونظرا لصغر حجم ذرة الهيدروجين فان المزدوج الإلكتروني سوف ينجذب مع بروتون ذرة الهيدروجين الموجب مكون هذا النوع من الترابط. يرمز عادة الي الترابط الهيدروجيني بالرابطة الهيدروجينية نتيجة لقوة هذا الترابط حيث ان قوة الترابط تبلغ بين 1 إلى 40 كيلوجول / مول، حسب نوع الجزيئات المترابطة.
أنواع الروابط الهيدروجينة
[عدل]1-روابط هيدروجينية داخلية:-
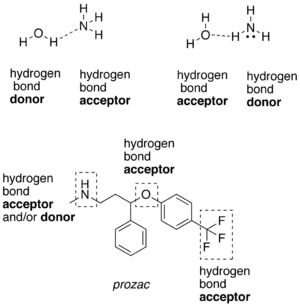
[عدل]وهي تحدث بين جزيئات لديها ذرة هيدروجين مرتبط إلى احدي الذرات التالية (N، F، O) برابطة تساهمية قطبية ومثال عليها الكحولات والامينات الأولية والثانوية والاميدات الأولية والثانوية والأحماض الكربوكسلية والماء وتسمي هذه الجزيئات عادة بمانح ومستقبل للرابطة الهيدروجينية.[1]
2-روابط هيدروجينية خارجية:-
[عدل]وهي تحدث في المركبات التي لديها ذرة (N، F، O) ولكن غير متصلة برابطة تساهمية قطبية مع الهيدروجين وبالتالي فانها تكون روابط هيدروجينة ولكن ليس مع نفسها وانما مع المذيب المستخدم إذا كان يوافق الشروط لحدوث الترابط الهيدروجيني ومثال علي هذه النوع الايثرات والامينات الثالثية والكيتونات والالدهيدات والاسترات والاميدات الثالثية.

وقد ثبت علميا ان الشكل الحقيقي للماء هو عبارة عن هرم رباعي السطوح حيث تشترك كل 3 جزيئات ماء (جزيئان مانح وجزيء مستقبل) لتكوين هذا الشكل. يعتبر الترابط الهيدروجني في حامض الهيدروفلوريك اقوي هذه الروابط والقيم التالية تمثل بعض الطاقة لهذا الترابط.
قوة الترابط الهيدروجيني
[عدل]تختلف قوة الترابط الهيدروجيني بين ترابط ضعيف (1–2 kJ mol−1) إلى ترابط قوي (161.5 kJ mol−1 في أيون الفلوريد الثنائيHF2-).[2][3]
نذكر هنا المحتوي الحراري (الإنثالبية: وهي مقياس لشدة الترابط) لجزيئات في حالة البخار:.[4]
F—H...:F (155 kJ/mol or 40 kcal/mol)
O—H...:N (29 kJ/mol or 6.9 kcal/mol)
O—H...:O (21 kJ/mol or 5.0 kcal/mol)
N—H...:N (13 kJ/mol or 3.1 kcal/mol)
N—H...:O (8 kJ/mol or 1.9 kcal/mol)
HO—H...:OH+3 (18 kJ/mol or 4.3 kcal/mol)
اقرأ أيضا
[عدل]المراجع
[عدل]- ^ Campbell، Neil A. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. مؤرشف من الأصل في 2018-11-01.
{{استشهاد بكتاب}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Larson، J. W.؛ McMahon، T. B. (1984). "Gas-phase bihalide and pseudobihalide ions. An ion cyclotron resonance determination of hydrogen bond energies in XHY- species (X, Y = F, Cl, Br, CN)". Inorganic Chemistry. ج. 23 ع. 14: 2029–2033. DOI:10.1021/ic00182a010.
- ^ Emsley, J. (1980). "Very Strong Hydrogen Bonds". Chemical Society Reviews. ج. 9 ع. 1: 91–124. DOI:10.1039/cs9800900091. مؤرشف من الأصل في 2022-03-10.
- ^ V. David, N. Grinberg, S. C. Moldoveanu in Advances in Chromatography Volume 54 (Eds.: E. Grushka, N. Grinberg), CRC Press, Boca Raton, 2018, chapter 3.
