كبريتيد البيريليوم
| كبريتيد البيريليوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
Beryllium sulfide |
|
| أسماء أخرى | |
سلفيد البيريليوم |
|
| المعرفات | |
| رقم CAS | 13598-22-6 |
| بوب كيم (PubChem) | 83605 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | BeS |
| الكتلة المولية | 41.08 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 2.36 غ/سم3 |
| نقطة الانصهار | 1800 °س يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
كبريتيد البيريليوم (أو سلفيد البيريليوم) مركب كيميائي له الصيغة BeS، ويكوون على شكل بلورات بيضاء اللون.
التحضير[عدل]
يحضّر كبريتيد البيريليوم من التفاعل المباشر لعنصري الكبريت والبيريليوم عند 1150 °س.
كما يحضر المركب بطريقة أخرى من تفاعل كلوريد البيريليوم مع كبريتيد الهيدروجين، كما في التفاعل التالي:
لكن الطريقة الأخيرة تعطي ناتجاً من كبريتيد البيريليوم يحوي آثاراً من الكلوريد.
من الطرق الأخرى لتحضير المركب اختزال كبريتات البيريليوم، أو تفاعل أكسيد البيريليوم مع ثنائي كبريتيد الكربون.[2]
الخواص[عدل]
إن كبريتيد البيريليوم عبارة عن مادة بلورية صلبة لها لون أبيض، أحياناً رمادي، لها رائحة خفيفة تشبه كبريتيد الهيدروجين. يتحلمه المركب ببطء، ويتفكك بسرعة تحت تأثير الأحماض وغاز ثنائي أكسيد الكربون.[3]
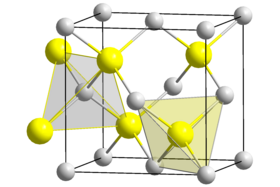
يتبلور BeS وفق النظام البلّوري المكعّب ببنية تشبه بنية السفاليريت، ويكون ثابت الشبكة البلورية مقداره 485 بيكومتر،[2] وتتبع البلورة الزمرة الفراغية من النمط [4]
لكبريتيد البيريليوم خصائص شبه موصل غير مباشرة، حيث أن فجوة النطاق المباشرة لها قيمة تبلغ 7.4 ميغا إلكترون فولت، وغير المباشرة 4.7 ميغا إلكترون فولت.[4]
احتياطات الأمان[عدل]
إن البيريليوم ومركباته الكيميائية هي مواد سامّة ومسرطنة، حيث يمكن أن تسبب مرض التسمم بالبيريليوم. لذا ينبغي أخذ الحيطة والحذر عند التعامل مع هذه المركبات.
المراجع[عدل]
- ^ https://pubchem.ncbi.nlm.nih.gov/compound/83605. اطلع عليه بتاريخ 2018-04.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة)، الوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة)، وتحقق من التاريخ في:|accessdate=(مساعدة) - ^ أ ب Brauer، Georg (1975)، Handbuch der Präparativen Anorganischen Chemie (ط. 3rd)، Stuttgart: Enke، ص. 890، ISBN:3-432-02328-6(بالألمانية)
- ^ Walsh، Kenneth (2009)، Beryllium Chemistry and Processing، ASM International، ص. 127، ISBN:0871707217
- ^ أ ب Ropp، Richard (2012)، Encyclopedia of the Alkaline Earth Compounds، Newnes، ص. 137، ISBN:0444595538