ثلاثي كلوريد النتروجين
| ثلاثي كلوريد النتروجين | |
|---|---|
 |
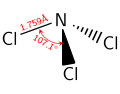 |
| أسماء أخرى | |
Trichloramine |
|
| المعرفات | |
| رقم CAS | 10025-85-1 |
| بوب كيم (PubChem) | 61437 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | NCl3 |
| الكتلة المولية | 120.36 غ/مول |
| المظهر | سائل أصفر |
| الكثافة | 1.64 غ/سم3 |
| نقطة الانصهار | −40 °س |
| نقطة الغليان | 71 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثلاثي كلوريد النتروجين (كما يعرف باسم ثلاثي كلورامين) هو مركب كيميائي من عنصري الكلور والنتروجين، له الصيغة NCl3، ويكون على شكل سائل أصفر اللون زيتي القوام، له رائحة تشبه رائحة غاز الكلور.
الوفرة والتحضير
يعد ثلاثي كلوريد النتروجين المسؤول عن الرائحة المميزة للمسابح عند تعقيمها بغاز الكلور، حيث يتشكل NCl3 كناتج ثانوي من تفاعل غاز الكلور مع اليوريا ومشتقات الأمونياك التي تطرح من الجسم أثناء السباحة نتيجة التعرق.[3]
يحضّر ثلاثي كلوريد النتروجين مخبرياً من تفاعل كلورة محلول غير مشبع من كلوريد الأمونيوم، وينتج من هذه العملية أحادي وثنائي كلورامين.
كما يمكن الحصول على المركب من تفاعل غاز الكلور مع كربونات الأمونيوم في وسط من رباعي كلوريد الكربون:[4]
الخصائص
- يتفكك ثلاثي كلوريد النتروجين تحت تأثير الأشعة فوق البنفسجية عند طول موجة 340 نانومتر، والتي تحفز التفاعل مع أيونات الهيدروكسيد:[5]
- لمركب ثلاثي كلوريد النتروجين بنية جزيئية هرمية، تكون الزاوية Cl-N-Cl فيها 107.78°، في حين أن طول الرابطة N–Cl يكون مقداره 175.3 بيكومتر.
- يتفاعل ثلاثي كلوريد النتروجين مع الماء بشكل بطيء ليشكل الأمونياك وحمض تحت الكلوروز (HClO)، إذ أن النتروجين أكثر كهرسلبية من الكلور.[6]
الاستخدامات
في السابق، كان ثلاثي كلوريد النتروجين يستخدم من أجل تبييض الطحين، ولكن هذا الاستخدام توقف منذ زمن بسبب تشكل مواد سامة مثل ميثيونين سلفوكساميد.[7]
المراجع
- ^ ا ب ج Nitrogen trichloride (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ GESTIS: Messverfahren zur Bestimmung von Trichloramin. [وصلة مكسورة] نسخة محفوظة 15 مايو 2013 على موقع واي باك مشين.
- ^ G. Brauer (Hrsg.), Handbuch der Präparativen Anorganischen Chemie 3.Auflage, 1. Band, Ferdinand Enke Verlag Stuttgart, 1975, S. 462.
- ^ Fachartikel: Energie- und Wassersparkonzepte für Schwimmbäder (PDF). نسخة محفوظة 14 نوفمبر 2008 على موقع واي باك مشين.
- ^ T. M. Klapötke, H.-J. Meyer, C. Janiak, E. Riedel: Moderne anorganische Chemie., 2003, Walter de Gruyter, ISBN 3-11017838-9, S. 75.
- ^ Patrick Otto Ludl: Die Chemie des Stickstoffs und die Rolle seiner Verbindungen für die Chemie der Atmosphäre (PDF; 1,1 MB) ARGE Chemie, Wien, 2003.





