محفز كهربائي: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
Mr.Ibrahembot (نقاش | مساهمات) ط بوت:إضافة بوابة (بوابة:الكيمياء) |
Mn-imhotep (نقاش | مساهمات) أُنشئَت بترجمة الصفحة "Electrocatalyst" |
||
| سطر 1: | سطر 1: | ||
[[ملف:Electrocatalyst_ANL.jpg|تصغير|264x264بك| يتم قياس استقرار المحفز الكهربائي للكاثود البلاتيني بواسطة الكيميائي [[Xiaoping Wang|شياو بينغ وانغ]]]] |
[[ملف:Electrocatalyst_ANL.jpg|تصغير|264x264بك| يتم قياس استقرار المحفز الكهربائي للكاثود البلاتيني بواسطة الكيميائي [[Xiaoping Wang|شياو بينغ وانغ]]]] |
||
'''المحفز الكهربائي''' هو [[تحفيز|محفز]] يشارك في التفاعلات الكهروكيميائية . المحفزات الكهربائية هي شكل محدد من المحفزات التي تعمل على أسطح [[قطب كهربائي|الأقطاب الكهربائية]] أو في أغلب الأحيان قد تكون على سطح القطب الكهربائي نفسه. يمكن أن يكون المحفز الكهربائي [[تجانس وتغاير|غير متجانس]] مثل القطب الكهربائي المصفح . <ref name="Ind">{{استشهاد بكتاب|عنوان=Handbook of Heterogeneous Catalysis|مؤلف=Kotrel|مؤلف1-الأول=Stefan|سنة=2008|isbn=978-3527312412|الفصل=Industrial Electrocatalysis|doi=10.1002/9783527610044.hetcat0103|مؤلف2=BrUninger|مؤلف2-الأول=Sigmar}}</ref> تساعد المحفزات الكهربائية المتجانسة، القابلة للذوبان، في نقل الإلكترونات بين القطب والمواد المتفاعلة، و/أو تسهيل التحول الكيميائي الوسيط المذكور بواسطة [[نصف تفاعل|نصف التفاعل]] الشامل. <ref name=":9">{{استشهاد بدورية محكمة| |
'''المحفز الكهربائي''' هو [[تحفيز|محفز]] يشارك في التفاعلات الكهروكيميائية . المحفزات الكهربائية هي شكل محدد من المحفزات التي تعمل على أسطح [[قطب كهربائي|الأقطاب الكهربائية]] أو في أغلب الأحيان قد تكون على سطح القطب الكهربائي نفسه. يمكن أن يكون المحفز الكهربائي [[تجانس وتغاير|غير متجانس]] مثل القطب الكهربائي المصفح . <ref name="Ind">{{استشهاد بكتاب|عنوان=Handbook of Heterogeneous Catalysis|مؤلف=Kotrel|مؤلف1-الأول=Stefan|سنة=2008|isbn=978-3527312412|الفصل=Industrial Electrocatalysis|doi=10.1002/9783527610044.hetcat0103|مؤلف2=BrUninger|مؤلف2-الأول=Sigmar}}</ref> تساعد المحفزات الكهربائية المتجانسة، القابلة للذوبان، في نقل الإلكترونات بين القطب والمواد المتفاعلة، و/أو تسهيل التحول الكيميائي الوسيط المذكور بواسطة [[نصف تفاعل|نصف التفاعل]] الشامل. <ref name=":9">{{استشهاد بدورية محكمة|last=Roduner|first=Emil|date=June 13, 2017|title=Selected fundamentals of catalysis and electrocatalysis in energy conversion reactions—A tutorial|url=https://linkinghub.elsevier.com/retrieve/pii/S0920586117304236|journal=Catalysis Today|language=en|volume=309|pages=263–268|DOI=10.1016/j.cattod.2017.05.091}}</ref> تركز التحديات الرئيسية في المحفزات الكهربائية على [[خلية وقود|خلايا الوقود]] . <ref>{{استشهاد بدورية محكمة|DOI=10.1038/nature11115|title=Electrocatalyst approaches and challenges for automotive fuel cells|year=2012|last=Debe|first=Mark K.|journal=Nature|volume=486|issue=7401|pages=43–51|PMID=22678278|bibcode=2012Natur.486...43D}}</ref> <ref>{{استشهاد بدورية محكمة|DOI=10.1039/C4CS00470A|title=Design of electrocatalysts for oxygen- and hydrogen-involving energy conversion reactions|year=2015|last=Jiao|first=Yan|last2=Zheng|first2=Yao|last3=Jaroniec|first3=Mietek|last4=Qiao|first4=Shi Zhang|journal=Chemical Society Reviews|volume=44|issue=8|pages=2060–2086|PMID=25672249}}</ref> |
||
== المحفزات الكهربائية العملية == |
== المحفزات الكهربائية العملية == |
||
=== عملية الكلور القلوي === |
=== عملية الكلور القلوي === |
||
تعد [[عملية الكلور القلوي]] تطبيقًا واسع النطاق يستخدم المحفزات الكهربائية. توفر هذه التقنية معظم احتياجات الكلور [[هيدروكسيد الصوديوم|وهيدروكسيد الصوديوم]] التي تحتاجها العديد من الصناعات. الكاثود عبارة عن [[قطب أكسيد معدني مختلط|أنود تيتانيوم مختلط بأكسيد المعدن]] (يُسمى أيضًا أنود مستقر الأبعاد). <ref name="Ru">{{استشهاد بدورية محكمة|DOI=10.1021/cr200247n| |
تعد [[عملية الكلور القلوي]] تطبيقًا واسع النطاق يستخدم المحفزات الكهربائية. توفر هذه التقنية معظم احتياجات الكلور [[هيدروكسيد الصوديوم|وهيدروكسيد الصوديوم]] التي تحتاجها العديد من الصناعات. الكاثود عبارة عن [[قطب أكسيد معدني مختلط|أنود تيتانيوم مختلط بأكسيد المعدن]] (يُسمى أيضًا أنود مستقر الأبعاد). <ref name="Ru">{{استشهاد بدورية محكمة|DOI=10.1021/cr200247n|title=Surface Chemistry of Ruthenium Dioxide in Heterogeneous Catalysis and Electrocatalysis: From Fundamental to Applied Research|year=2012|last=Over|first=Herbert|journal=Chemical Reviews|volume=112|issue=6|pages=3356–3426|PMID=22423981}}</ref> <ref name="Land1972">{{استشهاد بدورية محكمة|title=Anodic Chlorate Formation on Platinized Titanium|last=Landolt, D.|last2=Ibl, N.|journal=Chapman and Hall Ltd.|volume=2|issue=3|year=1972|pages=201–210|DOI=10.1007/BF02354977}}</ref> |
||
[[ملف:Chloralkali_membrane.svg|مركز|تصغير| الخلية الغشائية المستخدمة في [[تحليل كهربائي|التحليل الكهربائي]] للمحلول الملحي. عند الأنود ( '''A''' ) ، يتأكسد الكلوريد (Cl<sup>-</sup> ) إلى الكلور. يسمح الغشاء الانتقائي للأيونات ( '''B''' ) للأيون Na+ بالتدفق بحرية عبره، ولكنه يمنع الأنيونات مثل الهيدروكسيد (OH<sup>-</sup> ) والكلوريد من الانتشار عبرها. عند الكاثود ( '''C''' )، يتم اختزال الماء إلى هيدروكسيد وغاز الهيدروجين. هذه العملية هي التحليل الكهربائي لمحلول مائي من كلوريد الصوديوم إلى منتجات مفيدة صناعيا مثل هيدروكسيد الصوديوم وغاز الكلور.]] |
[[ملف:Chloralkali_membrane.svg|مركز|تصغير| الخلية الغشائية المستخدمة في [[تحليل كهربائي|التحليل الكهربائي]] للمحلول الملحي. عند الأنود ( '''A''' ) ، يتأكسد الكلوريد (Cl<sup>-</sup> ) إلى الكلور. يسمح الغشاء الانتقائي للأيونات ( '''B''' ) للأيون Na+ بالتدفق بحرية عبره، ولكنه يمنع الأنيونات مثل الهيدروكسيد (OH<sup>-</sup> ) والكلوريد من الانتشار عبرها. عند الكاثود ( '''C''' )، يتم اختزال الماء إلى هيدروكسيد وغاز الهيدروجين. هذه العملية هي التحليل الكهربائي لمحلول مائي من كلوريد الصوديوم إلى منتجات مفيدة صناعيا مثل هيدروكسيد الصوديوم وغاز الكلور.]] |
||
=== الفلورة الكهربائية === |
=== الفلورة الكهربائية === |
||
يتم إنتاج العديد من مركبات الفلور العضوية عن طريق [[فلورة كهروكيميائية|الفلورة الكهربائية]] . <ref>{{Ullmann|doi=10.1002/14356007.a11_349|last1=Siegemund|first1=Günter|last2=Schwertfeger|first2=Werner|last3=Feiring|first3=Andrew|last4=Smart|first4=Bruce|last5=Behr|first5=Fred|last6=Vogel|first6=Herward|last7=McKusick|first7=Blaine}}</ref> أحد مظاهر هذه التقنية هي [[فلورة كهروكيميائية|عملية سيمونز]] ، والتي يمكن وصفها بالمعادلة التالية: |
يتم إنتاج العديد من مركبات الفلور العضوية عن طريق [[فلورة كهروكيميائية|الفلورة الكهربائية]] . <ref>{{Ullmann|doi=10.1002/14356007.a11_349|last1=Siegemund|first1=Günter|last2=Schwertfeger|first2=Werner|last3=Feiring|first3=Andrew|last4=Smart|first4=Bruce|last5=Behr|first5=Fred|last6=Vogel|first6=Herward|last7=McKusick|first7=Blaine}}</ref> أحد مظاهر هذه التقنية هي [[فلورة كهروكيميائية|عملية سيمونز]] ، والتي يمكن وصفها بالمعادلة التالية: |
||
: R<sub>3</sub>C–H + HF → R<sub>3</sub>C–F + H<sub>2</sub> |
: R<sub>3</sub>C–H + HF → R<sub>3</sub>C–F + H<sub>2</sub> |
||
في سياق التوليف النموذجي يحدث هذا التفاعل مرة واحدة لكل رابطة C – H في المادة الأولية. يتم الحفاظ على [[جهد الخلية بالقرب من 5 – 6 [[فولت]] . ويكون [[مصعد (كيمياء)|الأنود]] - المحفز الكهربائي - مطلي [[نيكل|بالنيكل]] . |
في سياق التوليف النموذجي يحدث هذا التفاعل مرة واحدة لكل رابطة C – H في المادة الأولية. يتم الحفاظ على [[جهد الخلية بالقرب من 5 – 6 [[فولت]] . ويكون [[مصعد (كيمياء)|الأنود]] - المحفز الكهربائي - مطلي [[نيكل|بالنيكل]] . |
||
=== Hydrodimerization من الأكريلونيتريل === |
=== Hydrodimerization من الأكريلونيتريل === |
||
يتم تحويل الأكريلونيتريل إلى أديبونيتريل على نطاق صناعي عن طريق التحفيز الكهربائي. <ref name="Ind" /> |
يتم تحويل الأكريلونيتريل إلى أديبونيتريل على نطاق صناعي عن طريق التحفيز الكهربائي. <ref name="Ind">{{استشهاد بكتاب|عنوان=Handbook of Heterogeneous Catalysis|مؤلف=Kotrel|مؤلف1-الأول=Stefan|سنة=2008|isbn=978-3527312412|الفصل=Industrial Electrocatalysis|doi=10.1002/9783527610044.hetcat0103|مؤلف2=BrUninger|مؤلف2-الأول=Sigmar}}</ref> |
||
== الخلفية والنظرية == |
== الخلفية والنظرية == |
||
بشكل عام، [[تحفيز|المحفز]] هو عامل يزيد من سرعة [[تفاعل كيميائي|التفاعل الكيميائي]] دون أن يستهلكه التفاعل. من جهة الديناميكا الحرارية، يعمل المحفز على تقليل [[طاقة تنشيط|طاقة التنشيط]] اللازمة لحدوث التفاعل الكيميائي. المحفز الكهربائي هو محفز يؤثر على طاقة التنشيط للتفاعل الكهروكيميائي. <ref name=":42">{{استشهاد ويب| |
بشكل عام، [[تحفيز|المحفز]] هو عامل يزيد من سرعة [[تفاعل كيميائي|التفاعل الكيميائي]] دون أن يستهلكه التفاعل. من جهة الديناميكا الحرارية، يعمل المحفز على تقليل [[طاقة تنشيط|طاقة التنشيط]] اللازمة لحدوث التفاعل الكيميائي. المحفز الكهربائي هو محفز يؤثر على طاقة التنشيط للتفاعل الكهروكيميائي. <ref name=":42">{{استشهاد ويب|url=https://www.youtube.com/watch?v=2sbsTLvcbCg&feature=youtu.be|title=Electrocatalysis 101 {{!}} GCEP Symposium - October 11, 2012|date=September 3, 2014|website=Youtube.com|last=Jaramillo|first=Tom|url-status=live}}</ref> تظهر أدناه طاقة تنشيط التفاعلات الكيميائية من حيث صلتها بطاقة المواد المتفاعلة وطاقة المنتجات. ترتبط طاقة التنشيط في العمليات الكهروكيميائية [[جهد كهركيميائي|بالكمون]] ، أي الجهد، الذي يحدث عنده التفاعل. وبالتالي، فإن المحفزات الكهربائية كثيرًا ما تغير الكمون التي يتم عندها مشاهدة عمليات الأكسدة والاختزال. <ref>{{استشهاد بكتاب|عنوان=Electrochemical methods: fundamentals and applications|مؤلف=Bard|مؤلف1-الأول=Allen J.|طبعة=Second|isbn=0-471-04372-9|مكان=Hoboken, NJ|تاريخ=2001|oclc=43859504|مؤلف2=Larry R. Faulkner}}</ref> وبدلاً من ذلك، يمكن اعتبار المحفز الكهربي عاملًا يسهل تفاعلًا كيميائيًا محددًا على سطح القطب. <ref name=":5">{{استشهاد بدورية محكمة|last=McCreery|first=Richard L.|date=July 2008|title=Advanced Carbon Electrode Materials for Molecular Electrochemistry|journal=Chemical Reviews|language=en|volume=108|issue=7|pages=2646–2687|DOI=10.1021/cr068076m|PMID=18557655|issn=0009-2665}}</ref> وبالنظر إلى أن التفاعلات الكهروكيميائية تحدث عندما يتم تمرير الإلكترونات من نوع كيميائي إلى آخر، فإن التفاعلات الإيجابية على سطح القطب تزيد من احتمال حدوث التحولات الكهروكيميائية، وبالتالي تقليل الكمون المطلوب لتحقيق هذه التحولات. <ref name=":5" /> |
||
[[ملف:Catalyst_Energy_Diagram.png|يمين|تصغير|250x250بك| مخطط الطاقة المحتملة للتفاعل مع وبدون محفز. يعمل المحفز على زيادة معدل التفاعل عن طريق خفض طاقة التنشيط للتفاعل دون استهلاكها في التفاعل. يعمل المحفز الكهربي على خفض طاقة التنشيط للتفاعل الكهروكيميائي، وغالبًا ما يؤدي إلى خفض الكمون الكهربائي التي يحدث عندها التفاعل (أحمر).]] |
[[ملف:Catalyst_Energy_Diagram.png|يمين|تصغير|250x250بك| مخطط الطاقة المحتملة للتفاعل مع وبدون محفز. يعمل المحفز على زيادة معدل التفاعل عن طريق خفض طاقة التنشيط للتفاعل دون استهلاكها في التفاعل. يعمل المحفز الكهربي على خفض طاقة التنشيط للتفاعل الكهروكيميائي، وغالبًا ما يؤدي إلى خفض الكمون الكهربائي التي يحدث عندها التفاعل (أحمر).]] |
||
يمكن تقييم المحفزات الكهربائية وفقًا لثلاثة أرقام حسب الجدارة: النشاط، والاستقرار، والانتقائية. يمكن تقييم نشاط المحفزات الكهربائية كميًا من نعيين كثافة التيار المتولد، وبالتالي مدى سرعة حدوث التفاعل، بالنسبة لجهد تطبيقي معين. يتم وصف هذه العلاقة بمعادلة تافل . <ref name=":42" /> في تقييم استقرار المحفزات الكهربائية، تعد قدرة المحفزات على تحمل الإمكانات التي تحدث عندها التحولات أمرًا بالغ الأهمية. تشير انتقائية المحفزات الكهربائية إلى تفاعلها التفضيلي مع ركائز معينة، وتوليدها لمنتج واحد. <ref name=":42" /> يمكن تقييم الانتقائية كميًا من خلال معامل الانتقائية، الذي يقارن استجابة المادة للتحليل أو الركيزة المرغوبة مع الاستجابة للتداخلات الأخرى. <ref>{{استشهاد بدورية محكمة| |
يمكن تقييم المحفزات الكهربائية وفقًا لثلاثة أرقام حسب الجدارة: النشاط، والاستقرار، والانتقائية. يمكن تقييم نشاط المحفزات الكهربائية كميًا من نعيين كثافة التيار المتولد، وبالتالي مدى سرعة حدوث التفاعل، بالنسبة لجهد تطبيقي معين. يتم وصف هذه العلاقة بمعادلة تافل . <ref name=":42">{{استشهاد ويب|url=https://www.youtube.com/watch?v=2sbsTLvcbCg&feature=youtu.be|title=Electrocatalysis 101 {{!}} GCEP Symposium - October 11, 2012|date=September 3, 2014|website=Youtube.com|last=Jaramillo|first=Tom|url-status=live}}</ref> في تقييم استقرار المحفزات الكهربائية، تعد قدرة المحفزات على تحمل الإمكانات التي تحدث عندها التحولات أمرًا بالغ الأهمية. تشير انتقائية المحفزات الكهربائية إلى تفاعلها التفضيلي مع ركائز معينة، وتوليدها لمنتج واحد. <ref name=":42" /> يمكن تقييم الانتقائية كميًا من خلال معامل الانتقائية، الذي يقارن استجابة المادة للتحليل أو الركيزة المرغوبة مع الاستجابة للتداخلات الأخرى. <ref>{{استشهاد بدورية محكمة|last=Brown|first=Micah D.|last2=Schoenfisch|first2=Mark H.|date=2019-11-27|title=Electrochemical Nitric Oxide Sensors: Principles of Design and Characterization|journal=Chemical Reviews|language=en|volume=119|issue=22|pages=11551–11575|DOI=10.1021/acs.chemrev.8b00797|PMID=31553169|issn=0009-2665}}</ref> |
||
في العديد من الأنظمة الكهروكيميائية، بما في ذلك [[خلية غلفانية|الخلايا الجلفانية]] [[خلية وقود|وخلايا الوقود]] وأشكال مختلفة من [[خلية تحليل كهربائي|الخلايا الإلكتروليتية]] ، فإن العيب هو أنها يمكن أن تعاني من حواجز تنشيط عالية. يتم تحويل الطاقة للتغلب على حواجز التنشيط هذه إلى حرارة. في معظم تفاعلات الاحتراق الطاردة للحرارة، تقوم هذه الحرارة ببساطة بنشر التفاعل تحفيزيًا. في تفاعل الأكسدة والاختزال، تكون هذه الحرارة منتجًا ثانويًا عديم الفائدة في النظام. عادة ما يتم وصف الطاقة الإضافية المطلوبة للتغلب على الحواجز الكمونية من حيث انخفاض كفاءة الفاراديا و [[جهد زائد|الجهد الزائدة]] العالي. <ref name=":42" /> في هذه الأنظمة، سيتطلب كل من [[قطب كهربائي|القطبين]] [[نصف خلية|ونصف الخلية]] المرتبطة به محفزًا كهربائيًا مخصصًا له. <ref name=":9" /> |
في العديد من الأنظمة الكهروكيميائية، بما في ذلك [[خلية غلفانية|الخلايا الجلفانية]] [[خلية وقود|وخلايا الوقود]] وأشكال مختلفة من [[خلية تحليل كهربائي|الخلايا الإلكتروليتية]] ، فإن العيب هو أنها يمكن أن تعاني من حواجز تنشيط عالية. يتم تحويل الطاقة للتغلب على حواجز التنشيط هذه إلى حرارة. في معظم تفاعلات الاحتراق الطاردة للحرارة، تقوم هذه الحرارة ببساطة بنشر التفاعل تحفيزيًا. في تفاعل الأكسدة والاختزال، تكون هذه الحرارة منتجًا ثانويًا عديم الفائدة في النظام. عادة ما يتم وصف الطاقة الإضافية المطلوبة للتغلب على الحواجز الكمونية من حيث انخفاض كفاءة الفاراديا و [[جهد زائد|الجهد الزائدة]] العالي. <ref name=":42">{{استشهاد ويب|url=https://www.youtube.com/watch?v=2sbsTLvcbCg&feature=youtu.be|title=Electrocatalysis 101 {{!}} GCEP Symposium - October 11, 2012|date=September 3, 2014|website=Youtube.com|last=Jaramillo|first=Tom|url-status=live}}</ref> في هذه الأنظمة، سيتطلب كل من [[قطب كهربائي|القطبين]] [[نصف خلية|ونصف الخلية]] المرتبطة به محفزًا كهربائيًا مخصصًا له. <ref name=":9">{{استشهاد بدورية محكمة|last=Roduner|first=Emil|date=June 13, 2017|title=Selected fundamentals of catalysis and electrocatalysis in energy conversion reactions—A tutorial|url=https://linkinghub.elsevier.com/retrieve/pii/S0920586117304236|journal=Catalysis Today|language=en|volume=309|pages=263–268|DOI=10.1016/j.cattod.2017.05.091}}</ref> |
||
التفاعلات النصفية التي تتضمن خطوات متعددة ، وعمليات متعددة لنقل الإلكترونات ، وتطور أو استهلاك الغازات في تحولاتها الكيميائية الشاملة، غالبًا ما يكون لها حواجز كبيرة في الديناميكا الحرارية . علاوة على ذلك، غالبًا ما يكون هناك أكثر من تفاعل محتمل على سطح القطب. على سبيل المثال، أثناء [[تحليل كهربائي للماء|التحليل الكهربائي للماء]] ، يمكن للأنود أكسدة الماء من خلال "عملية ثنائية الإلكترون" إلى [[بيروكسيد الهيدروجين]] أو عملية رباعية الإلكترون للأكسجين. يمكن أن يؤدي وجود محفز كهربائي إلى تسهيل أي من مسارات التفاعل. <ref name="electromethods"> |
التفاعلات النصفية التي تتضمن خطوات متعددة ، وعمليات متعددة لنقل الإلكترونات ، وتطور أو استهلاك الغازات في تحولاتها الكيميائية الشاملة، غالبًا ما يكون لها حواجز كبيرة في الديناميكا الحرارية . علاوة على ذلك، غالبًا ما يكون هناك أكثر من تفاعل محتمل على سطح القطب. على سبيل المثال، أثناء [[تحليل كهربائي للماء|التحليل الكهربائي للماء]] ، يمكن للأنود أكسدة الماء من خلال "عملية ثنائية الإلكترون" إلى [[بيروكسيد الهيدروجين]] أو عملية رباعية الإلكترون للأكسجين. يمكن أن يؤدي وجود محفز كهربائي إلى تسهيل أي من مسارات التفاعل. <ref name="electromethods"> |
||
{{استشهاد بكتاب|عنوان=Electrochemical methods: fundamentals and applications|مؤلف=Bard|مؤلف1-الأول=Allen J.|ناشر=[[John Wiley & Sons|Wiley]]|isbn=978-0-471-04372-0|مسار= |
{{استشهاد بكتاب|عنوان=Electrochemical methods: fundamentals and applications|مؤلف=Bard|مؤلف1-الأول=Allen J.|ناشر=[[John Wiley & Sons|Wiley]]|isbn=978-0-471-04372-0|مسار=https://www.amazon.co.uk/gp/reader/0471043729/ref=sib_dp_pt#reader-link|مكان=[[New York City|New York]]|تاريخ=January 2001|مؤلف2=Faulkner|مؤلف2-الأول=Larry R.|وصلة-مؤلف1=Allen J. Bard|تاريخ وصول=27 February 2009}} |
||
</ref> |
</ref> |
||
[[ملف:Types_of_Electrocatalysts.png|يمين|تصغير|450x450بك| أنواع مواد المحفزات الكهربائية، بما في ذلك المحفزات الكهربائية المتجانسة وغير المتجانسة.]] |
[[ملف:Types_of_Electrocatalysts.png|يمين|تصغير|450x450بك| أنواع مواد المحفزات الكهربائية، بما في ذلك المحفزات الكهربائية المتجانسة وغير المتجانسة.]] |
||
== المحفزات الكهربائية المتجانسة == |
== المحفزات الكهربائية المتجانسة == |
||
المحفز الكهربائي المتجانس هو الذي يوجد في نفس الطور من المادة مثل المواد المتفاعلة، على سبيل المثال، مجمع تنسيق قابل للذوبان في الماء يحفز التحويل الكهروكيميائي في المحلول. <ref name=":12">{{استشهاد بدورية محكمة| |
المحفز الكهربائي المتجانس هو الذي يوجد في نفس الطور من المادة مثل المواد المتفاعلة، على سبيل المثال، مجمع تنسيق قابل للذوبان في الماء يحفز التحويل الكهروكيميائي في المحلول. <ref name=":12">{{استشهاد بدورية محكمة|last=Artero|first=Vincent|last2=Chavarot-Kerlidou|first2=Murielle|last3=Fontecave|first3=Marc|date=2011-08-01|title=Splitting Water with Cobalt|url=http://doi.wiley.com/10.1002/anie.201007987|journal=Angewandte Chemie International Edition|language=en|volume=50|issue=32|pages=7238–7266|DOI=10.1002/anie.201007987|PMID=21748828}}</ref> <ref name=":62">{{استشهاد بدورية محكمة|last=Kinzel|first=Niklas W.|last2=Werlé|first2=Christophe|last3=Leitner|first3=Walter|date=2021-01-19|title=Transition Metal Complexes as Catalysts for the Electroconversion of CO 2 : An Organometallic Perspective|journal=Angewandte Chemie International Edition|volume=60|issue=21|language=en|pages=11628–11686|DOI=10.1002/anie.202006988|PMID=33464678|PMCID=8248444|issn=1433-7851}}</ref> ولا تمارس هذه التكنولوجيا تجاريا، ولكنها ذات أهمية بحثية. |
||
=== معقدات التنسيق الاصطناعية === |
=== معقدات التنسيق الاصطناعية === |
||
تحفز العديد من [[معقد تناسقي|معقدات التنسيق]] التفاعلات الكهروكيميائية، <ref name=":12" /> <ref name=":62" /> ولكن المحفزات غير المتجانسة فقط هي التي لها قيمة تجارية. |
تحفز العديد من [[معقد تناسقي|معقدات التنسيق]] التفاعلات الكهروكيميائية، <ref name=":12">{{استشهاد بدورية محكمة|last=Artero|first=Vincent|last2=Chavarot-Kerlidou|first2=Murielle|last3=Fontecave|first3=Marc|date=2011-08-01|title=Splitting Water with Cobalt|url=http://doi.wiley.com/10.1002/anie.201007987|journal=Angewandte Chemie International Edition|language=en|volume=50|issue=32|pages=7238–7266|DOI=10.1002/anie.201007987|PMID=21748828}}</ref> <ref name=":62">{{استشهاد بدورية محكمة|last=Kinzel|first=Niklas W.|last2=Werlé|first2=Christophe|last3=Leitner|first3=Walter|date=2021-01-19|title=Transition Metal Complexes as Catalysts for the Electroconversion of CO 2 : An Organometallic Perspective|journal=Angewandte Chemie International Edition|volume=60|issue=21|language=en|pages=11628–11686|DOI=10.1002/anie.202006988|PMID=33464678|PMCID=8248444|issn=1433-7851}}</ref> ولكن المحفزات غير المتجانسة فقط هي التي لها قيمة تجارية. |
||
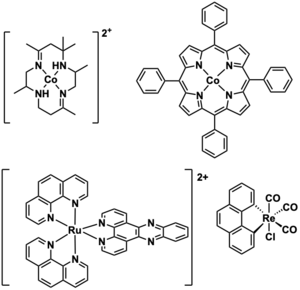
[[ملف:Transition_Metal_Complex_Electrocatalysts.png|يمين|تصغير|300x300بك| أمثلة على معقدات المعادن الانتقالية التي تعمل كمحفزات كهربائية متجانسة. <ref name=":12" /> . <ref name=":62" />]] |
[[ملف:Transition_Metal_Complex_Electrocatalysts.png|يمين|تصغير|300x300بك| أمثلة على معقدات المعادن الانتقالية التي تعمل كمحفزات كهربائية متجانسة. <ref name=":12">{{استشهاد بدورية محكمة|last=Artero|first=Vincent|last2=Chavarot-Kerlidou|first2=Murielle|last3=Fontecave|first3=Marc|date=2011-08-01|title=Splitting Water with Cobalt|url=http://doi.wiley.com/10.1002/anie.201007987|journal=Angewandte Chemie International Edition|language=en|volume=50|issue=32|pages=7238–7266|DOI=10.1002/anie.201007987|PMID=21748828}}</ref> . <ref name=":62">{{استشهاد بدورية محكمة|last=Kinzel|first=Niklas W.|last2=Werlé|first2=Christophe|last3=Leitner|first3=Walter|date=2021-01-19|title=Transition Metal Complexes as Catalysts for the Electroconversion of CO 2 : An Organometallic Perspective|journal=Angewandte Chemie International Edition|volume=60|issue=21|language=en|pages=11628–11686|DOI=10.1002/anie.202006988|PMID=33464678|PMCID=8248444|issn=1433-7851}}</ref>]] |
||
=== الانزيمات === |
=== الانزيمات === |
||
يمكن لبعض [[إنزيم|الإنزيمات]] أن تعمل كمحفزات كهربائية. <ref name=":3">{{استشهاد بدورية محكمة| |
يمكن لبعض [[إنزيم|الإنزيمات]] أن تعمل كمحفزات كهربائية. <ref name=":3">{{استشهاد بدورية محكمة|last=Chen|first=Hui|last2=Simoska|first2=Olja|last3=Lim|first3=Koun|last4=Grattieri|first4=Matteo|last5=Yuan|first5=Mengwei|last6=Dong|first6=Fangyuan|last7=Lee|first7=Yoo Seok|last8=Beaver|first8=Kevin|last9=Weliwatte|first9=Samali|date=2020-12-09|title=Fundamentals, Applications, and Future Directions of Bioelectrocatalysis|journal=Chemical Reviews|language=en|volume=120|issue=23|pages=12903–12993|DOI=10.1021/acs.chemrev.0c00472|PMID=33050699|issn=0009-2665}}</ref> يمكن الاستفادة [[نيتروجيناز|من إنزيم النيتروجين]] ،(انزيم نيتروجيناز ) ، وهو إنزيم يحتوي على عنقود MoFe، [[تثبيت النيتروجين|لتثبيت النيتروجين الجوي]] ، أي تحويل غاز النيتروجين إلى جزيئات مثل الأمونيا. يؤدي تثبيت البروتين على سطح القطب واستخدام وسيط إلكتروني إلى تحسين كفاءة هذه العملية بشكل كبير. <ref name=":2">{{استشهاد بدورية محكمة|last=Milton|first=Ross D.|last2=Minteer|first2=Shelley D.|date=2019-12-17|title=Nitrogenase Bioelectrochemistry for Synthesis Applications|url=https://pubs.acs.org/doi/abs/10.1021/acs.accounts.9b00494|journal=Accounts of Chemical Research|language=en|volume=52|issue=12|pages=3351–3360|DOI=10.1021/acs.accounts.9b00494|PMID=31800207|issn=0001-4842}}</ref> تعتمد فعالية المحفزات الكهربائية الحيوية عمومًا على سهولة نقل الإلكترون بين الموقع النشط للإنزيم وسطح القطب. <ref name=":3" /> توفر الإنزيمات الأخرى نظرة ثاقبة لتطوير المحفزات الاصطناعية. على سبيل المثال ألهمت نازعة هيدروجين الفورمات ، وهو إنزيم يحتوي على النيكل، تطوير معقدات اصطناعية ذات هياكل جزيئية مماثلة لاستخدامها في تقليل ثاني أكسيد الكربون. <ref name=":72">{{استشهاد بدورية محكمة|last=Yang|first=Jenny Y.|last2=Kerr|first2=Tyler A.|last3=Wang|first3=Xinran S.|last4=Barlow|first4=Jeffrey M.|date=2020-11-18|title=Reducing CO 2 to HCO 2 – at Mild Potentials: Lessons from Formate Dehydrogenase|url=https://pubs.acs.org/doi/10.1021/jacs.0c07965|journal=Journal of the American Chemical Society|language=en|volume=142|issue=46|pages=19438–19445|DOI=10.1021/jacs.0c07965|PMID=33141560|issn=0002-7863}}</ref> تعد خلايا الوقود الميكروبية طريقة أخرى يمكن من خلالها الاستفادة من الأنظمة البيولوجية في تطبيقات التحفيز الكهربائي. <ref name=":3" /> <ref name=":8">{{استشهاد بدورية محكمة|last=Qiao|first=Yan|last2=Bao|first2=Shu-Juan|last3=Li|first3=Chang Ming|date=2010|title=Electrocatalysis in microbial fuel cells—from electrode material to direct electrochemistry|url=http://xlink.rsc.org/?DOI=b923503e|journal=Energy & Environmental Science|language=en|volume=3|issue=5|pages=544|DOI=10.1039/b923503e|issn=1754-5692}}</ref> كما تعمل الأنظمة القائمة على الميكروبات على الاستفادة من المسارات الأيضية للكائن الحي بأكمله، بدلاً من نشاط إنزيم معين، مما يعني أنها قادرة على تحفيز نطاق واسع من التفاعلات الكيميائية. <ref name=":3" /> يمكن لخلايا الوقود الميكروبية أن تستمد التيار الكهربي من أكسدة الركائز مثل الجلوكوز، <ref name=":8" /> ويمكن الاستفادة منها في عمليات مثل خفض كميات ثاني أكسيد الكربون. <ref name=":3" /> |
||
== المحفزات الكهربائية غير المتجانسة == |
== المحفزات الكهربائية غير المتجانسة == |
||
المحفز الكهربائي غير المتجانس هو محفز يكون في طور من المادة مختلف عن المواد المتفاعلة، على سبيل المثال، سطح صلب يحفز التفاعل في المحلول. تظهر أعلاه باللون الأخضر أنواع مختلفة من مواد المحفز الكهربائي غير المتجانسة. نظرًا لأن تفاعلات التحفيز الكهربي غير المتجانسة تحتاج إلى نقل إلكترونات بين المحفز الصلب (عادةً فلز) والكهارل، والذي يمكن أن يكون محلولًا سائلًا - ولكن أيضًا بوليمر أو سيراميك قادر على التوصيل الأيوني - فإن ديناميكية التفاعل تعتمد على كل من المحفز والكهارل وكذلك على [[سطح بيني|السطح البيني]] بينهما. <ref name=" |
المحفز الكهربائي غير المتجانس هو محفز يكون في طور من المادة مختلف عن المواد المتفاعلة، على سبيل المثال، سطح صلب يحفز التفاعل في المحلول. تظهر أعلاه باللون الأخضر أنواع مختلفة من مواد المحفز الكهربائي غير المتجانسة. نظرًا لأن تفاعلات التحفيز الكهربي غير المتجانسة تحتاج إلى نقل إلكترونات بين المحفز الصلب (عادةً فلز) والكهارل، والذي يمكن أن يكون محلولًا سائلًا - ولكن أيضًا بوليمر أو سيراميك قادر على التوصيل الأيوني - فإن ديناميكية التفاعل تعتمد على كل من المحفز والكهارل وكذلك على [[سطح بيني|السطح البيني]] بينهما. <ref name=":5">{{استشهاد بدورية محكمة|last=McCreery|first=Richard L.|date=July 2008|title=Advanced Carbon Electrode Materials for Molecular Electrochemistry|journal=Chemical Reviews|language=en|volume=108|issue=7|pages=2646–2687|DOI=10.1021/cr068076m|PMID=18557655|issn=0009-2665}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMcCreery2008">McCreery, Richard L. (July 2008). "Advanced Carbon Electrode Materials for Molecular Electrochemistry". ''Chemical Reviews''. '''108''' (7): 2646–2687. [[معرف الغرض الرقمي|doi]]:[[doi:10.1021/cr068076m|10.1021/cr068076m]]. [[الرقم التسلسلي القياسي الدولي|ISSN]] [[issn:0009-2665|0009-2665]]. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/18557655 18557655].</cite></ref> تحدد طبيعة سطح المحفز الكهربائي بعض خصائص التفاعل بما في ذلك معدل التفاعل والانتقائية. <ref name=":5" /> |
||
=== المواد الكتلية === |
=== المواد الكتلية === |
||
يمكن أن يحدث التحفيز الكهربائي على سطح بعض المواد الكتلية، مثل معدن البلاتين. تم استخدام الأسطح المعدنية الكتلية من الذهب لتحلل الميثانول لإنتاج الهيدروجين. <ref name=" |
يمكن أن يحدث التحفيز الكهربائي على سطح بعض المواد الكتلية، مثل معدن البلاتين. تم استخدام الأسطح المعدنية الكتلية من الذهب لتحلل الميثانول لإنتاج الهيدروجين. <ref name=":9">{{استشهاد بدورية محكمة|last=Roduner|first=Emil|date=June 13, 2017|title=Selected fundamentals of catalysis and electrocatalysis in energy conversion reactions—A tutorial|url=https://linkinghub.elsevier.com/retrieve/pii/S0920586117304236|journal=Catalysis Today|language=en|volume=309|pages=263–268|DOI=10.1016/j.cattod.2017.05.091}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFRoduner2017">Roduner, Emil (June 13, 2017). [https://linkinghub.elsevier.com/retrieve/pii/S0920586117304236 "Selected fundamentals of catalysis and electrocatalysis in energy conversion reactions—A tutorial"]. ''Catalysis Today''. '''309''': 263–268. [[معرف الغرض الرقمي|doi]]:[[doi:10.1016/j.cattod.2017.05.091|10.1016/j.cattod.2017.05.091]]. [[سيمانتك سكولر|S2CID]] [https://api.semanticscholar.org/CorpusID:103395714 103395714].</cite></ref> يتم إجراء التحليل الكهربائي للماء بشكل تقليدي في أقطاب معدنية خاملة مثل البلاتين أو الإيريديوم. <ref name=":10">{{استشهاد بدورية محكمة|last=Carmo|first=Marcelo|last2=Fritz|first2=David L.|last3=Mergel|first3=Jürgen|last4=Stolten|first4=Detlef|date=March 14, 2013|title=A comprehensive review on PEM water electrolysis|url=https://linkinghub.elsevier.com/retrieve/pii/S0360319913002607|journal=International Journal of Hydrogen Energy|language=en|volume=38|issue=12|pages=4901–4934|DOI=10.1016/j.ijhydene.2013.01.151}}</ref> يمكن ضبط نشاط المحفز الكهربي عن طريق تعديل كيميائي، مثل خلط معدنين أو أكثر في سبيكة. ويرجع ذلك إلى التغير في البنية الإلكترونية للسبيكة ، وخاصة في النطاق الإلكتروني d الذي يعتبر المسؤول عن الخواص التحفيزية للمعادن النبيلة. <ref name="Mistry-2016">{{استشهاد بدورية محكمة|title=Nanostructured electrocatalysts with tunable activity and selectivity|journal=Nature Reviews Materials|last=Mistry|first=H.|volume=1|issue=4|pages=1–14|last2=Varela|first2=A.S.|DOI=10.1038/natrevmats.2016.9|last3=Strasser|first3=P.|author3-link=Peter Strasser (chemist)|last4=Cuenya|first4=B.R.|year=2016|bibcode=2016NatRM...116009M}}</ref> |
||
=== المواد النانوية === |
=== المواد النانوية === |
||
==== الجسيمات النانوية ==== |
==== الجسيمات النانوية ==== |
||
لقد ثبت أن مجموعة متنوعة من مواد [[جسيم نانوي|الجسيمات النانوية]] تعزز التفاعلات الكهروكيميائية المختلفة، <ref name=":0">{{استشهاد بدورية محكمة| |
لقد ثبت أن مجموعة متنوعة من مواد [[جسيم نانوي|الجسيمات النانوية]] تعزز التفاعلات الكهروكيميائية المختلفة، <ref name=":0">{{استشهاد بدورية محكمة|last=Kleijn|first=Steven E. F.|last2=Lai|first2=Stanley C. S.|last3=Koper|first3=Marc T. M.|last4=Unwin|first4=Patrick R.|date=2014-04-01|title=Electrochemistry of Nanoparticles|url=http://doi.wiley.com/10.1002/anie.201306828|journal=Angewandte Chemie International Edition|language=en|volume=53|issue=14|pages=3558–3586|DOI=10.1002/anie.201306828|PMID=24574053}}</ref> على الرغم من أنه لم يتم تسويق أي منها. يمكن ضبط هذه المحفزات يبعا لحجمها وشكلها، بالإضافة إلى ضغطها السطحي. <ref>{{استشهاد بدورية محكمة|last=Luo|first=Mingchuan|last2=Guo|first2=Shaojun|date=September 26, 2017|title=Strain-controlled electrocatalysis on multimetallic nanomaterials|url=http://www.nature.com/articles/natrevmats201759|journal=Nature Reviews Materials|language=en|volume=2|issue=11|pages=17059|DOI=10.1038/natrevmats.2017.59|issn=2058-8437}}</ref> |
||
[[ملف:Electronic_density_difference_Cl_Cu111.png|بديل=Electronic density difference of a Cl atom adsorbed on a Cu(111) surface obtained with a density functional theory simulation. Red regions represent the abundance of electrons, whereas blue regions represent deficit of electrons.|تصغير|220x220بك| فرق الكثافة الإلكترونية لذرة الكلور Cl الممتزة على سطح Cu(111) الذي تم الحصول عليه حسابيا من خلال محاكاة [[نظرية الكثافة الوظيفية|DFT]] .]] |
[[ملف:Electronic_density_difference_Cl_Cu111.png|بديل=Electronic density difference of a Cl atom adsorbed on a Cu(111) surface obtained with a density functional theory simulation. Red regions represent the abundance of electrons, whereas blue regions represent deficit of electrons.|تصغير|220x220بك| فرق الكثافة الإلكترونية لذرة الكلور Cl الممتزة على سطح Cu(111) الذي تم الحصول عليه حسابيا من خلال محاكاة [[نظرية الكثافة الوظيفية|DFT]] .]] |
||
يمكن أيضا تحقيق معدلات تفاعل أعلى من خلال التحكم الدقيق في ترتيب الذرات السطحية: في الواقع، في الأنظمة النانوية، يكون عدد مواقع التفاعل المتاحة أكثر من مساحة السطح المكشوفة في تقدير نشاط التحفيز الكهربائي. المواقع هي المواضع التي يمكن أن يحدث فيها التفاعل؛ يعتمد حدوث تفاعل في موقع معين على التركيب الإلكتروني للمحفز، والذي يحدد طاقة [[امتزاز|الامتزاز]] للمواد المتفاعلة بالإضافة إلى العديد من المتغيرات الأخرى التي لم يتم توضيحها بالكامل حتى الآن. <ref name="10.1039/c0nr00857e">{{استشهاد بدورية محكمة| |
يمكن أيضا تحقيق معدلات تفاعل أعلى من خلال التحكم الدقيق في ترتيب الذرات السطحية: في الواقع، في الأنظمة النانوية، يكون عدد مواقع التفاعل المتاحة أكثر من مساحة السطح المكشوفة في تقدير نشاط التحفيز الكهربائي. المواقع هي المواضع التي يمكن أن يحدث فيها التفاعل؛ يعتمد حدوث تفاعل في موقع معين على التركيب الإلكتروني للمحفز، والذي يحدد طاقة [[امتزاز|الامتزاز]] للمواد المتفاعلة بالإضافة إلى العديد من المتغيرات الأخرى التي لم يتم توضيحها بالكامل حتى الآن. <ref name="10.1039/c0nr00857e">{{استشهاد بدورية محكمة|title=Structure sensitivity and nanoscale effects in electrocatalysis|journal=The Royal Society of Chemistry|volume=3|issue=5|pages=2054–2073|last=Koper|first=M.T.M.|DOI=10.1039/c0nr00857e|PMID=21399781|year=2011|bibcode=2011Nanos...3.2054K}}</ref> |
||
وفقًا لنموذج TSK ، يمكن تصنيف ذرات سطح المحفز إلى ذرات مدرجة أو سلمية أو ملتوية وفقًا لموقعها، وتتميز كل منها [[عدد تناسقي|برقم تنسيق]] مختلف. من حيث المبدأ، تميل الذرات ذات رقم التنسيق الأقل (وجود اختلالات في البنية والعيوب) إلى أن تكون أكثر تفاعلية، وبالتالي تمتز المواد المتفاعلة بسهولة أكبر: قد يؤدي هذا إلى تعزيز الحركية ولكن قد يؤدي أيضًا إلى خفضها إذا لم تكن الأنواع الممتزة هي المادة المتفاعلة، وبالتالي تعمل على تعطيل المحفز. إن التقدم في تكنولوجيا النانو يجعل من الممكن إجراء هندسة سطحية للمحفز بحيث تتعرض بعض المستويات البلورية المرغوبة فقط للمواد المتفاعلة، مما يزيد من عدد مواقع التفاعل الفعالة للتفاعل المطلوب. <ref name=" |
وفقًا لنموذج TSK ، يمكن تصنيف ذرات سطح المحفز إلى ذرات مدرجة أو سلمية أو ملتوية وفقًا لموقعها، وتتميز كل منها [[عدد تناسقي|برقم تنسيق]] مختلف. من حيث المبدأ، تميل الذرات ذات رقم التنسيق الأقل (وجود اختلالات في البنية والعيوب) إلى أن تكون أكثر تفاعلية، وبالتالي تمتز المواد المتفاعلة بسهولة أكبر: قد يؤدي هذا إلى تعزيز الحركية ولكن قد يؤدي أيضًا إلى خفضها إذا لم تكن الأنواع الممتزة هي المادة المتفاعلة، وبالتالي تعمل على تعطيل المحفز. إن التقدم في تكنولوجيا النانو يجعل من الممكن إجراء هندسة سطحية للمحفز بحيث تتعرض بعض المستويات البلورية المرغوبة فقط للمواد المتفاعلة، مما يزيد من عدد مواقع التفاعل الفعالة للتفاعل المطلوب. <ref name=":0">{{استشهاد بدورية محكمة|last=Kleijn|first=Steven E. F.|last2=Lai|first2=Stanley C. S.|last3=Koper|first3=Marc T. M.|last4=Unwin|first4=Patrick R.|date=2014-04-01|title=Electrochemistry of Nanoparticles|url=http://doi.wiley.com/10.1002/anie.201306828|journal=Angewandte Chemie International Edition|language=en|volume=53|issue=14|pages=3558–3586|DOI=10.1002/anie.201306828|PMID=24574053}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKleijnLaiKoperUnwin2014">Kleijn, Steven E. F.; Lai, Stanley C. S.; Koper, Marc T. M.; Unwin, Patrick R. (2014-04-01). [http://doi.wiley.com/10.1002/anie.201306828 "Electrochemistry of Nanoparticles"]. ''Angewandte Chemie International Edition''. '''53''' (14): 3558–3586. [[معرف الغرض الرقمي|doi]]:[[doi:10.1002/anie.201306828|10.1002/anie.201306828]]. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/24574053 24574053].</cite></ref> |
||
حتى الآن، لا يمكن صياغة آلية الاعتماد على سطح المحفز بشكل عام نظرًا لأن كل تأثير سطحي يكون بشدة محددًا بخاصية التفاعل. تم اقتراح بعض تصنيفات التفاعلات بناءً على اعتمادها السطحي <ref name="10.1039/c0nr00857e">{{استشهاد بدورية محكمة| |
حتى الآن، لا يمكن صياغة آلية الاعتماد على سطح المحفز بشكل عام نظرًا لأن كل تأثير سطحي يكون بشدة محددًا بخاصية التفاعل. تم اقتراح بعض تصنيفات التفاعلات بناءً على اعتمادها السطحي <ref name="10.1039/c0nr00857e">{{استشهاد بدورية محكمة|title=Structure sensitivity and nanoscale effects in electrocatalysis|journal=The Royal Society of Chemistry|volume=3|issue=5|pages=2054–2073|last=Koper|first=M.T.M.|DOI=10.1039/c0nr00857e|PMID=21399781|year=2011|bibcode=2011Nanos...3.2054K}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKoper2011">Koper, M.T.M. (2011). "Structure sensitivity and nanoscale effects in electrocatalysis". ''Nanoscale''. The Royal Society of Chemistry. '''3''' (5): 2054–2073. [[بيب كود|Bibcode]]:[https://ui.adsabs.harvard.edu/abs/2011Nanos...3.2054K 2011Nanos...3.2054K]. [[معرف الغرض الرقمي|doi]]:[[doi:10.1039/c0nr00857e|10.1039/c0nr00857e]]. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/21399781 21399781].</cite></ref> ولكن لا يزال هناك العديد من الاستثناءات التي لا تدخل في هذه التصنيفات. |
||
===== تأثير حجم الجسيمات ===== |
===== تأثير حجم الجسيمات ===== |
||
[[ملف:Platinum_nanoparticles_1_38_79_116_201.jpg|بديل=|يمين|تصغير|400x400بك| مثال على تأثير حجم الجسيم: يعتمد عدد مواقع التفاعل بأنواعها المختلفة على حجم الجسيم. في نموذج الجسيمات النانوية الأربعة FCC هذا، يكون موقع العقد بين المسنويين البلوريين (111) و(100) مستوى (رقم التنسيق 6، ممثلًا بكرات ذهبية اللون) هو 24 لجميع الجسيمات النانوية الأربعة المختلفة، بينما يختلف عدد المواقع السطحية الأخرى.]] |
[[ملف:Platinum_nanoparticles_1_38_79_116_201.jpg|بديل=|يمين|تصغير|400x400بك| مثال على تأثير حجم الجسيم: يعتمد عدد مواقع التفاعل بأنواعها المختلفة على حجم الجسيم. في نموذج الجسيمات النانوية الأربعة FCC هذا، يكون موقع العقد بين المسنويين البلوريين (111) و(100) مستوى (رقم التنسيق 6، ممثلًا بكرات ذهبية اللون) هو 24 لجميع الجسيمات النانوية الأربعة المختلفة، بينما يختلف عدد المواقع السطحية الأخرى.]] |
||
أدى الاهتمام بتخفيض تكاليف المحفز للعمليات الكهروكيميائية قدر الإمكان إلى استخدام مساحيق المحفز الدقيقة حيث أن [[مساحة السطح النوعية|مساحة السطح المحددة]] تزداد مع تصغير حجم الجسيمات. على سبيل المثال، يعتمد تصميم [[خلية وقود غشاء تبادل البروتون|خلايا الوقود]] والمحللات الكهربائية الأكثر شيوعًا على غشاء بوليمري مشحون في جسيمات البلاتين النانوية كمحفز كهربائي (فيما يسمى بالبلاتين الأسود ). <ref name="Carmo-2013">{{استشهاد بدورية محكمة| |
أدى الاهتمام بتخفيض تكاليف المحفز للعمليات الكهروكيميائية قدر الإمكان إلى استخدام مساحيق المحفز الدقيقة حيث أن [[مساحة السطح النوعية|مساحة السطح المحددة]] تزداد مع تصغير حجم الجسيمات. على سبيل المثال، يعتمد تصميم [[خلية وقود غشاء تبادل البروتون|خلايا الوقود]] والمحللات الكهربائية الأكثر شيوعًا على غشاء بوليمري مشحون في جسيمات البلاتين النانوية كمحفز كهربائي (فيما يسمى بالبلاتين الأسود ). <ref name="Carmo-2013">{{استشهاد بدورية محكمة|title=A comprehensive review on PEM water electrolysis|journal=International Journal of Hydrogen Energy|last=Carmo|first=M.|volume=38|pages=4901–4934|last2=Fritz|first2=D.L.|issue=12|DOI=10.1016/j.ijhydene.2013.01.151|year=2013|last3=Mergel|first3=J.|last4=Stolten|first4=D.}}</ref> |
||
على الرغم من أن نسبة مساحة السطح إلى حجم الجسيمات تعتبر بشكل شائع هي المعلمة الرئيسية التي تربط حجم المحفز الكهربائي بنشاطه، إلا أنه لفهم تأثير حجم الجسيمات، يجب أخذ العديد من الظواهر الأخرى في الاعتبار: <ref name="10.1039/c0nr00857e">{{استشهاد بدورية محكمة| |
على الرغم من أن نسبة مساحة السطح إلى حجم الجسيمات تعتبر بشكل شائع هي المعلمة الرئيسية التي تربط حجم المحفز الكهربائي بنشاطه، إلا أنه لفهم تأثير حجم الجسيمات، يجب أخذ العديد من الظواهر الأخرى في الاعتبار: <ref name="10.1039/c0nr00857e">{{استشهاد بدورية محكمة|title=Structure sensitivity and nanoscale effects in electrocatalysis|journal=The Royal Society of Chemistry|volume=3|issue=5|pages=2054–2073|last=Koper|first=M.T.M.|DOI=10.1039/c0nr00857e|PMID=21399781|year=2011|bibcode=2011Nanos...3.2054K}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKoper2011">Koper, M.T.M. (2011). "Structure sensitivity and nanoscale effects in electrocatalysis". ''Nanoscale''. The Royal Society of Chemistry. '''3''' (5): 2054–2073. [[بيب كود|Bibcode]]:[https://ui.adsabs.harvard.edu/abs/2011Nanos...3.2054K 2011Nanos...3.2054K]. [[معرف الغرض الرقمي|doi]]:[[doi:10.1039/c0nr00857e|10.1039/c0nr00857e]]. [[ببمد|PMID]] [https://pubmed.ncbi.nlm.nih.gov/21399781 21399781].</cite></ref> |
||
* ''شكل التوازن'' : لأي حجم معين من الجسيمات النانوية، هناك شكل توازن معين يحدد بالضبط مستوياتها البلورية |
* ''شكل التوازن'' : لأي حجم معين من الجسيمات النانوية، هناك شكل توازن معين يحدد بالضبط مستوياتها البلورية |
||
* ''العدد النسبي لمواقع التفاعل'' : يتوافق حجم الجسيمات النانوية مع عدد معين من الذرات السطحية وبعضها فقط يستضيف موقع التفاعل |
* ''العدد النسبي لمواقع التفاعل'' : يتوافق حجم الجسيمات النانوية مع عدد معين من الذرات السطحية وبعضها فقط يستضيف موقع التفاعل |
||
* ''البنية الإلكترونية'' : تحت حجم معين تتغير [[دالة شغل|وظيفة عمل]] الجسيمات النانوية وتتلاشى بنية نطاقها النشط |
* ''البنية الإلكترونية'' : تحت حجم معين تتغير [[دالة شغل|وظيفة عمل]] الجسيمات النانوية وتتلاشى بنية نطاقها النشط |
||
* ''[[عيب بلوري|العيوب]]'' : الشبكة البلورية للجسيمات النانوية الصغيرة تكون مثالية؛ وبالتالي، فإن التفاعلات المعززة بالعيوب حيث تتباطأ مواقع التفاعل مع انخفاض حجم الجسيمات |
* ''[[عيب بلوري|العيوب]]'' : الشبكة البلورية للجسيمات النانوية الصغيرة تكون مثالية؛ وبالتالي، فإن التفاعلات المعززة بالعيوب حيث تتباطأ مواقع التفاعل مع انخفاض حجم الجسيمات |
||
| سطر 72: | سطر 73: | ||
==== المواد المعتمدة على الكربون ==== |
==== المواد المعتمدة على الكربون ==== |
||
يمكن استخدام [[أنابيب نانوية كربونية|أنابيب الكربون النانوية]] والمواد المعتمدة على [[غرافين|الجرافين]] كمحفزات كهربائية. <ref name="CNT">{{استشهاد ويب| |
يمكن استخدام [[أنابيب نانوية كربونية|أنابيب الكربون النانوية]] والمواد المعتمدة على [[غرافين|الجرافين]] كمحفزات كهربائية. <ref name="CNT">{{استشهاد ويب|url=http://nanotechweb.org/cws/article/tech/37366|title=CNTs tuned to provide electrocatalyst support|date=19 January 2008|publisher=Nanotechweb.org|archiveurl=https://web.archive.org/web/20090122040434/http://nanotechweb.org/cws/article/tech/37366|archivedate=22 January 2009|accessdate=27 February 2009|last=Wang|first=Xin|url-status=dead}}</ref> إن الأسطح الكربونية للجرافين وأنابيب الكربون النانوية مناسبة تمامًا لامتصاص العديد من الأنواع الكيميائية، والتي يمكن أن تعزز تفاعلات تحفيزية كهربائية معينة. <ref name=":52">{{استشهاد بدورية محكمة|last=McCreery|first=Richard L.|date=June 17, 2008|title=Advanced Carbon Electrode Materials for Molecular Electrochemistry|url=https://pubs.acs.org/doi/10.1021/cr068076m|journal=Chemical Reviews|language=en|volume=108|issue=7|pages=2646–2687|DOI=10.1021/cr068076m|PMID=18557655|issn=0009-2665}}</ref> بالإضافة إلى ذلك، فإن موصليتها تعني أنها مواد إلكترودات (أقطاب كهربية) جيدة. <ref name=":52" /> تتمتع الأنابيب النانوية الكربونية بمساحة سطحية عالية جدًا، مما يزيد من المواقع السطحية التي يمكن أن تحدث فيها التحولات الكهروكيميائية. <ref>{{استشهاد بدورية محكمة|last=Wildgoose|first=Gregory G.|last2=Banks|first2=Craig E.|last3=Leventis|first3=Henry C.|last4=Compton|first4=Richard G.|date=November 30, 2005|title=Chemically Modified Carbon Nanotubes for Use in Electroanalysis|url=http://link.springer.com/10.1007/s00604-005-0449-x|journal=Microchimica Acta|language=en|volume=152|issue=3–4|pages=187–214|DOI=10.1007/s00604-005-0449-x|issn=0026-3672}}</ref> يمكن أن يعمل الجرافين أيضًا كمنصة لبناء المركبات باستخدام أنواع أخرى من المواد النانوية مثل المحفزات ذات الذرة الواحدة. <ref>{{استشهاد بدورية محكمة|last=Zhang|first=Qin|last2=Zhang|first2=Xiaoxiang|last3=Wang|first3=Junzhong|last4=Wang|first4=Congwei|date=2021-01-15|title=Graphene-supported single-atom catalysts and applications in electrocatalysis|url=https://iopscience.iop.org/article/10.1088/1361-6528/abbd70|journal=Nanotechnology|volume=32|issue=3|pages=032001|DOI=10.1088/1361-6528/abbd70|PMID=33002887|issn=0957-4484}}</ref> بسبب موصليتها، يمكن للمواد المعتمدة على الكربون أن تحل محل الأقطاب الكهربائية المعدنية لإجراء التحفيز الكهربائي الخالي من المعادن. <ref>{{استشهاد بدورية محكمة|last=Dai|first=Liming|date=June 13, 2017|title=Carbon-based catalysts for metal-free electrocatalysis|url=https://linkinghub.elsevier.com/retrieve/pii/S2451910317300182|journal=Current Opinion in Electrochemistry|language=en|volume=4|issue=1|pages=18–25|DOI=10.1016/j.coelec.2017.06.004}}</ref> |
||
==== مواد الإطار ==== |
|||
يمكن استخدام [[هيكل فلزي عضوي|الأطر المعدنية العضوية (MOFs)]] ، وخاصة الأطر الموصلة، كمحفزات كهربائية لعمليات مثل تقليل <sub>ثاني</sub> أكسيد الكربون وانشطار [[تفكيك الماء|الماء]] . توفر الأطر العضوية المعدنية مواقع نشطة محتملة في كل من المراكز المعدنية ومواقع الروابط العضوية. <ref name=":11">{{استشهاد بدورية محكمة|last=Jiao|first=Long|last2=Wang|first2=Yang|last3=Jiang|first3=Hai-Long|last4=Xu|first4=Qiang|date=November 27, 2017|title=Metal-Organic Frameworks as Platforms for Catalytic Applications|url=http://doi.wiley.com/10.1002/adma.201703663|journal=Advanced Materials|language=en|volume=30|issue=37|pages=1703663|DOI=10.1002/adma.201703663|PMID=29178384}}</ref> ويمكن أيضًا تشغيلها أو تغليف بمواد أخرى مثل الجسيمات النانوية. <ref name=":11" /> ويمكن أيضًا دمج الأطر العضوية المعدنية مع مواد قائمة على الكربون لتكوين محفزات كهربائية. <ref>{{استشهاد بدورية محكمة|last=Singh|first=Chanderpratap|last2=Mukhopadhyay|first2=Subhabrata|last3=Hod|first3=Idan|date=January 5, 2021|title=Metal–organic framework derived nanomaterials for electrocatalysis: recent developments for CO2 and N2 reduction|journal=Nano Convergence|language=en|volume=8|issue=1|pages=1|DOI=10.1186/s40580-020-00251-6|issn=2196-5404|PMCID=7785767|PMID=33403521}}</ref> يمكن أيضًا استخدام الأطر العضوية التساهمية (COFs) ، خاصة تلك التي تحتوي على معادن، كمحفزات كهربائية. أظهرت COFs المبنية من بورفيرينات الكوبالت القدرة على تقليل ثاني أكسيد الكربون إلى أول أكسيد الكربون. <ref>{{استشهاد بدورية محكمة|last=Sharma|first=Rakesh Kumar|last2=Yadav|first2=Priya|last3=Yadav|first3=Manavi|last4=Gupta|first4=Radhika|last5=Rana|first5=Pooja|last6=Srivastava|first6=Anju|last7=Zbořil|first7=Radek|last8=Varma|first8=Rajender S.|last9=Antonietti|first9=Markus|date=2020|title=Recent development of covalent organic frameworks (COFs): synthesis and catalytic (organic-electro-photo) applications|url=http://xlink.rsc.org/?DOI=C9MH00856J|journal=Materials Horizons|language=en|volume=7|issue=2|pages=411–454|DOI=10.1039/C9MH00856J|issn=2051-6347}}</ref> |
|||
ومع ذلك، فمن المعروف أن العديد من الأطر العضوية المعدنية يكون غير مستقر في الظروف الكيميائية والكهروكيميائية، مما يجعل من الصعب معرفة ما إذا كانت الأطر العضوية المعدنية هي في الواقع محفزات أم محفزات مبدئية . تحتاج المواقع النشطة الحقيقية للأطر العضوية المعدنية إلى دراسة وتحليل شامل أثناء التحفيز الكهربائي. <ref>{{استشهاد بدورية محكمة|last=Zheng|first=Weiran|last2=Liu|first2=Mengjie|last3=Lee|first3=Lawrence Yoon Suk|title=Electrochemical Instability of Metal–Organic Frameworks: In Situ Spectroelectrochemical Investigation of the Real Active Sites|journal=ACS Catalysis|date=3 January 2020|volume=10|issue=1|pages=81–92|DOI=10.1021/acscatal.9b03790}}</ref> |
|||
== بحث حول التحفيز الكهربائي == |
|||
=== انقسام الماء / إنتاج الهيدروجين === |
|||
== مراجع == |
|||
[[ملف:Hydrogen_fuel_cell_schematic.jpg|تصغير|450x450بك| رسم تخطيطي لخلية وقود الهيدروجين. لتزويد الهيدروجين، يتم استخدام تقسيم الماء بالتحفيز الكهربائي بشكل شائع.]] |
|||
{{مراجع}} |
|||
{{شريط بوابات|الكيمياء}} |
|||
[[تصنيف:تحفيز]] |
[[تصنيف:تحفيز]] |
||
نسخة 07:21، 7 سبتمبر 2023

المحفز الكهربائي هو محفز يشارك في التفاعلات الكهروكيميائية . المحفزات الكهربائية هي شكل محدد من المحفزات التي تعمل على أسطح الأقطاب الكهربائية أو في أغلب الأحيان قد تكون على سطح القطب الكهربائي نفسه. يمكن أن يكون المحفز الكهربائي غير متجانس مثل القطب الكهربائي المصفح . [1] تساعد المحفزات الكهربائية المتجانسة، القابلة للذوبان، في نقل الإلكترونات بين القطب والمواد المتفاعلة، و/أو تسهيل التحول الكيميائي الوسيط المذكور بواسطة نصف التفاعل الشامل. [2] تركز التحديات الرئيسية في المحفزات الكهربائية على خلايا الوقود . [3] [4]
المحفزات الكهربائية العملية
عملية الكلور القلوي
تعد عملية الكلور القلوي تطبيقًا واسع النطاق يستخدم المحفزات الكهربائية. توفر هذه التقنية معظم احتياجات الكلور وهيدروكسيد الصوديوم التي تحتاجها العديد من الصناعات. الكاثود عبارة عن أنود تيتانيوم مختلط بأكسيد المعدن (يُسمى أيضًا أنود مستقر الأبعاد). [5] [6]

الفلورة الكهربائية
يتم إنتاج العديد من مركبات الفلور العضوية عن طريق الفلورة الكهربائية . [7] أحد مظاهر هذه التقنية هي عملية سيمونز ، والتي يمكن وصفها بالمعادلة التالية:
- R3C–H + HF → R3C–F + H2
في سياق التوليف النموذجي يحدث هذا التفاعل مرة واحدة لكل رابطة C – H في المادة الأولية. يتم الحفاظ على [[جهد الخلية بالقرب من 5 – 6 فولت . ويكون الأنود - المحفز الكهربائي - مطلي بالنيكل .
Hydrodimerization من الأكريلونيتريل
يتم تحويل الأكريلونيتريل إلى أديبونيتريل على نطاق صناعي عن طريق التحفيز الكهربائي. [1]
الخلفية والنظرية
بشكل عام، المحفز هو عامل يزيد من سرعة التفاعل الكيميائي دون أن يستهلكه التفاعل. من جهة الديناميكا الحرارية، يعمل المحفز على تقليل طاقة التنشيط اللازمة لحدوث التفاعل الكيميائي. المحفز الكهربائي هو محفز يؤثر على طاقة التنشيط للتفاعل الكهروكيميائي. [8] تظهر أدناه طاقة تنشيط التفاعلات الكيميائية من حيث صلتها بطاقة المواد المتفاعلة وطاقة المنتجات. ترتبط طاقة التنشيط في العمليات الكهروكيميائية بالكمون ، أي الجهد، الذي يحدث عنده التفاعل. وبالتالي، فإن المحفزات الكهربائية كثيرًا ما تغير الكمون التي يتم عندها مشاهدة عمليات الأكسدة والاختزال. [9] وبدلاً من ذلك، يمكن اعتبار المحفز الكهربي عاملًا يسهل تفاعلًا كيميائيًا محددًا على سطح القطب. [10] وبالنظر إلى أن التفاعلات الكهروكيميائية تحدث عندما يتم تمرير الإلكترونات من نوع كيميائي إلى آخر، فإن التفاعلات الإيجابية على سطح القطب تزيد من احتمال حدوث التحولات الكهروكيميائية، وبالتالي تقليل الكمون المطلوب لتحقيق هذه التحولات. [10]

يمكن تقييم المحفزات الكهربائية وفقًا لثلاثة أرقام حسب الجدارة: النشاط، والاستقرار، والانتقائية. يمكن تقييم نشاط المحفزات الكهربائية كميًا من نعيين كثافة التيار المتولد، وبالتالي مدى سرعة حدوث التفاعل، بالنسبة لجهد تطبيقي معين. يتم وصف هذه العلاقة بمعادلة تافل . [8] في تقييم استقرار المحفزات الكهربائية، تعد قدرة المحفزات على تحمل الإمكانات التي تحدث عندها التحولات أمرًا بالغ الأهمية. تشير انتقائية المحفزات الكهربائية إلى تفاعلها التفضيلي مع ركائز معينة، وتوليدها لمنتج واحد. [8] يمكن تقييم الانتقائية كميًا من خلال معامل الانتقائية، الذي يقارن استجابة المادة للتحليل أو الركيزة المرغوبة مع الاستجابة للتداخلات الأخرى. [11]
في العديد من الأنظمة الكهروكيميائية، بما في ذلك الخلايا الجلفانية وخلايا الوقود وأشكال مختلفة من الخلايا الإلكتروليتية ، فإن العيب هو أنها يمكن أن تعاني من حواجز تنشيط عالية. يتم تحويل الطاقة للتغلب على حواجز التنشيط هذه إلى حرارة. في معظم تفاعلات الاحتراق الطاردة للحرارة، تقوم هذه الحرارة ببساطة بنشر التفاعل تحفيزيًا. في تفاعل الأكسدة والاختزال، تكون هذه الحرارة منتجًا ثانويًا عديم الفائدة في النظام. عادة ما يتم وصف الطاقة الإضافية المطلوبة للتغلب على الحواجز الكمونية من حيث انخفاض كفاءة الفاراديا و الجهد الزائدة العالي. [8] في هذه الأنظمة، سيتطلب كل من القطبين ونصف الخلية المرتبطة به محفزًا كهربائيًا مخصصًا له. [2]
التفاعلات النصفية التي تتضمن خطوات متعددة ، وعمليات متعددة لنقل الإلكترونات ، وتطور أو استهلاك الغازات في تحولاتها الكيميائية الشاملة، غالبًا ما يكون لها حواجز كبيرة في الديناميكا الحرارية . علاوة على ذلك، غالبًا ما يكون هناك أكثر من تفاعل محتمل على سطح القطب. على سبيل المثال، أثناء التحليل الكهربائي للماء ، يمكن للأنود أكسدة الماء من خلال "عملية ثنائية الإلكترون" إلى بيروكسيد الهيدروجين أو عملية رباعية الإلكترون للأكسجين. يمكن أن يؤدي وجود محفز كهربائي إلى تسهيل أي من مسارات التفاعل. [12]

المحفزات الكهربائية المتجانسة
المحفز الكهربائي المتجانس هو الذي يوجد في نفس الطور من المادة مثل المواد المتفاعلة، على سبيل المثال، مجمع تنسيق قابل للذوبان في الماء يحفز التحويل الكهروكيميائي في المحلول. [13] [14] ولا تمارس هذه التكنولوجيا تجاريا، ولكنها ذات أهمية بحثية.
معقدات التنسيق الاصطناعية
تحفز العديد من معقدات التنسيق التفاعلات الكهروكيميائية، [13] [14] ولكن المحفزات غير المتجانسة فقط هي التي لها قيمة تجارية.
الانزيمات
يمكن لبعض الإنزيمات أن تعمل كمحفزات كهربائية. [15] يمكن الاستفادة من إنزيم النيتروجين ،(انزيم نيتروجيناز ) ، وهو إنزيم يحتوي على عنقود MoFe، لتثبيت النيتروجين الجوي ، أي تحويل غاز النيتروجين إلى جزيئات مثل الأمونيا. يؤدي تثبيت البروتين على سطح القطب واستخدام وسيط إلكتروني إلى تحسين كفاءة هذه العملية بشكل كبير. [16] تعتمد فعالية المحفزات الكهربائية الحيوية عمومًا على سهولة نقل الإلكترون بين الموقع النشط للإنزيم وسطح القطب. [15] توفر الإنزيمات الأخرى نظرة ثاقبة لتطوير المحفزات الاصطناعية. على سبيل المثال ألهمت نازعة هيدروجين الفورمات ، وهو إنزيم يحتوي على النيكل، تطوير معقدات اصطناعية ذات هياكل جزيئية مماثلة لاستخدامها في تقليل ثاني أكسيد الكربون. [17] تعد خلايا الوقود الميكروبية طريقة أخرى يمكن من خلالها الاستفادة من الأنظمة البيولوجية في تطبيقات التحفيز الكهربائي. [15] [18] كما تعمل الأنظمة القائمة على الميكروبات على الاستفادة من المسارات الأيضية للكائن الحي بأكمله، بدلاً من نشاط إنزيم معين، مما يعني أنها قادرة على تحفيز نطاق واسع من التفاعلات الكيميائية. [15] يمكن لخلايا الوقود الميكروبية أن تستمد التيار الكهربي من أكسدة الركائز مثل الجلوكوز، [18] ويمكن الاستفادة منها في عمليات مثل خفض كميات ثاني أكسيد الكربون. [15]
المحفزات الكهربائية غير المتجانسة
المحفز الكهربائي غير المتجانس هو محفز يكون في طور من المادة مختلف عن المواد المتفاعلة، على سبيل المثال، سطح صلب يحفز التفاعل في المحلول. تظهر أعلاه باللون الأخضر أنواع مختلفة من مواد المحفز الكهربائي غير المتجانسة. نظرًا لأن تفاعلات التحفيز الكهربي غير المتجانسة تحتاج إلى نقل إلكترونات بين المحفز الصلب (عادةً فلز) والكهارل، والذي يمكن أن يكون محلولًا سائلًا - ولكن أيضًا بوليمر أو سيراميك قادر على التوصيل الأيوني - فإن ديناميكية التفاعل تعتمد على كل من المحفز والكهارل وكذلك على السطح البيني بينهما. [10] تحدد طبيعة سطح المحفز الكهربائي بعض خصائص التفاعل بما في ذلك معدل التفاعل والانتقائية. [10]
المواد الكتلية
يمكن أن يحدث التحفيز الكهربائي على سطح بعض المواد الكتلية، مثل معدن البلاتين. تم استخدام الأسطح المعدنية الكتلية من الذهب لتحلل الميثانول لإنتاج الهيدروجين. [2] يتم إجراء التحليل الكهربائي للماء بشكل تقليدي في أقطاب معدنية خاملة مثل البلاتين أو الإيريديوم. [19] يمكن ضبط نشاط المحفز الكهربي عن طريق تعديل كيميائي، مثل خلط معدنين أو أكثر في سبيكة. ويرجع ذلك إلى التغير في البنية الإلكترونية للسبيكة ، وخاصة في النطاق الإلكتروني d الذي يعتبر المسؤول عن الخواص التحفيزية للمعادن النبيلة. [20]
المواد النانوية
الجسيمات النانوية
لقد ثبت أن مجموعة متنوعة من مواد الجسيمات النانوية تعزز التفاعلات الكهروكيميائية المختلفة، [21] على الرغم من أنه لم يتم تسويق أي منها. يمكن ضبط هذه المحفزات يبعا لحجمها وشكلها، بالإضافة إلى ضغطها السطحي. [22]

يمكن أيضا تحقيق معدلات تفاعل أعلى من خلال التحكم الدقيق في ترتيب الذرات السطحية: في الواقع، في الأنظمة النانوية، يكون عدد مواقع التفاعل المتاحة أكثر من مساحة السطح المكشوفة في تقدير نشاط التحفيز الكهربائي. المواقع هي المواضع التي يمكن أن يحدث فيها التفاعل؛ يعتمد حدوث تفاعل في موقع معين على التركيب الإلكتروني للمحفز، والذي يحدد طاقة الامتزاز للمواد المتفاعلة بالإضافة إلى العديد من المتغيرات الأخرى التي لم يتم توضيحها بالكامل حتى الآن. [23]
وفقًا لنموذج TSK ، يمكن تصنيف ذرات سطح المحفز إلى ذرات مدرجة أو سلمية أو ملتوية وفقًا لموقعها، وتتميز كل منها برقم تنسيق مختلف. من حيث المبدأ، تميل الذرات ذات رقم التنسيق الأقل (وجود اختلالات في البنية والعيوب) إلى أن تكون أكثر تفاعلية، وبالتالي تمتز المواد المتفاعلة بسهولة أكبر: قد يؤدي هذا إلى تعزيز الحركية ولكن قد يؤدي أيضًا إلى خفضها إذا لم تكن الأنواع الممتزة هي المادة المتفاعلة، وبالتالي تعمل على تعطيل المحفز. إن التقدم في تكنولوجيا النانو يجعل من الممكن إجراء هندسة سطحية للمحفز بحيث تتعرض بعض المستويات البلورية المرغوبة فقط للمواد المتفاعلة، مما يزيد من عدد مواقع التفاعل الفعالة للتفاعل المطلوب. [21]
حتى الآن، لا يمكن صياغة آلية الاعتماد على سطح المحفز بشكل عام نظرًا لأن كل تأثير سطحي يكون بشدة محددًا بخاصية التفاعل. تم اقتراح بعض تصنيفات التفاعلات بناءً على اعتمادها السطحي [23] ولكن لا يزال هناك العديد من الاستثناءات التي لا تدخل في هذه التصنيفات.
تأثير حجم الجسيمات

أدى الاهتمام بتخفيض تكاليف المحفز للعمليات الكهروكيميائية قدر الإمكان إلى استخدام مساحيق المحفز الدقيقة حيث أن مساحة السطح المحددة تزداد مع تصغير حجم الجسيمات. على سبيل المثال، يعتمد تصميم خلايا الوقود والمحللات الكهربائية الأكثر شيوعًا على غشاء بوليمري مشحون في جسيمات البلاتين النانوية كمحفز كهربائي (فيما يسمى بالبلاتين الأسود ). [24]
على الرغم من أن نسبة مساحة السطح إلى حجم الجسيمات تعتبر بشكل شائع هي المعلمة الرئيسية التي تربط حجم المحفز الكهربائي بنشاطه، إلا أنه لفهم تأثير حجم الجسيمات، يجب أخذ العديد من الظواهر الأخرى في الاعتبار: [23]
- شكل التوازن : لأي حجم معين من الجسيمات النانوية، هناك شكل توازن معين يحدد بالضبط مستوياتها البلورية
- العدد النسبي لمواقع التفاعل : يتوافق حجم الجسيمات النانوية مع عدد معين من الذرات السطحية وبعضها فقط يستضيف موقع التفاعل
- البنية الإلكترونية : تحت حجم معين تتغير وظيفة عمل الجسيمات النانوية وتتلاشى بنية نطاقها النشط
- العيوب : الشبكة البلورية للجسيمات النانوية الصغيرة تكون مثالية؛ وبالتالي، فإن التفاعلات المعززة بالعيوب حيث تتباطأ مواقع التفاعل مع انخفاض حجم الجسيمات
- الاستقرار : تميل الجسيمات النانوية الصغيرة إلى فقدان كتلتها بسبب انتشار ذراتها نحو جزيئات أكبر، وفقًا لظاهرة نضج أوستفالد .
- عوامل التغطية : من أجل تثبيت الجسيمات النانوية، من الضروري وجود طبقة تغطية، وبالتالي فإن جزءًا من سطحها يكون غير متاح للمواد المتفاعلة
- الدعم : غالبًا ما يتم تثبيت الجسيمات النانوية على دعامة من أجل البقاء في مكانها، وبالتالي لا يكون جزء من سطحها متاحًا للمواد المتفاعلة.
المواد المعتمدة على الكربون
يمكن استخدام أنابيب الكربون النانوية والمواد المعتمدة على الجرافين كمحفزات كهربائية. [25] إن الأسطح الكربونية للجرافين وأنابيب الكربون النانوية مناسبة تمامًا لامتصاص العديد من الأنواع الكيميائية، والتي يمكن أن تعزز تفاعلات تحفيزية كهربائية معينة. [26] بالإضافة إلى ذلك، فإن موصليتها تعني أنها مواد إلكترودات (أقطاب كهربية) جيدة. [26] تتمتع الأنابيب النانوية الكربونية بمساحة سطحية عالية جدًا، مما يزيد من المواقع السطحية التي يمكن أن تحدث فيها التحولات الكهروكيميائية. [27] يمكن أن يعمل الجرافين أيضًا كمنصة لبناء المركبات باستخدام أنواع أخرى من المواد النانوية مثل المحفزات ذات الذرة الواحدة. [28] بسبب موصليتها، يمكن للمواد المعتمدة على الكربون أن تحل محل الأقطاب الكهربائية المعدنية لإجراء التحفيز الكهربائي الخالي من المعادن. [29]
مواد الإطار
يمكن استخدام الأطر المعدنية العضوية (MOFs) ، وخاصة الأطر الموصلة، كمحفزات كهربائية لعمليات مثل تقليل ثاني أكسيد الكربون وانشطار الماء . توفر الأطر العضوية المعدنية مواقع نشطة محتملة في كل من المراكز المعدنية ومواقع الروابط العضوية. [30] ويمكن أيضًا تشغيلها أو تغليف بمواد أخرى مثل الجسيمات النانوية. [30] ويمكن أيضًا دمج الأطر العضوية المعدنية مع مواد قائمة على الكربون لتكوين محفزات كهربائية. [31] يمكن أيضًا استخدام الأطر العضوية التساهمية (COFs) ، خاصة تلك التي تحتوي على معادن، كمحفزات كهربائية. أظهرت COFs المبنية من بورفيرينات الكوبالت القدرة على تقليل ثاني أكسيد الكربون إلى أول أكسيد الكربون. [32]
ومع ذلك، فمن المعروف أن العديد من الأطر العضوية المعدنية يكون غير مستقر في الظروف الكيميائية والكهروكيميائية، مما يجعل من الصعب معرفة ما إذا كانت الأطر العضوية المعدنية هي في الواقع محفزات أم محفزات مبدئية . تحتاج المواقع النشطة الحقيقية للأطر العضوية المعدنية إلى دراسة وتحليل شامل أثناء التحفيز الكهربائي. [33]
بحث حول التحفيز الكهربائي
انقسام الماء / إنتاج الهيدروجين

- ^ أ ب Kotrel، Stefan؛ BrUninger، Sigmar (2008). "Industrial Electrocatalysis". Handbook of Heterogeneous Catalysis. DOI:10.1002/9783527610044.hetcat0103. ISBN:978-3527312412.
- ^ أ ب ت Roduner, Emil (13 Jun 2017). "Selected fundamentals of catalysis and electrocatalysis in energy conversion reactions—A tutorial". Catalysis Today (بالإنجليزية). 309: 263–268. DOI:10.1016/j.cattod.2017.05.091. وسم
<ref>غير صالح؛ الاسم ":9" معرف أكثر من مرة بمحتويات مختلفة. - ^ Debe، Mark K. (2012). "Electrocatalyst approaches and challenges for automotive fuel cells". Nature. ج. 486 ع. 7401: 43–51. Bibcode:2012Natur.486...43D. DOI:10.1038/nature11115. PMID:22678278.
- ^ Jiao، Yan؛ Zheng، Yao؛ Jaroniec، Mietek؛ Qiao، Shi Zhang (2015). "Design of electrocatalysts for oxygen- and hydrogen-involving energy conversion reactions". Chemical Society Reviews. ج. 44 ع. 8: 2060–2086. DOI:10.1039/C4CS00470A. PMID:25672249.
- ^ Over، Herbert (2012). "Surface Chemistry of Ruthenium Dioxide in Heterogeneous Catalysis and Electrocatalysis: From Fundamental to Applied Research". Chemical Reviews. ج. 112 ع. 6: 3356–3426. DOI:10.1021/cr200247n. PMID:22423981.
- ^ Landolt, D.؛ Ibl, N. (1972). "Anodic Chlorate Formation on Platinized Titanium". Chapman and Hall Ltd. ج. 2 ع. 3: 201–210. DOI:10.1007/BF02354977.
- ^ Siegemund، Günter؛ Schwertfeger، Werner؛ Feiring، Andrew؛ Smart، Bruce؛ Behr، Fred؛ Vogel، Herward؛ McKusick، Blaine (2005)، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.a11_349
- ^ أ ب ت ث Jaramillo، Tom (3 سبتمبر 2014). "Electrocatalysis 101 | GCEP Symposium - October 11, 2012". Youtube.com.
{{استشهاد ويب}}: صيانة الاستشهاد: url-status (link) - ^ Bard، Allen J.؛ Larry R. Faulkner (2001). Electrochemical methods: fundamentals and applications (ط. Second). Hoboken, NJ. ISBN:0-471-04372-9. OCLC:43859504.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link) - ^ أ ب ت ث McCreery, Richard L. (Jul 2008). "Advanced Carbon Electrode Materials for Molecular Electrochemistry". Chemical Reviews (بالإنجليزية). 108 (7): 2646–2687. DOI:10.1021/cr068076m. ISSN:0009-2665. PMID:18557655. وسم
<ref>غير صالح؛ الاسم ":5" معرف أكثر من مرة بمحتويات مختلفة. - ^ Brown, Micah D.; Schoenfisch, Mark H. (27 Nov 2019). "Electrochemical Nitric Oxide Sensors: Principles of Design and Characterization". Chemical Reviews (بالإنجليزية). 119 (22): 11551–11575. DOI:10.1021/acs.chemrev.8b00797. ISSN:0009-2665. PMID:31553169.
- ^ Bard، Allen J.؛ Faulkner، Larry R. (يناير 2001). Electrochemical methods: fundamentals and applications. New York: Wiley. ISBN:978-0-471-04372-0. اطلع عليه بتاريخ 2009-02-27.
- ^ أ ب ت Artero, Vincent; Chavarot-Kerlidou, Murielle; Fontecave, Marc (1 Aug 2011). "Splitting Water with Cobalt". Angewandte Chemie International Edition (بالإنجليزية). 50 (32): 7238–7266. DOI:10.1002/anie.201007987. PMID:21748828.
- ^ أ ب ت Kinzel, Niklas W.; Werlé, Christophe; Leitner, Walter (19 Jan 2021). "Transition Metal Complexes as Catalysts for the Electroconversion of CO 2 : An Organometallic Perspective". Angewandte Chemie International Edition (بالإنجليزية). 60 (21): 11628–11686. DOI:10.1002/anie.202006988. ISSN:1433-7851. PMID:33464678.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help) - ^ أ ب ت ث ج Chen, Hui; Simoska, Olja; Lim, Koun; Grattieri, Matteo; Yuan, Mengwei; Dong, Fangyuan; Lee, Yoo Seok; Beaver, Kevin; Weliwatte, Samali (9 Dec 2020). "Fundamentals, Applications, and Future Directions of Bioelectrocatalysis". Chemical Reviews (بالإنجليزية). 120 (23): 12903–12993. DOI:10.1021/acs.chemrev.0c00472. ISSN:0009-2665. PMID:33050699.
- ^ Milton, Ross D.; Minteer, Shelley D. (17 Dec 2019). "Nitrogenase Bioelectrochemistry for Synthesis Applications". Accounts of Chemical Research (بالإنجليزية). 52 (12): 3351–3360. DOI:10.1021/acs.accounts.9b00494. ISSN:0001-4842. PMID:31800207.
- ^ Yang, Jenny Y.; Kerr, Tyler A.; Wang, Xinran S.; Barlow, Jeffrey M. (18 Nov 2020). "Reducing CO 2 to HCO 2 – at Mild Potentials: Lessons from Formate Dehydrogenase". Journal of the American Chemical Society (بالإنجليزية). 142 (46): 19438–19445. DOI:10.1021/jacs.0c07965. ISSN:0002-7863. PMID:33141560.
- ^ أ ب Qiao, Yan; Bao, Shu-Juan; Li, Chang Ming (2010). "Electrocatalysis in microbial fuel cells—from electrode material to direct electrochemistry". Energy & Environmental Science (بالإنجليزية). 3 (5): 544. DOI:10.1039/b923503e. ISSN:1754-5692.
- ^ Carmo, Marcelo; Fritz, David L.; Mergel, Jürgen; Stolten, Detlef (14 Mar 2013). "A comprehensive review on PEM water electrolysis". International Journal of Hydrogen Energy (بالإنجليزية). 38 (12): 4901–4934. DOI:10.1016/j.ijhydene.2013.01.151.
- ^ Mistry، H.؛ Varela، A.S.؛ Strasser، P.؛ Cuenya، B.R. (2016). "Nanostructured electrocatalysts with tunable activity and selectivity". Nature Reviews Materials. ج. 1 ع. 4: 1–14. Bibcode:2016NatRM...116009M. DOI:10.1038/natrevmats.2016.9.
- ^ أ ب Kleijn, Steven E. F.; Lai, Stanley C. S.; Koper, Marc T. M.; Unwin, Patrick R. (1 Apr 2014). "Electrochemistry of Nanoparticles". Angewandte Chemie International Edition (بالإنجليزية). 53 (14): 3558–3586. DOI:10.1002/anie.201306828. PMID:24574053. وسم
<ref>غير صالح؛ الاسم ":0" معرف أكثر من مرة بمحتويات مختلفة. - ^ Luo, Mingchuan; Guo, Shaojun (26 Sep 2017). "Strain-controlled electrocatalysis on multimetallic nanomaterials". Nature Reviews Materials (بالإنجليزية). 2 (11): 17059. DOI:10.1038/natrevmats.2017.59. ISSN:2058-8437.
- ^ أ ب ت Koper، M.T.M. (2011). "Structure sensitivity and nanoscale effects in electrocatalysis". The Royal Society of Chemistry. ج. 3 ع. 5: 2054–2073. Bibcode:2011Nanos...3.2054K. DOI:10.1039/c0nr00857e. PMID:21399781. وسم
<ref>غير صالح؛ الاسم "10.1039/c0nr00857e" معرف أكثر من مرة بمحتويات مختلفة. - ^ Carmo، M.؛ Fritz، D.L.؛ Mergel، J.؛ Stolten، D. (2013). "A comprehensive review on PEM water electrolysis". International Journal of Hydrogen Energy. ج. 38 ع. 12: 4901–4934. DOI:10.1016/j.ijhydene.2013.01.151.
- ^ Wang، Xin (19 يناير 2008). "CNTs tuned to provide electrocatalyst support". Nanotechweb.org. مؤرشف من الأصل في 2009-01-22. اطلع عليه بتاريخ 2009-02-27.
- ^ أ ب McCreery, Richard L. (17 Jun 2008). "Advanced Carbon Electrode Materials for Molecular Electrochemistry". Chemical Reviews (بالإنجليزية). 108 (7): 2646–2687. DOI:10.1021/cr068076m. ISSN:0009-2665. PMID:18557655.
- ^ Wildgoose, Gregory G.; Banks, Craig E.; Leventis, Henry C.; Compton, Richard G. (30 Nov 2005). "Chemically Modified Carbon Nanotubes for Use in Electroanalysis". Microchimica Acta (بالإنجليزية). 152 (3–4): 187–214. DOI:10.1007/s00604-005-0449-x. ISSN:0026-3672.
- ^ Zhang، Qin؛ Zhang، Xiaoxiang؛ Wang، Junzhong؛ Wang، Congwei (15 يناير 2021). "Graphene-supported single-atom catalysts and applications in electrocatalysis". Nanotechnology. ج. 32 ع. 3: 032001. DOI:10.1088/1361-6528/abbd70. ISSN:0957-4484. PMID:33002887.
- ^ Dai, Liming (13 Jun 2017). "Carbon-based catalysts for metal-free electrocatalysis". Current Opinion in Electrochemistry (بالإنجليزية). 4 (1): 18–25. DOI:10.1016/j.coelec.2017.06.004.
- ^ أ ب Jiao, Long; Wang, Yang; Jiang, Hai-Long; Xu, Qiang (27 Nov 2017). "Metal-Organic Frameworks as Platforms for Catalytic Applications". Advanced Materials (بالإنجليزية). 30 (37): 1703663. DOI:10.1002/adma.201703663. PMID:29178384.
- ^ Singh, Chanderpratap; Mukhopadhyay, Subhabrata; Hod, Idan (5 Jan 2021). "Metal–organic framework derived nanomaterials for electrocatalysis: recent developments for CO2 and N2 reduction". Nano Convergence (بالإنجليزية). 8 (1): 1. DOI:10.1186/s40580-020-00251-6. ISSN:2196-5404. PMID:33403521.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Sharma, Rakesh Kumar; Yadav, Priya; Yadav, Manavi; Gupta, Radhika; Rana, Pooja; Srivastava, Anju; Zbořil, Radek; Varma, Rajender S.; Antonietti, Markus (2020). "Recent development of covalent organic frameworks (COFs): synthesis and catalytic (organic-electro-photo) applications". Materials Horizons (بالإنجليزية). 7 (2): 411–454. DOI:10.1039/C9MH00856J. ISSN:2051-6347.
- ^ Zheng، Weiran؛ Liu، Mengjie؛ Lee، Lawrence Yoon Suk (3 يناير 2020). "Electrochemical Instability of Metal–Organic Frameworks: In Situ Spectroelectrochemical Investigation of the Real Active Sites". ACS Catalysis. ج. 10 ع. 1: 81–92. DOI:10.1021/acscatal.9b03790.
