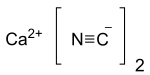سيانيد الكالسيوم
| سيانيد الكالسيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
calcium dicyanide |
|
| المعرفات | |
| CAS | 592-01-8 |
| بوب كيم | 11590 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | Ca(CN)2 |
| الكتلة المولية | 92.11 غ/مول |
| المظهر | مسحوق أبيض |
| الكثافة | 1.85 غ/سم3 |
| نقطة الانصهار | >300 °س (يتفكك) |
| الذوبانية في الماء | منحل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
سيانيد الكالسيوم مركب كيميائي صيغته Ca(CN)2، ويوجد على شكل مسحوق بلوري أبيض اللون.
ينتمي المركب إلى مجموعة مركبات السيانيد السامة.[2]
التحضير[عدل]
يحضر المركب من تفاعل إدخال النتروجين إلى كربيد الكالسيوم عند درجات حرارة مرتفعة تتجاوز 1000 °س، وهو تفاعل ناشر للحرارة:
كما يستحصل على المركب ناتجاً ثانوياً من عملية تحضير سياناميد الكالسيوم.[3]
يمكن تحضير محلول من سيانيد الكالسيوم من تفاعل حمض السيانيك مع هيدروكسيد الكالسيوم:[4]
الخواص[عدل]
يوجد المركب في الشروط القياسية على شكل مسحوق بلوري أبيض اللون، وهو ذو انحلالية جيدة في الماء، كما ينحل في الإيثانول.[5]
يتفاعل المركب بالتماس مع الرطوبة بتفاعل حلمهة محرراً سيانيد الهيدروجين؛ ولتثبيته يمزج مع سيانيد الصوديوم بنسبة حوالي 45-50% من الأخير، مع وجود 1-2% من الفحم؛ ويعرف الخليط في الأوساط التجارية باسم «السيانيد الأسود».
الاستخدامات[عدل]
يستخدم سيانيد الكالسيوم في تعدين الذهب والفضة من خاماتها.[6] كما يمكن أن يستخدم مبيداً للقوارض.[7]
مراجع[عدل]
- ^ أ ب ت CALCIUM CYANIDE (بالإنجليزية), QID:Q278487
- ^ Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo and Manfred Sauer "Cyano Compounds, Inorganic" Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2004. دُوِي:10.1002/14356007.a08_159.pub2
- ^ موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
- ^ Gail, E., Gos, S., Kulzer, R., Lorösch, J., Rubo, A., Sauer, M., Kellens, R., Reddy, J., Steier, N. und Hasenpusch, W (2011). "Cyano Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. DOI:10.1002/14356007.a08_159.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله يقترح استخدام|تاريخ=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0
- ^ "Use of Cyanide in the Gold Industry". International Cyanide Management Institute. مؤرشف من الأصل في 29 فبراير 2012. اطلع عليه بتاريخ 30. Juli 2011.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Pradyot Patnaik: A Comprehensive Guide to the Hazardous Properties of Chemical Substances. Wiley, 2008, ISBN 978-0-470-13494-8