إيثانول
| إيثانول | |
|---|---|
| الاسم النظامي (IUPAC) | |
إيثانول |
|
| أسماء أخرى | |
كحول إيثيلي، كحول |
|
| المعرفات | |
| رقم CAS | 64-17-5 |
| بوب كيم | 702 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C2H5-OH |
| الكتلة المولية | 46.07 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.789 غ/سم3 |
| نقطة الانصهار | - 114.3 °س |
| نقطة الغليان | 78.4 °س |
| الذوبانية في الماء | كامل الامتزاج |
| حموضة (pKa) | 16 [2] |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الإيثانول أو الكحول الإيثيلي، وهو مركب كيميائي عضوي ينتمي إلى فصيلة الكحوليات له الصيغة الكيميائية: C2H5OH و صيغته الجزئية C2H6O ويسمى الكحول تعميماً. الايثانول مادة قابلة للاشتعال عديمة اللون تتكون من تخمر السكر، يستعمل في المشروبات الكحولية وفي صناعة العطور ويستعمل كوقود في المحركات الميكانيكية المجهزة للإيثانول.
أصل التسمية[عدل]
الإيثانول هو الاسم النظامي حسب الاتحاد الدولي للكيمياء البحتة والتطبيقية لجزيء يتكون من ذرتي كربون و (البادئة «ايث-»)، تعني وجود روابط و بينهما (لاحقة «- انو»)، والمجموعة المرافقة -OH و (لاحقة«ول»)[3]
مصطلح 'ايثيل' هو إصدارة إنجليزية من الكلمة الألمانية äthyl، التي صيغت في عام 1838 بواسطة «ليبج». وعلى غرار ذلك مصطلح المتصل «ميثيل» على حد سواء حيث نشأ من اليونانية، ومشاركة الجزء 'يل'، الذي يعادل 'hyle' وتعنى مادة . ومع ذلك، فإن الجزء السابق يختلف - 'ETH'، أي ما يعادل 'aither'، وهذا يعني الأثير. وبالتالي فإن كلمة «الإيثيل» هي اختصار 'aither hyle' .[4] استخدم «ليبج» مصطلح «الكحول الإيثيلي» للتمييز بين الإيثانول والكحولات الأخرى.
مصطلح «الكحول» الآن يشير إلى فئة مواد أوسع تسمية في الكيمياء ، ولكن في اللغة العامة فإنه لا يزال اسم الايثانول. في نهاية المطاف قرضا من القرون الوسطى العربية آل كوهل ,[5] استخدامالكحول بهذا المعنى استحدث في منتصف القرن 18. قبل الفترة، اللاتينية الوسطى الكحول كان يشير إلى «خام مسحوق الأنتيمون؛ مسحوق التجميل»، وبحلول القرن 17 لاحقا «بالمادة المتسامية ؛ الروح المقطر» واستخدام ل «روح النبيذ» (مختصر عن التعبير التام كحول النبيذ) تم تسجيلها 1753. واستخدامه منهجيا في مجال الكيمياء يعود إلى عام 1850.
الصيغة الكيميائية[عدل]
الإيثانول هو كحول ثنائي (2) الكربون وصيغته الجزئية C 2 H 6 O
CH3CH2OH
CH3–CH2–OH
التاريخ[عدل]
الخواص[عدل]
الخواص الفيزيائية[عدل]

مركب قطبي يمتاز بخاصية تكوين الرابطة الهيدروجينية بين جزيئاته حيث انه يحتوي على مجموعة الهيدروكسيل التي تعمل على تزايد تماسك الروابط . سائل لا لون له قابل للتطاير · كثافته النوعية .816· يغلي بالدرجة 80 مْ يذوب في المذيبات القطبية كالماء حيث انه يكون مع الماء روابط هيدروجينية . يحترق بلهب أزرق عديم الدخان وهو ليس دائما مرئيا في الضوء الطبيعي. الإيثانول هو أكثر قليلا من الماء انكسارا، و معامل انكساره بين 1.36242 (λ = 589.3 في نانومتر و 18.35 °C).[6]
خواصه كمذيب[عدل]
الإيثانول هو مذيب يمتزج مع عدد من المذيبات ، قابل للامتزاج مع الماء ومع العديد من المذيبات العضوية، بما في ذلك حمض الخليك، الاسيتون، البنزين، رابع كلوريد الكربون، الكلوروفورم، الايثر، جلايكول اثيلين، الجلسرين، نتروميتان، بيريدين، و التولوين[6][7] وهو أيضا قابل للامتزاج مع الهيدروكربونات الأليفاتية الخفيفة، مثل بنتان وهكسان، ومع الكلوريدات الأليفاتية مثل ثلاثي كلورو الإيثان ورابع كلور الإيثيلين.[7] امتزاج الإيثانول مع الماء يتناقض مع عدم امتزاج الكحولات طويلة السلسلة (خمسة أو أكثر ذرة كربون)، و قابلية الامتزاج المائية تقلل بشكل حاد مع زيادة عدد ذرات الكربون. .[8] وامتزاج الإيثانول مع الالكانات يقتصر على الألكانات يصل إلى [غيرديكان]والمزائج مع الدوديكان . وتظهر الألكانات العليا الدوديكان فجوة قابلية الامتزاج تحت درجة حرارة معينة (حوالي 13 درجة مئوية[9]).

التصنيع[عدل]
يصنع الإيثانول بطريقتين:
البتروكيماوية[عدل]
عن طريق التجفيف الاثيليني و(2) بشكل طبيعي عن طريق تخمير السكر اثيليني مادة خام تستخدم في المصانع مصنعة من مادة بتروكيماوية عادة من حمض منشط.
- C2H4 + H2SO4 → CH3 CH2 SO4H و
- CH3 CH2 SO4H + H2O → CH3CH2OH + H2SO4
التخمير[عدل]
الإيثانول المستعمل في المشروبات الكحولية ومعظمه المستعمل في محركات السيارات ذات تقنية تسمح بتشغيل المحرك بالإيثانول وأهم نقطة في هذا النظام هو الوصول إلى بكتيريا التعفن للتضاعفها وانعدام الأكسجين.
- C6 H12 O6 → 2 CH3 CH2 OH + 2 CO2
الخصائص السامة على الجسم[عدل]
هناك أربع خصائص يجب أن تأخذ في الاعتبار عند دراسة الاعراض السامة لكحول الإيثانول (التوزيع، الامتصاص، وظيفة الاعضاء، والتصفية) يمتص الإيثانول بسرعة عن طريق الامعاء ويضخ بشكل متوازي إلى جميع الاعضاء والأنسجة عن طريق الدم ويمر بشكل رئيس إلى الكبد. إن محاليل الإيثانول المطلق و الإيثانول المائي تستخدم بشكل واسع في مختلف الأشكال الصيدلانية و مستحضرات التجميل و يستخدم في صناعة المشروبات الكحولية. يمتص بسرعة من القناة الهضمية و أبخرته يمكن أن تنفذ عبر الرئتين، يُستقلب بشكل رئيسي في الكبد إلى الأست ألدهيد الذي بدوره يتأكسد لاحقاً إلى أسيتات. يعد الإيثانول مثبطاً للجملة العصبية المركزية (C.N.S) حيث إن تناول كميات قليلة إلى معتدلة قد تقود إلى ظهور أعراض انسمام تتمثل بعدم تناسق عمل العضلات، ضعف في الرؤية، تلعثم النطق . . . . إلخ. أما تناول كميات كبيرة (أو تراكيز كبيرة) قد يحدث تثبيطاً للمنعكسات البصلية كالنعاس lethargy، النسيان و ضعف الذاكرة amnesia انخفاض درجة الحرارة، انخفاض سكر الدم، ذهول أو انشداه stupor، فقدان الوعي coma، تثبيط التنفس، وهط ( انخفاض ) قلبي وعائي Cordiouascular Collapse. إن التركيز المميت للكحول في الدم يقدر بـ 400-500 ملغ/100مل. و على الرغم من أن أعراض الانسمام الكحولي تلاحظ عادة لدى متعاطي المشروبات الكحولية إلا أنه من الممكن ظهور هذه الأعراض لدى تناول المستحضرات الصيدلانية الحاوية عليه كمادة محلّة وذلك إذا أخذ بكميات كبيرة. لقد تم تحضير مستحضرات حقنية تحوي حتى 50% كحول ( 95% - 96% حجم/حجم ) على أية حال فأن بعض التراكيز منه قد تحدث ألماً أثناء الحقن العضلي، و التراكيز الأقل من 10.5% حجم/حجم هي المفضلة. يسبب حقنه تحت الجلد ألماً ملحوظاً متبوعاً بحس خدر، و إذا حقن قريباً من العصب فقد يتسبب ذلك بالتهاب الأعصاب و تلف الأعصاب nerve degeneration. إن هذا التأثير قد وضع في المعالجة لإحداث خدر في حالات الألم الشديد على الرغم من أن تطبيق هذه العملية في حصار العصب هي موضع خلاف في وجهات النظر، حيث استخدمت جرعات قدرها /1مل/ من الكحول المطلق لهذا الغرض. إن المستحضرات الحاوية على أكثر من 50% كحول حجم/حجم قد تسبب تهيجاً جلدياً لدى تطبيقها موضعياً. LD50 ( guinea pig, IP ) = 3.41 g/kg LD50 ( guinea pig, IV ) = 2.3 g/kg LD50 ( mouse, IP ) = 0.93 g/kg LD50 ( guinea pig, oral ) = 7.5 g/kg LD50 ( rabbit, IP ) = 0.96 g/kg LD50 ( rabbit, oral ) = 6.3 g/kg LD50 ( rat, IV ) = 1.44 g/kg LD50 ( guinea pig, oral ) = 5.56 g/kg LD50 ( hamster, IP ) = 5.07 g/kg LD50 ( mouse, IV ) = 1.97 g/kg LD50 ( mouse, SC ) = 8.29 g/kg LD50 ( rabbit, IV ) = 2.37 g/kg LD50 ( rat, IP ) = 3.75 g/kg LD50 ( rat, oral ) = 7.06 g/kg[10]
استعماله[عدل]
- يستخدم كمادة مذيبة في الصناعة الدوائية لتحضير الخلاصات الكحولية والصبغات الكحولية
- يستخدم كمادة مطهرة موضعية .
- يدخل في بناء المشروبات الكحولية
عدا استعماله في مواد التعقيم والمشروبات المسكرة
- يستعمل كوقود للمحركات ففي البرازيل أكبر مخازن ومحطات وقود في العالم تنتج وتستهلك الايثانول كوقود للسيارات والطائرات ذات الوزن الخفيف وبقرار من الحكومة البرازيلية يجب أن يمزج 25% من الايثانول بكل 1لتر بنزين لتخفيض تكلفته والتقليل من تلوث البترول. اليوم أكثر من 50% من السيارات في البرازيل مجهزة لتعمل على البنزين والايثانول ويسمى محرك فليكس.
الوجود في الطبيعة[عدل]
الإيثانول منتج ثانوي ينجم من عملية أيض الخميرة. وعلى هذا النحو، سيكون الإيثانول متواجد في مواطن الخميرة. و عموما الإيثانول يمكن العثور عليه في الفاكهة الناضجة .[11]
المخططات البيانية[عدل]

|

|
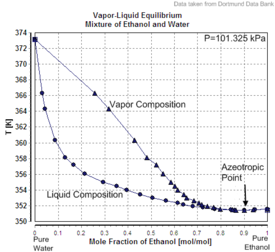
|
| حجم الزيادة في خليط من الإيثانول والماء (تقلص حجم) | حرارة خلط في خليط من الإيثانول والماء | توازن بخار السائل في خليط من الايثانول والمياه (بما في ذلك حالة الأيزوتروب) |

|

|
|
| حالة توازن المكونات الصلبة والسائلة في خليط من الايثانول والمياه (بما في ذلك نظام أصهري) | فجوة امتزاج في خليط من الإيثانول والدوديكان |
المراجع[عدل]
- ^ أ ب ت ethanol (بالإنجليزية), QID:Q278487
- ^ http://openmopac.net/pKa_table.html.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة) والوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة) - ^ USA (6 مارس 2012). "Ethanol – PubChem". Pubchem.ncbi.nlm.nih.gov. مؤرشف من الأصل في 2014-10-12. اطلع عليه بتاريخ 2012-04-23.
- ^ Harper, Douglas. "ethyl". قاموس علم اشتقاق الألفاظ.
- ^ قاموس أكسفورد الإنجليزي; قاموس علم اشتقاق الألفاظ "نسخة مؤرشفة" (PDF). مؤرشف من الأصل (PDF) في 2014-02-02. اطلع عليه بتاريخ 2013-07-08.
- ^ أ ب Lide, D. R.، المحرر (2000). CRC Handbook of Chemistry and Physics 81st edition. CRC press. ISBN:0-8493-0481-4.
- ^ أ ب Windholz, Martha (1976). The Merck index: an encyclopedia of chemicals and drugs (ط. 9th). Rahway, N.J., U.S.A: Merck. ISBN:0-911910-26-3. مؤرشف من الأصل في 2022-03-24.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson (1972). Organic Chemistry (ط. 2nd). Allyn and Bacon, inc. ISBN:0-205-08452-4.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Dahlmann U, Schneider GM (1989). "(Liquid + liquid) phase equilibria and critical curves of (ethanol + dodecane or tetradecane or hexadecane or 2,2,4,4,6,8,8-heptamethylnonane) from 0.1 MPa to 120.0 MPa". J Chem Thermodyn. ج. 21 ع. 9: 997. DOI:10.1016/0021-9614(89)90160-2.
- ^ Handbook of Pharmaceutical Excipients SIXTH EDITION Edited by Raymond C Rowe BPharm, PhD, DSC, FRPharmS, FRSC, CPhys, MInstP Chief Scientist Intelligensys Ltd, Stokesley, North Yorkshire, UK Paul J Sheskey BSc, RPh Application Development Leader The Dow Chemical Company, Midland, MI, USA Marian E Quinn BSc, MSc Development Editor Royal Pharmaceutical Society of Great Britain, London, UK
- ^ Dudley, Robert (2004). "Ethanol, Fruit Ripening, and the Historical Origins of Human Alcoholism in Primate Frugivory". Integrative Comparative Biology. ج. 44 ع. 4: 315–323. DOI:10.1093/icb/44.4.315.
الوصلات الخارجية[عدل]
| في كومنز صور وملفات عن: إيثانول |
- إيثانول
- أكسجينات
- ألكانولات
- تخدير
- ذيفانات الكبد
- كحولات
- كحولات أولية
- ماسخات
- مانعات العفونة
- مئيضات بشرية
- مبيدات آفات
- مبيدات الجراثيم
- مسرطنات المجموعة 1 حسب تصنيف الوكالة الدولية لأبحاث السرطان
- مطهرات
- معدلات تفارغية موجبة لمستقبل غابا أ
- مناهضات مستقبل ن-مثيل-د-أسبارتات
- مواد كيميائية أولية
- مواد كيميائية منزلية
- وقود الصواريخ




